






















’5 3/f1
BỘ Y TẾ
CỤC QUẢN LÝ DƯỢC
!
PREPRESS - 1NFORMATION
I .
U ' ' ' 0 ' CUSTOMER
" ,= - f ( Contro Proof New Proof Corrections
Fermat 52 x 18 x 13 nỊ.fflÌ ddll.……… ..…Tun ...………I
Regnster Nl'. 86.4.2 8 Date: Date: Date:
NP 7812
25.03_2009 15:39:34 Wsa: ............................ \fisa: ............................ Visa: ............................
Grundschrlft 7 Punkt
OK for Printing Control File OK for Printing
Date: Date: Date:
Visa: ............................ Visa: ............................ Visa: ............................
10107171 FE 10107171 FE 10107171 FE iUiur'i " Hỉ
FILM 1 VON 4 FILM 2VON 4 FILM 3 VON 4 Fh N~ -x \r"JN …
Schwanz PMS 300 PMS 327 PMS -_i…
25.03.09 25.03.09 25.03.09 z~ »i nạ
Medicine: keep out of reach of children ! caps. = 75 mg osettamivir.
Dosage and administrat'mn: see package insert sub torma oscltamlvir. phosphai.
Do not store above 25 °C
'd
4..—
1 viên nang = 75 mg oultImlvlr THUỐC CHI BẤN TỤEO ĐơN.
duới đạng muó: hosphat ĐỂ XA ~_rAM TAY CUA TR_Ể EM. _
Dùng đường u ng ĐỌC KY HƯỞNG DĂN sư DỤNG TRƯỜC KHI DUNG .
Hộp chứa 10 viên nang trcng 1 vi
56 đảng ký : VN—
Chỉđmh. chóng chidinh. liều về cách dùng: xin xem
trong từ hướng dẫn sữ dụng Sân xuất tại Thuỵ Sỹ bởi
F.Hoffmann-La Roche Ltd.
Báo quán ở nhiệt độ duời 30 °C. 124 Grenzacherstrasse. CH-4070 Basel
Dưới sự cho phẻp cũa: Gìlead Sciences.
NSX, HD, sô ló SX: xe… phân MFD. EXP. Betch No Thánh phô Foster. California, Mỹ
in trẻn bao bi. Ngảy SX vá ngảy hết han lả ngáy 01
của tháng Nhé nhảp khấu:
& I
Tamtflu®
Oseltamivir Nsuyễn Thị Minh Thảo
Cử 10 capsules
r —x\
Tamlflu'
Oseltamivir
CB 10
Ạị Tamiflu® <“ỄỒ Tamiflu® <Ể> Tamiflu® ịý
Oseltamivir Oseltamivir Oseltamivir
75 m , 75 mg _ 75 m
ỉ Tamuflu® … _ Tamthu® ỉ 3
<ì'ìò Oseltamivir <ỦỒ Oseltamivir ỔẾỂ> ;
75 mg 75 mg Ễ
Tamiflu® Ổ Tamiflu® Tamiflu® s
Oseltamivir Ẹ“ Oseltamivir @) Oseltamivir ễ
15 m _ 15 m _ vs mg i:
.9— Tamthu® g Tamthu® _
Ố°l*> Oseltamivir Oseltamivir <Ề>
75 mg 75 mg
Tamiflu® ’— Tamiflu® Tamiflu®
_ Oseltamivir ử> Oseltamivir Rư" Oseltamivir — .’.1
75 m , 75 m , 75 m ~. _,—-'²
i Tamthu® i Tamthu® -g_ @
ỞL"²> Oseltamivir <ỄÉÉ> Oseltamivir ỔẺẺ> Ở
5 mg 75 mg 9 ..~
Tamiflu® — Tamiflu® _Ĩ Tamiflu® %
Oseltamivir <Ề> Oseltamivir <ỄỀ Oseltamivir Ễ
75 m _ 75 m . . , ol'
,ỉ Tamthu® g Tamiflu® Ễ , ,} c
<ÊỆỂ> Oseltamivir <Ểff> Oseltamivir ẵ ~_
T 'fl @ 75 mg T 'fl @ 75 mg ';
ami U — BMI U — ,_ "
Oseltamivir ử\ Oseltamivir <Ủ> ~'_3
_ 75 m , 75 m _
g Tamiflu® g Tamthu®
Oseltamivir Ổ°ỆỒ Oseltamivir
75 mg 75 mg _ .
Tamiflu® Tamiflu® TanìTH-ủ= . . …
Oseltamivir <'Ễ> Oseltamivir <Ệ> Oseltam' 1_ en Thi- NIUlh Thao
75 m , 75 m , 75 mg ỉ
g Tamthu® ỉ Tamthu® ("\ Ễ
Oseltamivir Oseltamivir <Ủ> Oseltamivir —
fl ® 75 …Ổg T fl @ 75 …g T 'fl @
Tami u ami u ami u
Oseltamivir RẺ Oseltamivir Óỉm> Oseltamivir
75 m , 75 m _ 75 mg
g Tamthu® ỉ Tamtflu® _ Ệ
@) Oseltamivir Ó_°ỉ'> Oseltamivir “°“ 'ặ Ễ
75 mg 75 mg _ ² g
Tamiflu® (— Tamiflu® (nỉ) Tamthu® ẫ. g
Oseltamivir Ủ> Oseltamivir —cỂ Oseltamivir g, Ế
75 m _ 75 m , 75 mg
,ỉ Tamiflu® ỉ Tamthu®
Oseltamivir <Ẻ°ỉ²> Oseltamivir <Ệ
_4 " 75 mg vs mg %
Rx
Tamiqu®
Oseltamivir
]. MÔ TẢ
1.1 Nhóm dược lýlđiểu trị
Tamifiư lả một thuốc kháng vi rút.
1.2 Dạng dược phẩm
Viên nang cứng.
Viên nang 30 mg gổm thân nang mờ đục_mảu vảng nhạt có in chữ "ROCHE" vả nắp mờ đục mảu
vảng nhạt có in "30mg". Chữ in mảu xanh.
Viên nang 45 mg gổm thân nang mờ đục mảu ghi có in chữ "ROCHE“ vả nắp mờ đục mảu ghi có in
' "45mg“. Chữ in máu xanh.
Viên nang 75 mg gổm thân nang mờ đục mảu ghi có ỉn chữ "ROCHE“ vả nắp mờ đục mảu vảng nhạt
có in "75mg”. Chữ in mảu xanh.
Bột pha huyền dịch uống.
Bột dạng cốm rời hoặc kết khối có ma“… trắng đến vảng nhạt.
1.3 Đường dùng
Đường uống.
1.4 Tính vô trùng l Bức xạ
Không ảp đụng.
1.5 Thảuh phẫn định tỉnh và dịnh lượng
Hoạt chẩt: oscltamivir phosphatc.
Mỗi viên nang 30mg chứa 39,4mg oseltamivỉr phosphate, tương đưong vởi 30mg oseltamivir.
Mỗi viên nang 45mg chứa 59,1mg oscltamivir phosphate, tương đương với 45mg oscltamivir.
Mỗi viên nang 75mg chứa 98,5mg oscltamỉvir phosphatc. tưong đưong với 75mg oseltamỉvir.
Bột pha huyền dịch uống, khi được pha với nước tới nồng độ 1,2% có chửa 12mg/ml oscltamivir.
Danh sách tá dược
Sorbitol vả sodium bcnzoatc
Tá dược rrong víên nang: Prc-gclatinized stmch, Povidonc K 30, Croscarmellosc sodium, Tale,
Sodium stcaryl fi1maratc.
Tá dược trong bộ! pha huyền dịch: Sorbitol, Titanium dioxide, Sodium bcnzoatc, Xanthan gum,
Monosodium cỉtratc, Saccharin sodium, PERMASEAL 1 1900-31 TutIi Frutti.
` »
\%\ "
:.l
2. CÁC ĐẶC TÍNH LÂM SÀNG
2.1 Chỉ định điều trị
Tamif1u dược chỉ định để điểu trị bệnh cúm ở người lớn vả trẻ cm tù sảu tháng tuổi trở lên. (Xem
mục 2.2.1 Những hướng dẫn liều dùng đặc biệt, 2.4 Những Cảnh báo vả Thận trọng vả mục 3.3 Tính
an toản tiền lăm sâng)
Tamifiu được chỉ định để phòng ngừa bệnh cúm ở người iớn vả trẻ em từ một tuồi trở lên.
2.2. Liều lượng vả Cách dùng
Tamifiu có thể được dùng kẻm hoặc không kẻm theo thức ản. (Xem mục 3.2 Các đặc tinh dược động
học). Tuy nhiên, dùng Tamif1u kèm với thức ăn có thề lảm tăng khả năng dung nạp thuốc ở một số
bệnh nhản.
Trong trưởng hợp huyến dịch uống Tamiflu không sẵn có, người lớn, thanh thiểu niên vả trẻ em
không thể nuốt viên thuốc vẫn có thể uống đủng iiều lượng (xem phẩn Hướng dẫn pha trộn ở cuối tờ
hướng dẫn sử dụng nảy). Pha chế tại hỉệu thuốc lá lựa chỌn tốt nhất.
Liễu chuẩn:
Điều Irị bệnh củm
Nên bắt đầu điểu trị vâo ngảy thứ nhắt hoặc ngáy mc: hai khi xuất hiện các triệu chứng đầu tiên cùa
bệnh củm.
Người Iởn vả rhanh rhíếu nìên:
Ở người lớn vả thanh thiểu niên từ 13 tưối trở lên, liếu khuyên dùng tả ưống viên nang Tamifiu 75mg
hai lẳn mỗi ngảy, trong 5 ngảy. Trong trường hợp không thể nuốt được viên nang, có thể dùng dạng
huyền dịch với liều 75mg Tamifiu hai lẩn mỗi ngảy, trong 5 ngáy.
T rẻ em:
Trẻ có cân nặng trên 40 kg nểu có thể nuốt được viên nang, cũng có thế được điều trị vởỉ liều uống
viên nang 75mg hai lằn mỗi ngảy hoặc một vỉên nang 30mg cộng vởi một vỉẽn nang 45mg hai 1ần
mỗi ngây, thay vi dùng Tamit1u dạng huyễn dịch vởi liễu khuyên dùng như bảng dưới đây.
Li ²u uổn đ c kh “n dùng của T ami u cho !rẻ từ mỏt tuổi rrờ lẻn:
T rọng lượng cơ thể Liều khuyên dùng trong 5 ngởy Lượng huyền dịch uống
5 15 kg ao mg hai iẳn mỗi ngảy s.o ml hai lần mỗi ngảy
> 15 kg đển 23 kg 45 mg hai lẩn mỗi ngùy 1.5 ml hai lẩn mỗi ngãy
> 23 kg đển 40 kg 60 mg hai lần mỗi ngảy 10.0 ml hai 1ằn mỗi ngảy
> 40kg 75 mg hai lằn mỗi ngảy 12.5 ml hai 1ần mỗi ngảy
Có sẵn bơm định liếu uống 10 ml cho dạng huyễn dịch uống cho trẻ từ 1 tuổi trở lên.
Tamifiu dạng bột pha huyến dịch uống nén được pha chế bởi dược sĩ trước khi dùng cho bệnh nhân
(Xem mục 4.2 Hướng dẫn đặc biệt cho việc sử dụng, hủy bỏ thuốc).
Liều dùng đường uếng của Tamiỉlu đươc khuvến cảo cho tre“ 6-12 tháng tuổi:
2
Dựa trên dữ liệu dược động học còn hạn chế hiện có, với liều dùng 3 mgfkg hai lần mỗi ngảy ở trẻ 6
— 12 tháng tuối cho nổng độ chẳt chuyến hoá có hoạt tính trong huyết tưong ở phần lón bệnh nhi
tương tự như với nổng độ có hiệu quả lâm sảng ở trẻ lớn hơn vả người lón.
Liều thuốc do dược sĩ pha chế (hoặc trộn) được nêu ở phẩn Xử lý vả Hủy bộ (xem mục 4.2
Hưởng dẫn đặc biệt cho việc sử dụng, hửy bỏ thuốc).
Phòng ngừa bệnh cúm
Người lớn vò Ihanh rhiếu níẻn:
Liều uống Tamiflu khuyên dùng để phòng ngừa bệnh cúm sau khi tiếp xúc với người bị nhiễm cúm
iả 75mg ngảy một 1ẩn, trong 10 ngảy. Nên bắt đẳu việc sử dụng trong vòng hai ngảy sau khi tiếp xúc
vởi nguồn bệnh. Liều khuyên dùng để phòng bệnh củm trong suốt thời gian có dịch ở cộng đống lả
dùng 75mg ngây một lần. Tính an toản vả hiệu quả của việc dùng thuốc đã được chửng minh cho tới
6 tuần. Chừng nảo vẫn còn dùng thuốc thì thời gian bảo vệ của thuốc vẫn còn.
Trẻ em n`r ] tuổi:
Trẻ có cân nặng trên 40 kg nểu có thể nuốt được viên nang, cũng có thể được điều trị phòng bệnh
củm với vỉên nang 75mg một lần mỗi ngảy hoặc một viên 30 mg cộng với một vỉên 45 mg một lằn
mỗi ngảy, trong 10 ngảy, thay vì dùng Tamifiu dạng huyền dịch với liều khuyên dùng như bảng dưới
đây.
Liều uống đươc khuyên dùng của Tamiflu để phỏng ngừa bệnh củm cho rrẻ Iừ mỏ! mối Iro' Ie'n:
Trọng lượng cơ thể Líếu khuyên dùng trong 10 ngảy Lượng huyền dịch uống
5 15 kg 30 mg ngảy một 1ẳn 5.0 ml ngáy một iẳn
> 15 kg đền 23 kg 45 mg ngảy một lẩn 7.5 mi ngảy một lẳn
> 23 kg đển 40 kg 60mg ngảy một lần 10.0 ml ngảy một lẩn
> 40kg 75mg ngảy một lẫn 12.5 mi ngảy một lẳn
Có sẵn bơm định liếu uống 10 ml cho dạng huyền dịch uống.
Tamiflu dạng bột pha huyễn dịch uống nên được pha chế bời dược sĩ trưởc khi dùng cho bệnh nhân
(Xem mục 4.2 Hưởng dẫn đặc biệt cho việc sử dụng, hùy bỏ thuốc).
2.2.1 Những hưởng dẫn liều dùng đặc biệt:
Bệnh nhản suy Ihận
Điểu tri bệnh núm
Không cằn điếu chinh liều cho những bệnh nhân có độ thanh thải creatinine trên 60 milphút. Ở
những bệnh nhân có độ thanh thải creatinỉnc từ 30—60 ml/phủt, cằn giảm 1iều Tamifiu xuống 30mg
uống hai lần một ngảy, trong 5 ngảy. Ở những bệnh nhân có độ thanh thải creatinỉne từ 10—30
m1/phủt, cẩn giảm iiễu Tamỉfiu xuống 30mg uống ngây một lằn, trong 5 ngảy Ở những bệnh nhân
đang thẳm phân mảu định kỳ, nếu triệu chứng cúm xuất hiện trong khoảng thời gian 48 giờ giữa hai
lẳn thẳm phân máu có thể dùng liếu khời đẳu so mg Tamiqu trước khi bắt đầu thẳm phân máu. Đê
nồng độ thuốc trong huyết tương được duy tri trong khoảng trị liệu, nẻn dùng một liều 30 mg
3
Tamỉfiu sau mỗi lần thẩm phản mảư. Đối với thẳm phãn phúc mạc, nên dùng một liều 30 mg Tamiflu
trước khi bắt đẳư thẳm phân máu và sau đó bổ sung cảc liều 30 mg mỗi 5 ngảy (Xem mục 3.2.5 Đặc
tính Dược động học ở những đối tưọng đặc biệt và mục 2.4 Những Cảnh báo vả Thận trọng). Dược
động học cùa oseltamivir chưa được nghiên cứu ở những bệnh nhân “bệnh thặn giai đoạn cuối” (từc
lả độ thanh thải creatinin < 10m1/ pht'tt) không đang thẳm phân máu. Do đỏ, không có Iiểu khuyên
dùng cho nhóm bệnh nhân nảy.
Phỏng ngứa bệnh cúm
Không cần điếu chinh liền cho những bệnh nhân có độ thanh thải creatỉnỉne trên 60 mllphủt. Ở
những bệnh nhân có độ thanh thải creatinine từ 30-60 mI/phút, lỉều dùng Tamifiu nên được giảm
xuống còn 30mg, một ngảy uống một lần. Ở những bệnh nhân có độ thanh thải creatininc từ 10—30
ml/phủt, cần giảm liếu Tamifiu xuống 30mg uống cách ngảy một lần. Ở những bệnh nhãn đang thấm
phân mảu dịnh kỳ, có thể dùng iiều khời đẳu 30 mg Tamifiu trước khi bắt đầu thẩm phân mảu. Đề
nồng độ thuốc trong huyết tưong được duy trì trong khoáng trị lỉệu, nên dùng một iiếu 30 mg
Tamifiu sau mỗi những lần thấm phân mảu xen kẽ. Đối với thầm phân phúc mạc, nên dùng 1 liều so
mg Tamifiu trước khi bắt đầu thẳm phân máu vả sau đó bổ sung các Iiếu 30 mg mỗi 7 ngảy. (Xem
mục 3.2.5 Đặc tính Dược động học ở những đối tượng đặc biệt và mục 2.4 Những Cảnh báo và Thận
trọng). Dược động học của oseltamivir còn chưa dược nghiên cứu ở những bệnh nhân “bệnh thận
giai đoạn cuối” (tức lả độ thanh thải creatinin < 10m1/ phút) không đang thẳm phân máu. Do đó,
không có Iiểu khuyên dùng cho nhóm bệnh nhân nảy.
Bệnh nhãn suy gan
Không cẩn điều chinh liều cho những bệnh nhân bị rối loạn chức năng gan nhẹ h0ặc vừa khi được
điếu trị hoặc phòng ngùa bệnh củm (Xem mục 3.2.5 Đặc tính Dược động học ở những đối tượng đặc
biệt). Độ an toản vả đặc tính dược động học ở bệnh nhân suy gan nặng chưa được nghiên cứu.
Bệnh nhân suy giảm miễn dịch
Việc dự phòng cúm mùa cho bệnh nhân suy giảm miễn dịch từ 1 tưồi trở lên được khuyên là 12 mần.
Không cẳn điều chinh liếu (xem mục z.z>.
Người gìả
Không cẳn điều chỉnh lỉểu cho người giả khi được điều trị hoặc phòng ngữa hệnh cúm (Xem mục
5.2.5 Đặc tính Dược động học ở những đối tượng đặc biệt)
Trẻ em
Tính hiệu quả cùa Tamifiu ở trẻ dưới một tuồi chưa được xác lập ('Xcm mục 3.2.5 Đặc tinh Dược
động học ở những đối tượng đặc biệt). Các dữ liệu dược động học còn ít gợi ý rằng Iĩểu 3 mglkg hai
1ằn một ngảy ở trẻ từ 6 đến 12 tháng mối cho nồng độ ehẩt chuyến hoá có hoạt tính trong huyết
tương ở đa số bệnh nhi tưong tự như nổng độ có hiệu quả lâm sảng ở trẻ lớn hơn và người lón.
Những dữ iiện lâm sảng hiện có chưa đủ để đưa ra liếu khuyên dùng cho trẻ dưới 6 tháng tuổi (xem
mục 2.1 Chỉ định đĩếu trị)
2.3 Chổng chỉ định
\
ú
J
ulc-
Is' "
Quá mẫn với oseitamivir phosphatc hOặc với bắt kỳ thảnh phần nảo của thuốc.
2.4 Những Cânh bảo và Thận trọng
Co giật vả các biến cố tâm thần kinh giống như mê sảng đã được ghi nhận ở những bệnh nhân cúm
dùng Tamitiu, chủ yểu xảy ra ở trẻ em và thanh thiểu niên. Trong một vải trưòng hợp rất hiểm gặp,
cảc biến cố nảy gây nên chấn thưong do tai nạn. Vai trò cùa Tamit1u đối với các biến cố nảy hiện vẫn
chưa biết rõ vả các biến cố nảy cũng dã được ghi nhận ở những bệnh nhân bị củm mãi không dùng
Tamiflu. Ba nghiên cứu địch tễ học quy mô lớn độc lặp đã khắng định rằng cảc bệnh nhân nhiễm
cúm đang dùng Tamỉfiu không có nguy cơ xảy ra các biến cố về tãm thần kinh cao hon so vói những
bệnh nhân nhiễm cúm không dùng thuốc khảng vi rủt (xem phẩn 2.6.2 Sau khi … hảnh thuốc).
Bệnh nhân (đặc biệt trò cm vả thanh thiếu niên), cẩn được theo dõi chặt chẽ các dấu hiệu hảnh vi bắt
thường.
Không thấy bằng chứng về hiệu quả của Tamif1u trong bẫt kỳ bệnh nảo gây bới các tác nhân không
phải vi rút củm type A vả B.
Để điều chinh liều cho nhũng bệnh nhân bị suy thặn, xìn xem mục 2.2.1 Những hướng dẫn iiếu dùng
đặc bìệt vả mục 3.2.5 Đặc tính Dược động học ở những đối tượng đặc biệt.
Một lọ Tamiflu 30g để pha huyền dịch uống có chứa 25,713g sorbitol. Một Iiếu 4Smg oscltamivír
uống hai lần mỗi ngây sẽ đưa vảo co thể 2,6g sorbitol. Với nhũng bệnh nhân không dung nạp
fructose di trưyền, iiều nói trên vượt quá mức sorbitol tối đa được khưyên dùng hảng ngảy.
2.4.1 Tác động lên khá nãng lái xe và vận hảnh mảy móc
Không ảp dụng.
2.4.2 Tương tảc với các thuốc khác vả cảc hình thức tương tác khác
Thông tin từ những nghiên cứu về dược lý và dược động học cùa oscltamivir phosphate cho thấy
không có khả nãng xảy ra cảc tưong tác thuốc có ý nghĩa về mặt lâm sảng.
Một lưọng lớn oscltamivir phosphatc. được chuyến hoá thảnh hợp chất có hoạt tính nhờ esterasc, xảy
ra chủ yếu ở gan. Các mong tảc thưốc do sự cạnh tranh vói cstcrase vẫn chưa được báo cáo nhiều
trong y vản. Do oscltamivir vả chất chuyến hóa có hoạt tinh đểu gắn kết kẻm với protein huyết
tương, khả nãng tương tác đo chiếm chỗ của thuốc khó có thể xảy ra.
Các nghiên cứu in vit… cho thẩy cả oscltamivir phosphate lẫn chắt chưyên hoá có hoạt tính đều
không phải lả chẳt nền tốt cho men oxidasc có chức năng hỗn hợp P450 hoặc cho men glucuronyi
transfcrases. (Xem mục 3.2. Cảc đặc tính dược dộng học). Không có cơ sở nảo về mặt cơ chế cho
thấy có sự tương tác với thuốc ngùa thai dùng đường uống.
Cimctidine, một chẩt ừc chế không đặc hiệu cùa các đồng dạng cytochromc P450 vả lả chẳt cạnh
tranh với những thuốc gốc ba-zơ hoặc thuốc cation hoá để bải tiết qua ống thận, không có ảnh hướng
gì iên nồng độ trong huyết tương của oseltamivir hoặc chẩt chuyến hoá có hoạt tính cùa nó.
Xét về mặt lâm sảng, ca'c mong tác thưốc quan trỌng có Iiên quan đến sự cạnh ưanh đế bải tiết qua
ống thận khó có thể xảy ra do giới hạn an toản đã được biết của hầu hết cảc thuốc, đặc điềm thải trữ
cùa chất chuyến hoá có hoạt tinh (sự lọc ở vĩ cầu thận vả bải tiết ở ống thận dưới dạng anion) và khả
5
\’²tiủ JM
năng thải trừ cùa những đường nảy. Dùng thuốc đồng thời với probcnecid sẽ lảm tãng nổng độ các
chắt chuyền hoá có hoạt tính iên gần gấp đôi do lảm giảm sự bải tỉểt chủ động của chúng ở ống thận.
Tuy vậy, nhờ giởi hạn an toản của chắt chuyển hoá có hoạt tính rẩt rộng nên không cằn thiểt phải
điều chính liều khi dùng thuốc chung vởỉ probenecid.
Dùng thuốc đồng thời với amoxicillin không lảm thay đổi nổng độ của cả hai [oại thuốc trong huyết
tương, điều nảy cho thắy rằng sự cạnh tranh để được bải tiểt dưới dạng anion lả rẩt yếu.
Dùng thuốc đồng thời với paracetamol không lâm thay đối nổng độ trong huyết tuơng cùa
oseltamivir, chất chuyển hoá có hoạt tinh cùa nó, hoặc paracctamol.
Khỏng có tưong tác thuốc về dược động học giữa oseltamivir hoặc chắt chuyển hoá chinh cùa nó
được ghi nhận khi dùng chung oseltamivir với paracctamol, acid acctyi-saiicylic, cimetìdine hoặc cảc
thuốc kháng acid (magnesium vả hydroxid nhôm vả carbonate canxi), warfarin, rimantadine hoặc
amantadine.
Trong cảc nghiên cứu lâm sảng điểu trị vả dự phòng pha 111, người ta đã dùng Tamiflu chung với các
thuốc thông dụng khác như thuốc ức chế men chuyển (enalapril, captopril), các thiazide lợi tiểu
(bendrofiuazide). kháng sinh (penỉcillin, cephalosporin, azithromycin, crythromycin vả doxycycline),
thuốc chẹn thụ thể H2 (ranitidinc, cimetìdine), chẹn beta (propranolol), các xanthinc (thcophylline),
thuốc gỉống giao cảm (pseudoephcdrine), chế phẳm thuốc phiện (codcine), corticosteroids, thuốc
giãn phế quản dạng hit, vả thuốc giảm đau (aspirin, ibuprofen vả paracetamol). Không thắy có sự
thay đổi nảo về phán ứng phụ hOặc tẳn suất xuất hiện các phản ứng phụ khi dùng Tamifiu chung vởi
các thuốc nảy.
z.s. Sử dụng ở các đối tượng đặc biệt
2.5.1 Phụ nữ có thai
Nguy cơ thai kỳ nhóm B
Những nghiên cứu về tác động cùa thuốc lên sự sinh sản ở động vật, được tiến hảnh trên chuột và
thỏ, không ghi nhận hiện tưọng quái thai nảo. Những nghiên cứu về khả năng sinh sản vả độc tính
sinh sán đã được tiền hảnh rrên chuột. Không thẳy có bằng chứng về ảnh hưởng của thuốc iên khả
năng sinh sản ở tắt cả các liều oseltamivir được nghiên cứu. Ó chuột vả thò. người ta thẳy nồng độ
cùa thuốc ở phôi thai khoảng 15-20% nồng độ thuốc của thủ mẹ.
Trong khi không có thử nghiệm iâm sảng có đối chứng đưục tiển hảnh về việc sử dụng oseltamivir ở
phụ nữ mang thai, chỉ có it dữ liệu từ cảc báo cáo sau khi lưu hảnh thuốc vả các nghiên cứu quan sát
hổi cứu. Những dữ liệu nảy kểt họp với các nghiên cứu trên động vặt không cho thốy những ưu: hụi
trực tiểp hoặc giản tiểp đối với thai kỳ, sự phát triển phôi/thai hoặc sau khi sinh (xem mục 3.3 An
toản tiểu lâm sảng). Phụ nữ có thai có thể uống Tamiflu, sau khi cân nhắc thông tin an toản sẵn có,
khả nãng gây bệnh của chùng virus củm hiện hảnh và thể trạng của ugưùỉ phụ nữ có thai.
2.5.2 Bá mẹ cho con bú
Ở chuột cho con bú. oseitamivir vả chẳt chuyền hoá có hoạt tính được bải tíết vảo trong sữa. Có rất ít
thông tin về trẻ cm được nuôi bằng sữa cùa mẹ đang dùng oseltamivir vả về sự bải tiết của
oseitamívir vảo sữa mẹ. Cảo dữ liệu hạn chế đã chi ra rằng oseltamivir vả chẳt chuyển hoá có hoạt
6
tinh của nó đã được tim thẩy trong sữa mẹ, nhưng ở nống độ thẳp, dưới mức đạt được ở liều điều trị
cho trẻ em. Sau khi cân nhắc thông tin nảy, tính gãy bệnh của chùng vi rút cúm hiện hânh vả tình
trạng sức khoẻ của bá mẹ cho con bủ, có thể xem xét đển việc sử dụng oseltamivir.
2.5.3 Sử dụng ở trẻ em
Xem mục 2.2.1 Những hướng dẫn liều dùng đặc biệt vả 3.2.5 Đặc tinh dược động học ở những đối
tượng dặc biệt.
2.5.4 Sử dụng ở người lớn tuối
Xem mục 2.2.1 Những hướng dẫn liều dùng đặc biệt vả 3.2.5 Đặc tinh dược động học ở những đối
tưọng đặc biệt.
2.5.5 Suy thận
Xem mục 2.2.1 Những hướng dẫn Iỉều dùng đặc biệt vả 3.2.5 Đặc tinh dược động học ở những dối
tượng đặc biệt.
2.5.6 Suy gan
Xem mục 2.2.1 Những hưởng dẫn liều dùng đặc biệt và 3.2.5 Đặc tinh dược động học ở những đối
tượng đặc biệt.
2.6. Cảc tảc dụng không mong muốn
Thông bảo cho bác sỹ những tảo dụng khõng mong muốn gặp phải khi sử dụng thuốc.
2.6.1 Cảc thử nghiệm lâm sảng
Thông tin an toản chung của Tamíflu được dựa trên dữ liệu từ 2647 bệnh nhân người lón/thanh thiếu
niên vả 858 bệnh nhân trẻ cm bị củm, và dựa trên dữ iiệu từ 1945 bệnh nhân người lởn/thanh thiếu
niên vả 148 bệnh nhân trẻ cm được dùng Tamiflu để dự phòng cúm trong các thử nghiệm lâm sảng.
Trong các nghiên cứu điều trị ở người lón/thanh thiểu niên, các phản ửng ngoại ý hay gặp nhẩt lả
buổn nôn. nôn vả đau đầu. Phần lớn các phản ứng ngoại ỷ nảy được báo cáo chỉ xuất hiện một lẩn,
xáy ra trong ngảy điểu trị đầu tiên hoặc thứ hai vả tự hết trong vòng 1-2 ngảy sau đó. Trong các
nghiên cứu dự phòng ở người lớnlthanh thiểu niên, đa số cảc phản ứng ngoại y' được bảo cáo lả buổn
nôn, nôn ói, đau đầu vả đau. Ó trẻ cm, phản ứng ngoại ý thường gặp nhất lả nôn ói. Ở phần [ón bệnh
nhân, những phản ứng nảy không dẫn đến ngừng sử dụng Tamif1u.
Điều rrị vá dựplxòng củm ở người lớn vỡ rhnnlr rhiễu niên
Trong cảc nghiên cứu điều tri và dự phòng ở người lón/thanh thiển niên, các phản ứng ngoại ỷ xuất
hiện thưòng xuyên nhất (21%) ở iiếu khuyến cáo (75 mg, ngảy 2 lẳn, rrong 5 ngảy để điều trị vả 75
mg ngảy một lần, có thể kéo dải đến 6 tuần để dự phòng), và tỷ lệ xuất hiện các phản ứng ngoại ý can
hơn ít nhất là 1% ở nhóm Tamifiu so vởi giả dược, được nêu trong bảng 1.
Nhóm dân số trong cảc nghiên cứu điều trị cúm có cả những người lớn/thanh thiếu niên khoẻ mạnh
vả những bệnh nhân “có nguy cơ" (những bệnh nhãn có nguy cơ cao gặp các biến chứng có liên quan
với củm, chẳng hạn như ca'c bệnh nhân lớn tuổi vả các bệnh nhân bị bệnh timlbệnh hô hắp măn tinh).
7
Nói chung, thông tin về độ an toản ở các bệnh nhân “có nguy cơ" là tương đương về cảc loại phản
ứng ngoại ỷ so với nhóm nhũng người iởn/thanh thiểu niên khoẻ mạnh.
Các thông tin về độ an toản được bảo cáo ở cảc đổi tượng uống Tamifiu với liều khuyến cảo để dự
phòng (75 mg ngảy một lần có mẻ kéo dải đến 6 tuẳn) cũng tưong tự về cảc loại phản ửng ngoại ý
như những gì thắy được ở các nghiên cứu điểu tri (Bảng 1), cho dù thời gian sử dụng thuốc trong các
nghiên cứu dự phòng kéo dải hơn.
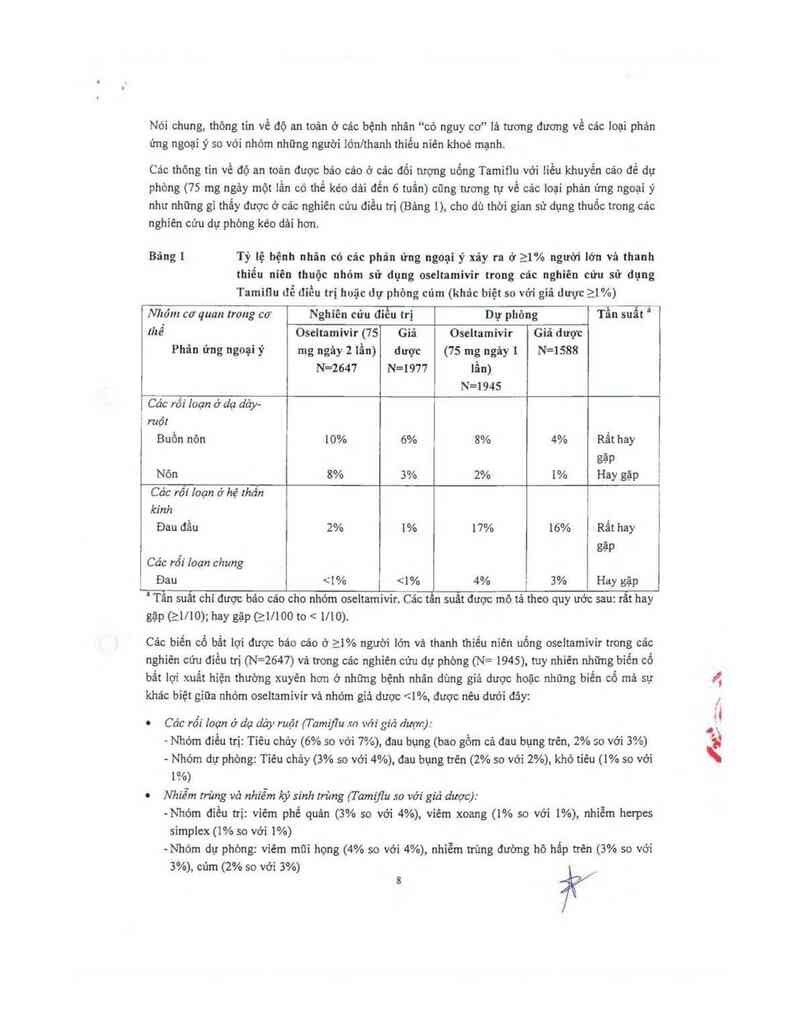
Bảng 1 Tỷ lệ bệnh nhân có cảc phân ứng ngoại ỷ xãy ra ở 21% người lớn và thanh
thiểu niên thuộc nhóm sữ dụng oseltamivir trong cảc nghiên cửu sử dụng
Tamiqu để điều trị huặc dự phòng cúm (khác biệt so với giả dược 21%)
Nhóm cơ quan Irong co’ Nghiên cứu điều trị Dự phòng 'Ĩ'Ển suất '
thề Oseltamivir (75 Giá Oseltamivir Giả dượt
Phân ứng ngoại ỷ mg ngảy 2 lẫn) dược (75 mg ngăy [ N=1588
N-2647 N=1977 lẫn)
N=1945
ĩềác rối loạn ở dạ dảy-
i ruột
Buồn nôn 10% 6% 8% 4% Rắt hay
gặp '
Nõn 8% 3% 2% 1% Hay gặp Ễ
Các rõi Ioạn ở hệ thán 1
kinh '
Đau đằu 2% m 17% 16% Rất hay
_ gặp
Các rói Ioạn chung
Đau 99,0°FJ 37,2°c kèm theo ho vă/hoặc sổ mũi, tất cả được
ghi lại trong vòn g 24 giờ. Trong số cảc đối tượng chưa phát tán vi rút lủc ban đằu, Tamiilu [ảm giảm
tỷ lệ mắc phải bệnh củm có bỉều hiện lâm sảng được xác nhặn bằng xét nghiệm từ 3% (7/231) trong
13
Q
nhỏ… không được điều trị đự phòng xuống còn 0,4% ( 1/232) trong nhóm được điểu trị dự phòng.
Sự đề kháng của vi rút
Sự giảm nhạy cảm của men neuramim'dase của vi rút
Các nghiên cứu lâm sảng: Nguy cơ xuất hiện cảc chùng vi rủt cúm với tinh nhạy cảm giảm hay để
khảng oseltamivir đă được nghĩẻn cứu kỷ trong cảc nghiên cứu lâm sảng do Roche tải trợ. Tất cả cảc
bệnh nhân mang vi rút kháng oseltamivir chi cho thẳy đề kháng thoáng qua, họ vẫn thải trừ được vi
rủt như binh thường vả ichớng có diễn tiến xấu về triệu chứng.
Bệnh nhân mang vi rút có đột biển đê khảng (%)
Nhỏm bệnh nhân . …
Kiêu hinh* Kiêu hinh vả kiêu gen*
Người iớn và thanh thiểu niên 4/ 1245 (0,32%) 5/1245 (0,4%)
Trẻ em (1-12 tuôi) 19/464 (4,1%) 251464 (5.4%)
* Xác định toản bộ kiêu gen không đuợc thực hiện trong tât cả cảc nghiên cứu.
Các nghiên cứu lâm sảng được tiền hảnh cho đến nay trong việc phòng bệnh củm sau tiếp xúc (7
ngảy), sau tiếp xúc trOng gia đinh (10 ngảy) vả phòng bệnh cúm theo mùa (42 ngảy) không cho thấy
có bằng chứng nảo về sự kháng thuốc liên quan đển việc sử dụng Tamiqu ở những bệnh nhân có khả
nảng miễn dịch tốt. Không thấy có sự kháng thuốc nảo trong một nghiên cứu dự phòng 12 tuần ở
những đối tượng suy giảm miễn dịch.
Các dữ Iìệu Iảm sảng vả theo dõi: Các chủng đột biển tự nhiên giảm nhạy cảm với oscltamivir in
vitro đã được phát hiện ở vi rủi cúm A vả củm B phân lập từ bệnh nhân chưa từng uống oscltamivir.
Ví dụ, năm 2008 đề kháng oseitamivir do sự thay thế H275Y đã được tim thẳy ở > 99% các mẫu
phân lập củm HlNl 1ưu hảnh ở châu Ẩn nảm 2008, trong khi cúm HINI năm 2009 (“cúm lợn”) gần
như đều nhạy cảm hoản toản với oscitamivir. Cảc chủng đề khảng cũng được phân lập từ cả những
bệnh nhân có miễn dịch tốt iẫn những bệnh nhân suy giảm miễn dich được điều trị bằng oscltamivir.
Sự nhạy cảm với oseltamivir vả ti lệ mắc các vi rút đề kháng dường như thay đối theo mùa cũng như
theo địa lý. Củng đã có báo cáo về sự đề kháng oseltamivir khi điều trị lẫn khi dự phòng ở những
bệnh nhân bị cúm trong dịch cúm HlNi.
Tỷ 1ẹ xuất hiện đề kháng có thế cao hơn ở những nhóm tuổi nhỏ nhẩt, vả trong nhóm cảc bệnh nhản
suy giảm miễn dịch. Các vi rủt đề kháng oseltamivir phân lập được từ các bệnh nhân điều trị bằng
oseltamivir vả các chũng vi rút cúm kháng oseltamivir chọn iọc trong phòng thí nghiệm đều cho thắy
có mang đột bỉến ở các neuraminidasc Nl vả N2. Các đột biển kháng thuốc có xu hướng đặc trưng
theo phân nhóm vi rủt.
Cảc bác sỹ nên cân uhắc thông tỉn hiện có về các dạng nhạy cảm với thuốc cùa vi rủt củm cho từng
mùa trước khi quyết định dùng Tamifiu hay không (để có thông tin mới nhất, xin xem trên website
cùa WHO vả/hoặc chinh quyển sở tại).
3.2 Các đặc tinh dược động học
3.2.1 Hấp thu
14
Oseltamivir được hẩp thu nhanh chóng ở đường tiêu hóa sau khi uống oscltamivir phosphate vả một
phẳn lởn thưốc được chuyền hóa thảnh chẩt có hoạt tinh, chủ yểu nhờ men estcrase ở gan. Nổng độ
trong huyết tưong của chẩt chuyển hỏa có hoạt tính có thể đo được trong vòng 30 phủt, đạt gần nồng
độ đinh 2-3 giờ sau khi dùng thuốc vả cao hon dảng kể (› zo lần) nổng độ của tiễn dược. Có it nhắt
75% lượng thuốc uống vảo được tuần hoản dưới dạng chất chuyển hóa có hoạt tính. Nồng độ của
chất chuyển hóa có hoạt tinh trong huyết rưong tỷ lệ với Iiểu dùng vả không bị ảnh hướng bới thức
ãn dùng cùng (Xem mục 2.2 Liều lượng vả Cảch dùng)
3.2.2 Phân bố
Thể tich phân bố trung binh (Vss) của chẩt chuyến hóa có hoạt tính lả khoảng 23 lít ở người.
Gốc có hoạt tinh tới được tẩt cả các vị trí quan trợng bị nhiễm vi rút củm qua nghiên cứu trên chồn,
chuột vả thò. Trong những nghiên cứu nảy, ngưòi ta đã thấy nồng độ chắt chuyến hóa có hoạt tinh
khảng vi rủt tặp trung ở phổi, dịch rưa phế quán-phế nang, chẩt nhầy ở mũi, tai giữa vả khi quân sau
khi uống oseltamivir phosphatc.
Mức độ gắn kểt của chắt chuyến hóa có hoạt tính với protein hưyết tương ở người lá không đảng kề
(xẩp xỉ 3%). Mức gắn kểt của tiển dược với protein huyết tương người lả 42%. Với mức nảy thì chưa
đủ để gây ra cảc tương tảc thuốc có ý nghĩa.
3.2.3 Chuyển hóa
Một Iưọng lớn oscltamivir phosphatc được chuyền hóa thảnh chẩt chuyến hỏa có hoạt tinh nhờ mcn
estcrasc. men nảy khu trú chủ yểu ở gan. Cá oscitamivir lẫn chẳt chuyển hỏa có hoạt tinh đểu không
phải là cơ chẳt hoặc chắt ức chế cùa các đổng dạng cytochrome P450 (Xem mục 2.4.2 Tương tác với
cảc thuốc khác vả các hinh thức tương tảc thuốc)
3.2.4 Thãỉ trừ
Oscltamivir sau khi hẳp thu được thải trừ phần lớn (> 90%) bằng cách chuyển thảnh chất chuyển hóa
có hoạt tinh. Chất nảy không bị chuyền hóa tiểp mả bị thải trừ qua nước tiểu. Nồng độ đinh của chẩt
chuyển hóa có hoạt tinh trong huyết tương giảm dẳn với thời gian bản thải từ 6 đển 10 giờ trong đa
số trường họp.
Thuốc có hoạt tinh được thái trừ toản bộ (> 99%) qua thận. Độ thanh thải thặn (18,8 lítlgiờ) vượt quá
mức 1ọc cầu thận (7,5 lit/giờ) cho thẳy thuốc còn được thải trừ tiép qua ống thận. Dưới 20% liệu
uống có đánh dẩu phóng xạ được thải trừ qua phân.
3.2.5 Dặc tính dược động học ở những dối tượng đạc biệt
Bệnh nhân suy rltận
Sau khi dùng lOOmg Tamifiư. 2 lằn | ngây, trong thời gian 5 ngảy cho nhĩmg hênh nhân bị suy thận ở
các mức độ khác nhau, người ta thẩy nổng độ chẳt chuyến hóa có hoạt tinh tỷ lệ nghịch với sự suy
giảm chức năng thặn.
Điều rrị bệnh cúm
Không cần ớiẻu chinh iièu cho những bệnh nhân có độ thanh thải creatinine trên 60 mi/phút. ó
những bệnh nhân có độ thanh thải creatinine từ 30-60 milphtit, cẳn giảm liều Tamiqu xuống 30 mg
uổng ngảy hai lằn, trong 5 ngảy.Ỏ những bệnh nhân có độ thanh thải creatinỉnc từ 10—30 milphút, cần
. i
giảm iiễu Tamifiu xuống 30 mg uống ngảy một lần, trong 5 ngảy. Ở những bệnh nhãn đang thẩm
phân máu dịnh kỳ, có thể dùng liều khời đầu 30 mg Tamiiiu trước khi bắt đầu thẩm phân mảu nểu
triệu chứng cúm xuất hiện trong khoảng thời gian 48 giờ giữa hai lần thẩm phân mảu. Đế nồng độ
thuốc trong huyểt tương được duy tri trong khoảng trị liệu, nên dùng một liều 30 mg Tamifiu sau
mỗi chu trinh thẳm phân máu. Đối với thẩm phân phủc mạc, một liểu 30 mg Tamifiu trước khi bắt
đầu thẩm phân mảư vả bổ sung cảc liều 30 mg mỗi 5 ngảy (Xem mục 3.2.5 Đặc tinh Dược động học
ở những đối tượng đặc biệt vả mục 2.4 Những Cảnh bảo vả Thận trọng). Dược động học của
oseltamivir còn chưa được nghiên cửu ở những bệnh nhân “bệnh thận giai đoạn cuối” (tức lả, độ
thanh thải creatinin < lOml/ phủt) không đang thẳm phân mảu. Do đó, không có liểu khuyên dùng
cho nhóm bệnh nhân nảy.
Phỏng ngửa bệnh cúm
Không cần điều chinh iiều cho những bệnh nhân có độ thanh thải creatininc trên 60 mllphủt. ò
những bệnh nhân có độ thanh thải creatinine từ 30—60 m1/phủt, cẳn giảm liều Tamiflu xuống còn 30
mg uổng ngảy một lần, trong 5 ngảy.Ớ những bệnh nhãn có độ thanh thái creatinine từ 10-30
mllphủt, cần giảm liều Tamifiu xuống còn 30 mg, cách một ngảy uống một lẳn. Ở những bệnh nhân
đang thẩm phân mảu định kỳ, có thể dùng liều khới đầu 30 mg Tamiflu trước khi bắt đẳu thẳm phân
mảu. Để nồng độ thuốc trong huyết tượng được duy trì trong khoáng trị iiệu, nên dùng một liểu 30
mg Tamifiu sau mỗi iằn thẩm phân máu xen kẽ. Đối vởi thẩm phân phủc mạc, nên dùng một liều 30
mg Tamiflu trước khi bắt đẳu thẩm phân máu vả bổ sung các iiểu 30 mg mỗi 7 ngảy (Xem mục 3.2.5
Đặc tính Dược động học ở những đối tượng đặc biệt vả mục 2.4 Những Cảnh báo vả Thận trọng).
Dược động học cùa oseltamivir còn chưa được nghiên cứu ở nhĩmg bệnh nhân “bệnh thặn giai đoạn
cuối” (tức lả, độ thanh thải creatinin < 10m1/ phủt) không đang thẩm phân máu. Do đó, không có liều
khuyên dùng cho nhỏm bệnh nhân nảy.
Bệnh nhân suy gan
Dựa trên những nghiên cứu trong phòng thí nghiệm vả trên động vật, ở những bệnh nhân suy gan
nhẹ hoặc trung binh, gia tăng đáng kể nổng độ oseltamivir vả chẳt chưyển hóa có hoạt tinh không
được ghi nhận vả điểu nảy đã được xác định iại trong các nghiên cứu lãm sảng (Xem mục 2.2.1
Những hướng dẫn liều dùng đặc biệt). Độ an toản vả dặc tinh dược dộng học ở bệnh nhân suy gan
nặng chưa được nghiên cửu.
Ngườigiủ
ớ người lớn tuổi (từ 65 đến 78 tuổi), nồng độ của chẩi chuyền hóa có hoạt tinh ở trạng thái ốn định
cao hon khoảng 25-35% so với người trẻ khi dùng cùng một liểu Tamifiu. Thời gian bán thải của
thuốc ở người giá tương tự như ở người trẻ. Cản cứ vảo nổng độ của thuốc vả khả năng dung nạp,
không cổn điều chinh liều cho người giả khi được điều tti hoặc phòng ngừa bệnh củm (Xem mục
2.2.1 Những hướng dẫn liều dùng đặc biệt)
Tre“ em Iừ ] tuổi
Dược động học cùa Tamifiu đã được đánh giá trong một nghiên cứu dược động học liểu đon ở trẻ cm
từ 1 đển 16 tuối. Dược động học đa iiểu cũng đã được nghiên cứu ở một số it trẻ từ 3 đển 12 tuổi
trong một thử nghiệm iâm sảng. Trẻ nhỏ tuổi có mức độ thái trữ các chẳt chuyển hóa có hoạt tinh
nhanh hon so với người iớn, iâm cho nồng độ thuốc trở nên thẩp hơn nếu xét theo liễu được cho tính
“ ớ
.\
___..h
'ửx
&
bằng mg/kg. Liều 2mg/kg vả các liều 30mg vả 4Smg khi dùng cho trẻ em theo khuyến cảo ở mục 2.2
cho nồng độ tảc dụng của oscltamivir carboxylate tưong tự với nổng độ đạt được ở người iớn dùng
liểu đơn viên nang 75mg (xẩp xi lmglkg). Dược động học của oseltamivir (› trẻ cm trên 12 tuổi
tương tự như ở người lớn.
Trẻ em từ 6-12 rluing
Hiện có it dữ liệu về nồng độ thuốc trong cơ thể trong phân nhóm bệnh nhán từ 6-12 thảng tuổi tham
gia trong cảc nghiên cứu về dược lực học. dược động học vả tính an toản ở trẻ nhiễm củm dưới 2
tuối. Các dữ liệu hiện có gợi ý rằng nổng độ thuốc sau khi uống liểu 3 mg/kg ở đa số trẻ 6-12 thảng
tuối tưong tự như nồng độ đạt được ở trẻ lớn hơn vả người iớn đang uống liều được phê chuẩn. Các
tác dụng không mong muốn được bảo cáo phù họp với những thông tỉn về an toản đã thiết lập ở trẻ
ión hơn.
3.3 Tinh an toản tiểu iâm sâng
Những dữ iiệu tiền lâm sảng không cho thẳy mối nguy hiềm đặc biệt nảo cùa thuốc cho người dựa
trên các nghiên cứu thông thường về dược học an toản, độc tinh liều lặp iại vả độc tinh trên gen.
3.3.1 Tính sinh ung tbư
Ba nghiên cửu về khả nảng gãy ưng thư (các nghiên cứu hai năm ớ chuột nhắt vả chuột lón với
oseitamivir, vả thử nghiệm sáu tháng về trao đồi gen ngAC ở chuột nhắt được tiến hảnh với chẩt
chuyển hóa có hoạt tính) cho kểt quả âm tính.
3.3.2 Tinh gầy đột biến
Oseltamivir vả chẩt chuyến hóa có hoạt tinh cho kết quả âm tinh trong lò thử nghiệm chuẩn gây độc
trên gen.
3.3.3 Suy giãm khả nãng sinh sân
Nghiên cứu về khả nảng sinh sản ở chuột với iiễu lên tới lSOOmg/kg/ngảy đã chứng minh không có
tác động có hại nảo iên cả hai giới.
3.3.4 Tính gây quái thai
Các nghiên cửu về quải thai đă được tiển hảnh với liểu lên tới 1500mg/kơngảy ở chuột vá
500mglkg/ngảy ở thò. Không ghi nhận được tảc động nảo cùa thuốc lẽn sự phát triển của phôi thai.
Trong các nghiên cứu chu sinh ở chuột, quả trinh chuyển dạ kéo dải được ghi nhặn ờ liểu
1500mg/kg/ngảy: giới hạn an toản giữa liễu điều trị ở người vả iiều cao nhất không gây hại
(SOOmg/kg/ngảy) ở chuột lả gấp 480 lằn đối với oseltamivir vả gấp 44 lần đối với chất chuyển hóa có
hoạt tinh. Nồng độ thuốc ở phôi chuột vả phôi thò xẳp xi 15 đển 20% nổng độ ở mẹ.
33.5 Dặc tinh khác
Ở chuột cho con bủ, oseltamivir vả chất chuyển hoá có hoạt tính được bải tiết vảo trong sữa. Ở
nguời, vẫn chưa biết liệu oscitamivir vả chất chuyến hoá có hoạt tính có được bải tiểt vảo trong sữa
mẹ hay không. Thế nhưng từ phép ngoại suy cùa các dữ liệu ở động vật, có thể dự đoán có khoảng
0,0 1 mg oscltamivir vả 0,3mg chất chuyền hoá có hoạt tinh được bái tiết vảo trong sữa mẹ mỗi ngảy.
. ớ
ỈoỈỉẢ' %“ I\zì
Khả năng da nhạy cảm với oseitamivir được ghi nhặn trong một xét nghiệm “tối đa hóa" ở chuột
iang. Sau khi gây kich ứng với di nguyên những con vặt thí nghiệm nảy, người ta thấy có khoảng
30% con vật được điều trị với hoạt chẳt chinh dơn thuần có xuất hiện ban đò. sớ gây kích ứng có hổi
phục ở mắt thờ cũng đã được phảt hiện.
Trong khi liều rất cao oseltamivir phosphat dùng đường uổng đã khỏng gây ra một biển cố bẳt iợi
nảo ở chuột trướng thảnh, thi liểu nảy lại gây độc tinh ở chuột con 7 ngảy tuối, kể cả từ vong. Những
biển cổ bắt lợi nảy đã được ghi nhận với liểu 657 mg/kg vả cao hơn. ớ iièu soo mg/kg, khỏng có
biển cố bắt iợi nảo được ghi nhận, kể cả khi điểu …; lâu dải (chưột 7 dến 21 ngảy tuối dùng 1iều soo
mglkglngảy).
4. cÁc ĐẶC TỈNH DƯỢC nọc
4.1 Bâo quãn và hạn dùng
Viên nang: bảo quản thuốc ở nhiệt độ dưới 30°C. Hạn dùng: 5 năm kể từ ngáy sản xuất.
Bột pha huyền dịch uống: không bảo quản thuốc ở nhiệt độ trêh 25°C.
Hưyền dich dã được pha: bảo quản thuốc ở nhiệt độ phòng (không quá 250C) trong 10 ngảy hay
trong ngăn mảt tủ lạnh (2°C - 8°C) trong 17 ngảy.
4.2 Hưởng dẫn đặc biệt cho việc sử dụng. hùy bỏ thuốc
Huỳ bỏ thuốc không sử dụuglhểt hạn
Cần hạn chế việc thâi bò dược phẫm ra môi trường. Không thâi bỏ dược phẫm qua hệ thống
nước thâi vã tránh vứt bỏ vão rảc thâi sinh hoạt. Hãy sử dụng “hệ thổng thu gom“ ở địa
phương, nễu cỏ.
Độ ổn đinh
Không nên sử dụng thuốc sau ngảy hết hạn được ghi ở vỏ hộp.
Cảch sử dụng vả hủy bỏ
Chuẩn hi hôi Tamifht cho đang hnvền dich t_iégg
Bột Tamifiu cho dạng huyến dich uổng nên được pha bởi dược sĩtrước khi đưa cho bệnh nhân (Xem
mục 2.2 Liễu luợng vả Cách díuig):
]. Vỗ vảo lọ thuốc đóng kin vải iần đề thuốc tơi ra.
2. Đong 52 ml nước. Sử dụng cốc lường nước (được cung cẳp sẵn) vả đong nuớc đến tnức đã
chỉ định.
3. Đồ 52 ml nước vảo 1ọ thuốc để pha thuốc vả 1ắc kỹ lọ thuốc đã dược đóng kín trong 15 giây.
4. Mở nắp lọ thuốc (loại bảo vệ không cho trẻ mở) vả ẩn bộ phận tiểp hợp vảo cố iọ thuốc.
s. Đóng náp bảo vệ lọ thuốc lại thật chặt. Điều nảy giúp cố định đủng chỗ bộ phận tiếp hợp ở tọ
thuốc vả khả năng bảo vệ cùa nắp iọ thuốc.
18
\2.\ \'dUJ:
Tờ hướng dẫn sử dụng và ống lấy thuốc sẽ được đưa cho bệnh nhân. Nên viết ngảy hết hạn cùa
huyền dịch đã pha trện nhãn thuốc.
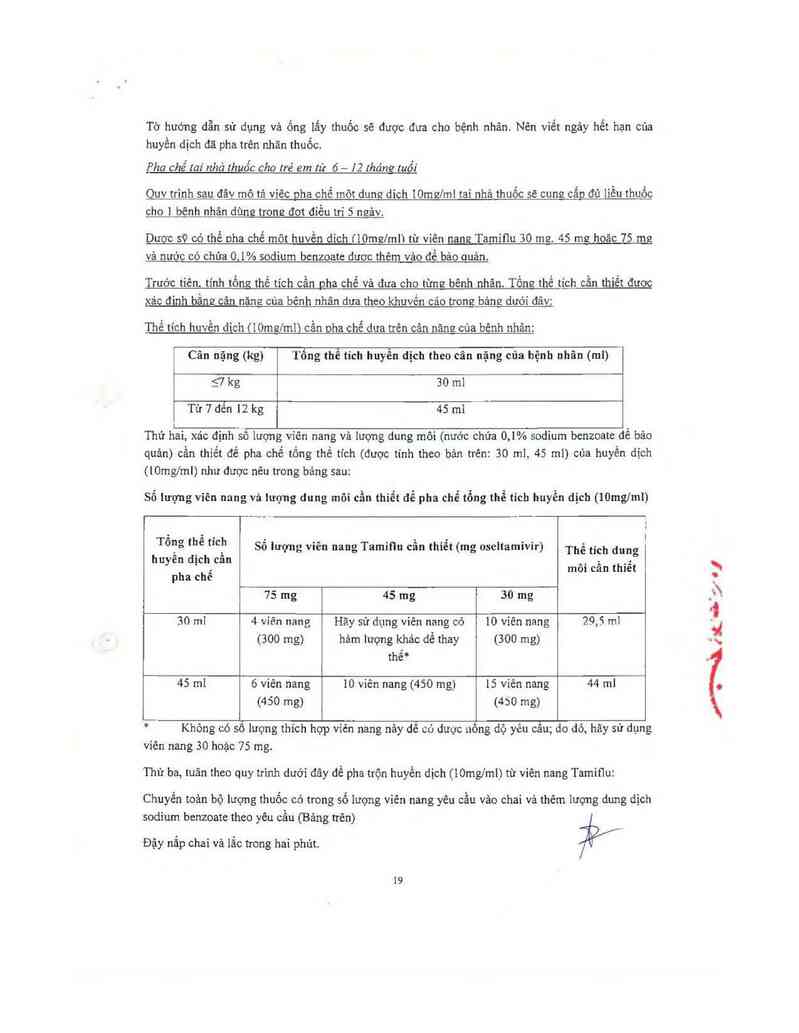
Pha chế tai nhả lhuốc cho trẻ em từ 6 — IZ !hănQ tuổi
Ouv trình sau đâv mô tả viêc nha chế môt dung dich 10mưlml tai nhả thuốc sẽ cung cắn đủ iiều thuốc
cho ] bênh nhân dùng trong đo’t điều trí 5 neảv.
Dươc sỹ có thề ợha chế mõt huvền dich (lOmc/mlì từ viên nang Tamiiiu 30 mg. 45 mg hoăc 75 mg
và nước có chứa 0.1% sodium bcnzoate đươc thêm vảo để bảo ouản.
Trước tiên. tính tống thề tich cần pha chế và đưa cho từng bênh nhân. Tồne thề tich cần thiết đươc
xác đinh bằng cân năng cùa bênh nhân dưa theo khuvền cảo trong bảng dưới đâv:
Thế tich huvển dich tiOmc/mii cần oha chế dưa trên cân năng cùa bênh nhân:
Cân nặng (ttg) Tổng thể tich huyền dịch theo cân nặng cùa hệnh nhân (ml)
g kg 30 ml
Từ 1 đên 12 kg 45 ml
[ .
Thứ hai, xác định sô 1ượng viên nang vả Iượng dung môi (nước chứa 0,1% sodium bcnzoatc đê bâo
quản) cần thiểt để pha chế tồng thế tich (được tính theo bản trên: 30 mi, 43 ml) của huyền dịch
(10mg/mi) như được nêu trong bảng sau:
Sổ iượng viên nang vả iượng dung môi cần thiết dễ pha chế tổng thể tich huyền dịch (lOmg/mi)
7. l › , o 0 '
Tong the th Sô lượng vỉên nang Tamiqu cân thiẽt (mg oseilamivir) Thể tich dunơ
huyên dịch cãn .. ~. .:b
: mot can thiet
pha che
vs mg 45 mg 30 mg
30 ml 4 vỉên nang Hãy sử dụng viên nang có 10 viên nang 29,5m1
(300 mg) hảm lượng khác dế thay (300 mg)
thế*
45 ml 6 viên nang 10 viên nang (450 mg) 15 viên nang 44 ml
(450 mg) (450 mg)
*— Không có số lượng thích hợp viên nang nây dễ có dược nông dộ yêu câu; do dó, hãy sử dụng
viên nang 30 hoặc 75 mg.
Thứ ba, tuân theo quy trinh dưới đây để pha trộn huyền dịch (_ lOmg/mi) từ viên nang Tamiflu:
Chuyển toản bộ lượng thuốc có trong số lượng viên nang yêu cầu vảo chai vả thêm lượng đung dịch
sodium benzoatc theo yêu cầu (Bảng trên)
Đậy nắp chai và lẳc trong hai phủt.
/NềLỔ'ỹơ
Dán nhãn phụ lên chai ghi rõ “Lắc nhẹ trước khi dùng”
Hướng dẫn cha mẹ hoặc người chăm sóc bỏ đi bất kỳ dung dịch nảo còn thùa sau khi bệnh nhãn đã
hoản thảnh đợt điểu trị.
Dán nhản ghi hạn dùng thich hợp tuỳ theo điều kiện bảo quản (xem dưới đây).
Bảo nuân huvền dich thuốc flOmư/mllpha chế ở nhả thuốc:
Điều kiện bâo quản ở nhiệt độ phộng: Ỏn định trong 3 tuần <21 ngảy) khi được bảo quản ở nhiệt độ
phòng “không quá 250C".
Điều kiện bảo quản iạnh: Ón định trong 6 tuần khi dược bảo quản ở nhiệt độ từ 2°c đển 8°C.
Dán nhản của nhả thuốc trẻn chai ghi rõ tên bệnh nhân, huớng dẫn sử dụng, ngảy hết hạn, tên thuốc
vả bất kỳ thỏng tin bắt buộc nảo khảc theo quy định về dược phẩm cùa địa phương. Xcm bảng dưới
đây về hướng dẫn liều dùng thích hợp.
Liều dùng cùa huyển dịch (iOmglmi) pha chế tại nhả thuốc từ viên nang Tamifiu cho trẻ cm tử 6~12
tháng tuối (3 mglkg cân nặng)
Cân nặng 1 Liều điểu trị (trong 5 ngảy)
6 kg 1,8 ml ngảy hai lẫn
7 kg 2,1 mi ngảy hai lần 1
8 kg 2,4 ml ngảy hai 1ần
1 9 kg 2,7 ml ngây hai lân
a 10 kg 3,0 ml ngảy hai lần
Ghi chú: Quy trình pha chế nảy tạo ra một huyền dịch IOmg/ml, khác với nồng độ của. huyền dịch do
Bột pha huyền dịch Tamifiu sẵn có trên thị trường.
Chia liều huyền dịch nảy bằng xy lanh cỏ vạch lường thuốc uống để đong những lượng huyền dịch
nhỏ.
Liều thuốc phù hỌp sẽ được người chăm sóc trộn với lượng tương tư đồ uổng ngọt, như nước đường.
si rô socholate, si rô anh đảo, kem phủ bánh (như caramei hoặc sốt kem bơ) để che dắu vị đắng.
4.3 Đóng gói
Víên nang 30 mg. Hộp ] vi chứa 10 viên.
Viên nang 45 mg. Hộp 1 ví chứa 10 viên.
Viên nang 75 mg. Hộp 1 ví chứa 10 viên.
Lọ chứa bột để pha huyền địch uống. Hộp 1 1o.
&
“U
lồỹm `\°"
Thuốc: Để xa tầm với của trẻ em.
Đọc kỹ hướng dẫn sử dụng trước khi dùng. Nếu cần bỉểt thêm thông tin xin hỏi ý kiểu bảc sĩ
của bạn.
Chi sử dụng theo sự kê đơn của bác sĩ.
Lưu hảnh thảng 12 nảm 2010
Sản xuất tại Thụy Sỹ bới F.Hoffmann-La Roche Ltd.
124 Grcnzachcrstrasse, CH-4070 Basel
21
|.91ă3.ạ… \`\
Hướng dẫn nha trôn thuốc:
Trong trường hợp huyền dịch uống Tamifiư không sẵn có, người lớn, thanh thiểu niên vả trẻ em
không thể nuốt viên thuốc có thể uống đúng iiều Tamifiu bầng cảch mớ viên nang và cho toản bộ
iượng thuốc trong viên nang vảo một lượng nhỏ (tối đa 1 thìa cả phê) đồ uống ngọt như siro
chocolate thường hoặc loại không đường, mặt ong (chi dảnh cho trẻ cm từ hai tuối trở lên), đường
nâu sảng hoặc đường tinh khỉểt hoả tan trong nước, kem tươi, sữa đặc có đường, nước sốt tảo hoặc
sữa chua để che dấu vị đắng cùa thuốc. Khuấy đều hỗn hợp và đưa cho bệnh nhân. Cần uổng hỗn
hợp nảy ngay sau khi pha chế.
Lảm theo hướng dẫn sau để đảm bảo đủng liều lượng.
1. Xác định số lưọng viên nang cẩn thiết để pha huyễn dịch:
_Ế Số iượng viên nang cần thiễt để đạt Ý Số lượng viên nang cần thiết để đạt
Cân nặng* được liều khuyến cảo cho 5 ngảy điều được liều khuyến cáo cho phòng
. trị bệnh
5 15 kg 1 viên nang 30 mg 2 lần/ngảy 1 viên nang 30 mg 1 lân/ngảy
> 15 Ìt_đ* . .
23 Ễg en 1 viện nang 45 mg 2 Iân/ngảy 1 viên nang 45 mg 1 lân/ngảy
› 23 k đ '
40 Ễg en 2 viên nang 30 mg 2 iẩn/ngảy 2 viên nang 30 mg 1 lần/ngảy
“Trẻ em cân nặng trên 40 kg có thẻ dùng liêu giông người lớn: viên nang Tamitiu 75 mg 2 iânlngảy
cho 5 ngảy điều trị hoặc 1 lần/ngảy để phòng bệnh.
2. Hãy kiếm tra bạn sử dụng đúng liều theo như bảng trên. Cẩm một viên nang phía trên một cái bát
nhỏ, cần thận mở viên nang vả cho bột thuốc vảo trong bát.
3. Thêm một lượng nhỏ (tối đa 1 thia cả phê) đồ uống ngọt (để che dắu vị đắng) vảo bát vả trộn đều.
4. Khuẩy đều hỗn hợp nảy vả đưa bảt cho bệnh nhân uống. Hỗn hợp nảy cần được ưống ngay sau khi
pha chế. Nếu còn lại một it hỗn hợp thuốc ở trong bát, cằn trảng 1ại bát bằng một lượng nhỏ nước vả
cho bệnh nhân uống lượng hỗn hợp nảy.
Lăp Iai guv trình nảv mỗi khi ban cần uống thuốc
nm g dẫn pha trôn thuốc
Trong trường hợp huyền dịch ưống Tamitlu không sẵn có, người lớn, thanh thiểu niên và trẻ em
không thể nuốt viên thuốc có thể uống đủng liễu Tamit'1u bằng cảch mớ viên nang vả cho toản bộ
lượng thuốc rrong viên nang vảo một lượng nhỏ (tối đa 1 thia cả phê) đồ uống ngọt như siro
chocolate thường hoặc ioại không đường, mật ong (chi dảnh cho trẻ em từ hai tuổi trở lẽn), đường
nâu sảng hoặc đường tinh khiểt hoả tan trong nước, kem tươi, sữa đặc có đường, nước sốt táo hoặc
sữa chua để che dẩu vị đắng của thuốc. Khuẳy đểu hỗn họp và đưa cho bệnh nhân. Cần uống hỗn
hợp nảy ngay sau khi pha chế.
Với những bệnh nhân cần dùng liều 30 — 60 mg, lảm theo hướng dẫn sau để đảm bảo dùng đủng liễu:
22
lãi ttồ .’“ảizl
1. Cầm một viên nang Tamifiu 75 mg phia trên một cải bảt nhò, cẩn thận mờ viên nang vả cho
bột thuốc vảo trong bảt.
2. Thêm 5 ml nước vảo lượng bột thuốc nảy, dùng một xi-lanh có đánh dắu (xi-ianh có vạch
chia) đề xảc định chinh xảc lượng dịch được hủt lẽn. Khuấy đều khoảng 2 phủt.
3. Dùng xi-ianh hủt một iượng chinh xảo hỗn hợp từ bảt. Xem báng dưới dây để xác định lượng
hỗn hợp cần dùng, dựa trên cân nặng cùa bệnh nhân. Không cần thiết phải hút iên bột mầu
trắng không tan vì đây lả chắt không có tảc đụng. Đẩy pit-tông cùa xi—lanh xuống để cho toản
bộ iượng thuốc nảy vảo bát thứ hai. Loại bỏ phần hỗn hợp không sử dụng
Trọng iượng cơ thê Liều khuyên dùng Lượng liỗn hợp Tamii'lu cho 1 liều
S 15 kg 30 mg 2 mi
› 15 kgđễn 23 kg 4Smg 3m1
> 23 kg đến 40 kg 60 mg 4 mi
4. Liều khưyên dùng iả 30 mg, 45 mg hoặc 60 mg, hai lằn mỗi ngảy trong 5 ngảy để điều trị vả
một iần mỗi ngảy đề phòng bệnh.
5 . Trong bảt thứ hai, thêm một lượng nhỏ (tối đa 1 thìa cả phê) đồ uổng ngọt vảo hỗn hợp thuốc
nảy (để che dẩn vị đắng) vả trộn đểu.
6. Khuẳy đều hỗn hợp nảy vã đưa toản bộ bát thứ hai cho bệnh nhân uống. Hỗn hợp nảy cằn
được uống ngay sau khi pha chế. Nếu còn lại một ít hỗn hợp thuốc ở trong bảt, cần trảng lại
bảt bằng một lượng nhỏ nước vả cho bệnh nhân uống lượng hỗn hợp nảy.
Với những bệnh nhân cần dùng liều 75 mg, Iảm theo hưởng dẫn sau:
1. Cấm một viên nang Tamỉfiu 75 mg phia trên một cải bát nhò, cẩn thận mớ viên nang vả cho
bột thuốc vảo trong bát.
Thêm một lưọng nhỏ (Lối đa 1 thia cả phê) dỗ uống ngọt (“để che dẳu vị đắng) vảo bát vả trộn
đều.
3. Khuấy đều hỗn hợp nảy vã đưa bát cho bệnh nhân uống. Hỗn hợp nảy cần được uống ngay
sau khi pha chế. Nếu còn lại một ít hỗn hợp thuốc ở trong bảt, cần tráng iại bảt bằng một
lượng nhỏ nuớc và cho bệnh nhân uống lượng hỗn hợp nảy.
lb)
.. . \ \ 7… c Ă Ả Ả
La lat u trinh na mm khi ban can uon thuoc
% 17...
' inii'-vn '1'1`111"
11.11 t …
Nguyễn Thị Minh Thảo
23
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng