












BỘYTỀ
CỤCQUẢNLÝDƯỢC
ĐÃ PHÊ DUYỆT
PREPRESS - IMFOFỀFvLQT' ON
4M/gp ~Đ
PREPRESS - ROCHE BASEL
CUSTOMER
Format 52 x 18 x 430 mm €e'ntrol Proof New Proof Corrections
RGngtĐl' NT. 86.4.2258 Date: ............................ Date: ............................ Date: ............................
NP 7812
26.03.2010 12:51:48 Wsa: ............................ visa: ............................ Vtsa: ............................
Grundschrilt 7 Punkt
OK for Printing Control File OK for Printing
A ,, Date: ............................ Date: ............................ Date: ............................
BỌY1E
CUC OlJẨN LÝ DUƠ : Visa: ............................ Visa: ............................ Visa: ............................
1011778² FE
FILM t VON 4
Pantone Black
26.03.10
+A,
…đảApPHE Dlơih'vlẵễ
FILM 2 VON 4 FILM 3 VON 4
PMS 300 PMS 327
zỡíiiịiiodziuẮẵđfspamA}
___/ '
\_(
'hmlflu'
Osclummr
Medicin e: keep out ot rea ch of children
Dosagc and administration: see package insert
t vièn nang = 75 mg oseltamỉvlr
dưới dang muôn pnosphat
Dùng đường uỏng
Hòp chừa 10 vien nang trong 1 ví
Các thõng tin khảc (như chỉ định. chóng chỉ fflnh, liêu
) xin xem trong tờ hướng dẳn sử
vá cách dùng
dung kem theo
Báo quản ở nhtèt độ dưới 30 °C.
1 caps. = 75 mg oseltamivir.
sub torma oseitamivir. phosphat.
THUỐC CHÍ BẢN Tneo ĐơN.
ĐỂ XA TÀM TAY CUA TRẺ EM.
oọc KỸ HƯỚNG DẢN sứ DỤNG TRƯỜC KHI DÙNG
Số đảng kỷ :
Sản xuát cno F.Hoffmann-La Roche Ltd, Basel. Thuy
Sỹ bớ: Roche S.p.A., Via More… 2. Segrate. italy
Nhã nhảp khấuị
NSX HD, sô lò SX' xem phản MFD, EXP. Batch No
in trẻn bao bì Ngay SX vá ngảy nêt han lả ngáy 01
cùa tháng
+
7
_llllủ,
. ' .
(Batch nc)
MFD
|
m
JJỈ'Z-ỉl ___ __
Mt=u 'aauôas aus uotunpmd 'uqụ ' ::vđ-saNm -
^q 'pueụazums 'lasee '… …… e1—uue
Tamillu'
Dsettamivit
cm 10 upsulu
`J mt_apew ,
@
\ịẦ H
\ Oseltamivir ị Oseltamivir 41
75 mg 75 mg Ế" 75 mg ,
Tamiflu® Tamiflu® — Tamiflu® ả Tamiflu® Ta
Oseltamivir Oseltamivir <ỄỀ> Oseltamivir Oseltamivir @) Ose
75 mg , 75 mg . 75 mg 75 mg , 75 m
_ Tam1flu® Tamthu® Tam:flu® › ›
Oseltamivir Oseltamivir Oseltamivir <“ì
75 mg 75 mg 75 mg - '
Tamiflu® Tamiflu® — Tamiflu® g Tamiflu® Tan
Oseltamivir Oseltamivir <ỂẾỂ> Oseltamivir ị Oseltamivir Oseltamivir <"ElỒ Oseltamivir ; Oseltamivir <Ê
75 mg 75 mg ả 75 mg
Tamiflu® -— Tamiflu® ,— Tamiflu® Tamiflu® — Tan
Oseltamivir <Ủầ Oseltamivir `xRÉ> Oseltamivir Oseltamivir Oselt
75m , 75m _ 75m 75 mg _ 75m
g Tamuflu® ỉ Tam:flu® g _ Tamthu® -
Oseltamivir ỐÍ°ỆE> Oseltamivir Q <ủc_he> Oseltamivir Q
75 mg 75 mg Ế 75 mg
Tamiflu® … Tamiflu® Tamiflu® a Tamiflu® — Tan
Oseltamivir <ỀẾ) Oseltamivir Oseltamivir ẫ Oseltamivir Oselt
75m _ 75m _ 75m “' 75 mg _ 75n~
i Tamtflu® _g, Tamtflu® g Ể Tamanu® ,
@) Oseltamivir Oseltamivir <Ẻ
75 mg 75 mg 75 mg
Tamiflu® Tamiflu® Tamiflu® Tamiflu® Tan
Oseltamivir Oseltamivir Oseltamivir Oseltamivir @) Oselt
75m , 75m , 75 mg 75 mg _ 75m
,ỉ Tamthu® g Tamnflu® Q _ Tamanu® -
<Ề“) Oseltamivir Oseltamivir Ề <Ề) Oseltamivir Q
75 mg 75 mg Ễ 75 mg
Tamiflu® '—x Tamiflu® ’“Ế Tamiflu® Tamiflu® Tan
Oseltamivir <ỂẺỀ Oseltamivir ỔỆ Oseltamivir ẵ Oseltamivir ẹễelt
75 m _ 75 m . 75 mg 5 75 mg _ m
ỉ Tamthu® g Tamtflu® _ _ Tamthu® -
<Ủ> Oseltamivir @) Oseltamivir Oseltamivir <Ẻ
75 mg 75 mg 75 mg
Tamiflu® ~—44 Tamiflu® ~—ì Tamiflu® Tamiflu® Tan
Oseltamivir <ỂẾỀ Oseltamivir <ỄẾ' Oseltamivir Oseltamivir Oselt
75m _ 75m _ 75 mg 75 mg _ 75m
ỉ Tamuflu® g Tamthu® _ … Tamtflu®
Oseltamivir Oseltamivir Oseltamivir Ổ
J".
Rx
Tamiflu®
Oseltamivir
1. MÔ TẢ
1.1 Nhóm dược lý | đíều trị
Tamiflu là một thuốc kháng vi rủt
1.2 Dạng dược phẩm
Viên nang cứng
Viến nang 30 mg gồm thân nang mờ đục_mảu vảng nhạt có in chữ "ROCHE“ vả nắp mờ đục mảu vảng nhạt có in "30mg”.
Chữ in mã… xanh.
Viên nang 45 mg gồm thân nang mờ đục mảu ghi có in chữ "ROCHE“ vả nắp mờ dục mảu ghi có ỉn "4Smg”. Chữ in mảu
xanh.
Viên nang 75 mg gồm thân nang mờ đục mảu ghi có in chữ "ROCHE“ vả nắp mờ đục mảu vâng nhạt có in "75mg”. Chữ in
mảu xanh.
Bột pha huyền dịch uống.
Bột dạng cốm rời hoặc kết khổi có mảu trắng đến vâng nhạt.
1.3 Đường dùng
Đường uống.
1.4 Tính vô trùng/ Bức xạ lạ
Không áp dụng.
1.5 Thảnh phẩn định tính và định lượng
Hoạt chẩt: oseltamìvỉr phosphatc.
Mỗi viên nang 30mg chứa 39,4mg oseltamívir phosphate, tuơng đương với 30mg oseltamivir.
Mỗi viên nang 45mg chứa 59,1mg oseltamivir phosphate, tượng đương với 4Smg oseltamivir.
Mỗi viên nang 75mg chứa 98,5mg oseltamivir phosphatc, tương đương với 75mg oscltamivir.
Bột pha huyền dịch uống, khi được pha với nước tới nồng độ 1,2% có chứa 12mg/ml oscltamivìr.
Bột pha huyền dịch uống, khi được pha với nước tới nổng độ 0.6% có chứa ómg/ml oseltamivir.
Danh sách tả dược
Sorbitol vả sodium bcnzoate
Tá dược lrong viên nang: Pre-gelatinized starch, Povidone K 30, Croscarmellose sodium, Tale, Sodium stearyl fumarate.
Tá dược Irong bộ! pha huyền dich: Sorbitol, Titanium dioxide, Sodium bcnzoatc, Xanthan gum, Monosodium citrate,
Saccharin sodium, PERMASEAL 11900—31 Tutti Frutti.
2. CÁC ĐẶC TÍNH LÃM SÀNG
2.1 Chỉ định điều trị
Tamit1u được chỉ định để điều trị bệnh củm ở người lớn và trẻ cm từ sáu tháng tuồi trớ Iến. (Xem mục 2.2.1 Những hướng
dẫn liếu dùng đậc biệt, 2.4 Những Cánh báo và Thận trọng và mục 3.3 Tính an toản tiến lâm sâng)
Tamifìu dược chỉ dịnh đề phòng ngừa bệnh cúm ở người lớn và trẻ em từ một tuối trở lên.
z.z. Liều lượng vâ Cách dùng
Tamifìu có thế đuợc dùng kèm hoặc không kẻm theo thức ăn. (Xem mục 3.2 Các đặc tính dược động học). Tuy nhiên, dùng
Tamiflu kèm với thửc ăn có thề lảm tăng khả năng dung nạp thuốc ở một số bệnh nhân.
Trong trường hợp huyền dịch uống Tamiflu không sẳn có, người lớn, thanh thiếu niên và trẻ em không thế nuốt viến thuốc
vẫn có thế uổng đúng liều lượng (xem phần Hướng dẫn pha trộn ớ cuối tờ hướng dẫn sử dụng nảy). Pha chế tại hiệu thuốc là
lựa chọn tốt nhất.
Điều trị bệnh cám
Nên bắt đầu diều trị vảo ngảy thứ nhất hoặc ngảy thứ hai khi xuất hiện các triệu chứng đằu tiên cùa bệnh cúm.
Người lớn vả thanh [hiếu niên:
Ở người lớn và thanh thiếu niên từ 13 tuội trớ lên, liều khuyên dùng lá uống viên nang Tamiũu _75mg hai lần mỗi ngảy, trong
5 ngảy. Trong trường hợp không thế nuôt được viên nang, có thế dùng dạng huyên dịch với liêu 75mg Tamiflu hai lần mỗi
ngảy, trong 5 ngảy.
Trẻ em.
Trẻ có cân nặng trên 40 kg nếu có thế nưốt được viên nang, cũng có thế_được điếu trị với lỉều uống viên nang 75mg hai lần
mỗi ngảy hoặc một viên nang 30mg cộng với một viên nang 4Smg hai lân mỗi ngảy, thay vì dùng Tamiqu dạng huyên dịch
vởi liêu khuyên dùng như bảng dưới đây.
Liều uống đươc khuỵên dùng cua Tami/ht cho Iré lù mói mồi trở lẻn:
Trọng lượng cơ !hể Liều khuyên dùng Irong 5 ngảy Lượng huyền dịch uống (6mg/mL)
s 15 kg 30 mg hai Iẳn mỗi ngảy s.o ml hai lần mỗi ngảy
› 15 kg đến 23 kg 45 mg hai lần mỗi ngảy 1.5 ml hai lần mỗi ngảy
› 23 kg đến 40 kg 60 mg hai lần mỗi ngảy 10.0 ml hai lần mỗi ngảy
> 40kg 75 mg hai lần mỗi ngảy 125 ml hai lần mỗi ngảy
Liều đùmar đường nống của Tami/ĩu đươc khgvến cáo cho lrẻ 6- [2 tháng tuồi:
Dựa trên dữ 1ỉệu dược động học còn hạn chế hiện có, với liều dùng 3 mglkg hai lần mỗi ngảy ở trẻ 6 — 12 tháng tuối trong 5
ngây. _
Tamiflu dạng bột pha huyến dịch uống nên được pha chế bời dược sĩ truớc khi dùng cho bệnh nhân (Xem mục 4.2 Hướng dân
dặc biệt cho việc sử dụng, hủy bỏ thuôc).
Phòng ngừa bệnh cám
Người lớn và lhanh rhiếu niên.-
Liều uống TamiHu khuyên dùng để phòng ngừa bệnh củm sau khi tỉểp xúc với người bị nhiễm củm lả 75mg ngảy một lần,
trong 10 ngảy. Nên bắt đầu việc sử dụng trong vờng hai ngây sau khi tiếp xúc với ngưồn bệnh. Liều khuyến dùng để phòng
bệnh củm trong suốt thời gian có dịch 6 cộng đồng là dùng 75mg ngảy một lần. Tính an toản vả hìệu quá cùa việc dùng thuốc
đã được chứng minh cho tới 6 tuần. Chùng nảo vẫn còn dùng thuốc thì thời gỉan bảo vệ cùa thuốc vẫn còn.
Trẻ em lù ] Iuồi:
Trẻ có cân nặng trên 40 kg nếu có thề nuốt được víên nang, củng có thẻ dược đìểu trị phòng bệnh cúm vởi viên nang 75mg
một iần mỗi ngảy hoặc một viên 30 mg cộng với một viên 45 mg một lần mỗi ngây, trong 10 ngảy, thay vì dùng Tamifìu dạng
huyền dịch với liều khuyên dùng như báng dưới đây.
Liều uống đuơc khuvên dùng ct`ta Tamiflu để phỏng ngửa bênh cúm cho Iré từ mỏ! mõi trở lẽn:
Trọng lượng cơ thể Liều khuyên dùng Irong 10 ngòy Lượng huyển dịch uống (6 mg/ij
S 15 kg 30 mg ngảy một lần 5.0 ml ngảy một lần
> 15 kg đến 23 kg 45 mg ngảy một lần 7.5 ml ngảy một iần
› 23 kg đến 40 kg 60mg ngảy một lần 10.0 ml ngảy một lần
> 40kg 75mg ngảy một lần 12.5 ml ngảy một lẫn
Tamìfìu dạng bột pha huyến dịch uổng nên được pha chế bời dược sĩ trước khi dùng cho bệnh nhân (Xem mục 4.2 Hướng dẫn
đặc biệt cho việc sư dụng, hùy bỏ thuôc).
2.2.1 Những hướng dẫn liều dùng đặc biệt:
Bệnh nhân suy Iliận
Điếu !rị bệnh cúm
Không cần điều chinh liểu cho những bệnh nhân có độ thanh thải creatinỉne trên 60 mllphút. Ở những bệnh nhân có độ thanh
thái creatinine từ 30—60 m1/phút, cân giám liếu Tamỉfìu xuống 30mg uống hai lần một ngảy, trong 5 ngảy. Ở những bệnh nhãn
có độ thanh thái creatinine từ 10-30 mI/phủt, cần giám liều Tamifiu xuống 30mg uống ngảy một lần, trong 5 ngảy. Ở những
bệnh nhân đang thẩm phân máu định kỳ, nêu triệu chứng củm xuất hiện trong khoáng thời gian 48 giờ giữa hai lần thấm phân
mảu có thể dùng Iiếu khới đầu 30 mg Tamiflu trước khi bắt đầu thẩm phân máu. Đê nồng độ thuôc trong huyết tuong được
duy trì trong khoáng trị liệu, nên dùng một liếu 30 mg Tamỉf1u sau mỗi lẳn thấm phân mảu. Đối với thấm phân phủc mạc, nên
dùng một liểu 30 mg Tamii1u truớc khi bắt đầu thẩm phân máu và sau đó bổ sung cảc lỉều 30 mg mỗi 5 ngảy (Xem mục 3 2 5
Đặc tính Dược động học ở những dối tuợng đặc bỉệt vả mục 2. 4 Những Cảnh bảo và Thận trọng) Dược dộng học cùa
oseitamivir chưa duợc nghỉên cứu ơ những bệnh nhân “bệnh thận giai đoạn cuối” (tức lả dộ thanh thái creatỉnỉn < lOml/ phủt)
khỏng đang thắm phân mảư. Do đớ, không có liếu khuyên đùng cho nhỏm bệnh nhân nảy.
Phỏng ngửa bệnh củm
Không cẩn điều chính liều cho những bệnh nhân có độ thanh thái creatinine trên 60 m1/phủt. Ở những bệnh nhân có độ thanh
thái c1cattnme từ 30-60 mllphủt, liều dùng Tamit1u nên được giám xuống còn 30mg, một ngảy ưống một lần. Ở những bệnh
nhân có độ thanh thái creatinine từ 10- 30 milphủt, cần giảm liếu Tamitlu xuống 30mg uống cách ngảy một lần. Ở những bệnh
nhân dang thẩm phân máu dịnh kỳ, có thể dùng liếu khớỉ đẩu 30 mg Tamíflu trước khi bắt đầu thẳm phân mảuí Đế nông độ
thuốc trong huyết tướng dược duy trì trong khoảng trị liệu, nên dùng một liểu 30 mg Tamif1u sau mỗi những lần thẩm phân
máu xen kẽ. Đối với thấm phân phúc mạc, nên dùng [ liều 30 mg Tamitlu trước khi bắt dầu thẩm phân máu và sau dó bổ sung
cảc Iìều 30 mg mỗi 7 ngảy (Xem mục 3 2.5 Dặc tính Dược dộng học ớ những đối tượng dặc biệt vả mục 2. 4 Những Cảnh báo
vả Thận trọng). Dược động học cùa oscltamivir cờn chưa dược nghỉên cứu ở những bệnh nhân “bệnh thận giai đoạn cuối”
(tức lả độ thanh thái creatinin < lOmll phút) không đang thấm phân mảu. Do đó, không có liều khuyên dùng cho nhóm bệnh
nhãn nảy.
Bệnh nhân suy gan
Không cần điều chinh liều cho những bệnh nhân bị rối loạn chức năng gan nhẹ hoặc vữa khi được điếu trị hoặc phòng ngừa
bệnh cúm (Xem mục 3.2.5 Đặc tính Dược động học ở nhũng dôi tượng đặc biệt). Độ an toản vả đặc tính dược dộng học ở
bệnh nhân suy gan nặng chưa dược nghiên cứu.
Bệnh nhân suy giảm mỉễn dịch
Vjệc dự phòng cúm mùa cho bệnh nhãn suy giám miễn dịch từ 1 tuối trớ lên được khuyên H: 12 tuần. Không cần diều chinh
liêu (xem mục 2.2).
Người giá
Không cần điếu chinh liếu cho người giả khi được điều trị hoặc phòng ngừa bệnh củm (Xem mục 3.2.5 Đặc tính Dược động
học ở những dối tượng đặc biệt)
Trẻ em
Tính hỉệu quá cúa Tamit1u ở trẻ dưới một tuối chưa được xảc lặp (Xem mục 3. 2.5 Đặc tinh Dược động học 0 những đối tượng
dặc biệt). Các dữ liệu dược động học gợi ý rằng liều 3 mg/kg hai lần một ngảy ờ tlẻ tù 6 đến 12 thảng tưổi cho nông độ chẩt
chuyền hoá có hoạt tính trong huyết tương ơ đa số bệnh nhi tượng tự như nồng độ có hìệu quả lâm sảng ớ trẻ lớn hơn vả
người lớn. Những dữ liệu lâm sảng hiện có chưa du dể đưa ra liều khuyên dùng cho trẻ dưới 6 thảng tuôi (xem mục 2.1 Chi
định điêu trị)
2 3 Chong chu dmh ễễ ,,
Quá mẫn với oseltamivir phosphate hoặc với bẩt kỳ thảnh phấn nảo của thuốc.
2. 4 Những Cảnh báo và Thận trọng
Co giật vả cảc biến cố tâm thần kinh giống như mê sáng đã được ghi nhận ờ những bệnh nhân củm dùng Tamii1u chủ yếu
xáy ra ở trẻ cm vả thanh thiếu niên. Trong một vải trướng hợp rắt hiểm gặp, các biến cố nây gây nên chắn thương do tai nạn.
Vai trò cùa Tamifiu dối với các biến cố nảy hiện vẫn chưa biết rõ và cảc biển cố nảy cũng đã được ghi nhận ở nhũng bệnh
nhân bị cúm mã không dùng Tamiflu. Ba nghiên cứu dịch tễ học quy mô lớn độc lập đã khắng định rằng các bệnh nhân nhiễm
củm đang dùng Tamií1u không có nguy cơ xáy ra cảc biến cố về tâm thẩn kinh cao hơn so với những bệnh nhân nhỉễm cúm
không dùng thuốc kháng vi rủt (xem phần 2.6.2 Sau khi lưu hảnh thuốc).
Bệnh nhân (dặc biệt trẻ em và thanh thìếu niên), cần được theo dỏi chặt chẽ cảc dấu hiệu hảnh vi bất thường.
Không thấy bằng chứng về hiệu quả cùa Tamifiu trong bất kỳ bệnh nảo gây bới các tác nhân khỏng phải vi rút cúm type A và
B.
Để điều chinh Iiểu cho những bệnh'nhân bị suy thận, xin xem mục 2.2.1 Những hướng dẫn liều đùng đặc biệt và mục 3.2.5
Đặc tinh Dược dộng học ở những đôi tượng đặc biệt
Một lọ Tamit1u 30g dế pha huyến dich uống có chứa 25 ,713g s0tbitol. Một liều 45mg oseltamivir uống hai lấn mỗi ngảy sẽ
đưa vảo cơ thể 2 ,6g sorbitol Với những bệnh nhân không dung nạp fructosc di truyền, iiều nói trên vuợt quá mức sorbitol tối
đa dược khuyên dùng hảng ngảy
2.4.1 Tác động lên khả năng lải xe và vận himh máy mỏc
Không áp dụng.
2. 4. 2 Tương tảc với các thuốc khác và các hinh thủc tương tác khác
Thông tin từ những nghỉên cứu về dược lý vả dược động học cưa oseltamỉvir phosphatc. cho thấy không có khả năng xảy ra
các tướng tảc thuốc có ý nghĩa về mặt lâm sảng.
Một lượng lớn oseltamivir phosphatc dược chưyên hoả thânh hợp chất có hoạt tính nhờ esterase, xảy ra chữ yếu ớ gan. Các
tương tảc thuốc do sự cạnh tranh với estcrạse vân chưa được bảo cảo nhiều trọng y văn. Do oseltamivír vả chât chuyền hóa có
hoạt tính đến găn kết kém với protein huyêt tương, khả năng tương tác do chiêm chỗ của thuôc khó có thẻ xáy ra.
Các nghìên cứu in vitro cho thắy cả oseitamivh phosphate lẫn chắt chuyến hoá có hoạt tính đều không phải là chất nền tốt cho
mcn oxidase có chức năng hỗn hợp P450 hoặc cho men glucuuonyl transferases. (Xem mục 3. 2. Các đặc tinh dược động học)
Không có cơ sở nảo về mặt cơ chế cho thấy có sự tương tảc với thuốc ngừa thai dùng đường uổng
Cimctidinc, một chất ức chế không đặc hiệu cưa các đồng dạng cytochromc P450 vả là chất cạnh tranh với nhũng thuốc gổc
ba—zơ hOặc thuốc cation hoá để bải tiết qua ống thận, không có ánh hưởng gì lên nổng độ trong huyết tương cùa oscltamỉvir
hoặc chắt chuyền hoá có hoạt tính của nó.
Xét về mặt lâm sảng, các tuong tác th uốc quan trọng có liên quan đến sự cạnh tranh để bải tiết qua ống thận khó có thề xáy ra
do gỉới hạn an toản đã được biết của hầu hết cảc thuốc, đặc điếm thái trù cùa chắt chuyền hoá có hoạt tinh (sự lọc ớ vì cần
thận vả bải tỉết ờ ống thận dưới dạng anion) vả khả năng thải trừ của những đường nảy. Dùng thuốc đổng thời với piobenecid
sẽ lảm tăng nổng độ cảc chất chuyến hoá có hoạt tính lên gần gấp đội do Iảm giám sự bải tiết chủ động của chúng ớ ống thận.
Tuy vậy, nhờ giới hạn an toân cứa chất chuyến hoá có hoạt tinh rẩt rộng nên không cần thiết phải diều chinh Iiếu khi dùng
thuốc chung với probenecid.
Dùng thuốc đồng thời với amoxicillin không lảm thay dối nồng dộ cứa cá hai loại thuốc trong huyết tương, điều nây cho thắy
rằng sự cạnh tranh để được bải tiết đưới dạng anion lả rẳt yếu
Dùng thuốc dồng thời với paracetamoi không Iảm thay đối nồng độ trong huyết tương cùa oseltamivir, chất chuyền hoá có
hoạt tỉnh của nó, hoặc paracetamol.
Không có tương tác thuốc về dược động học giữa oseltamivir hoặc chất chuyến hoá chinh cứa nó dược ghi nhận khi dùng
chung oscltamivir với paracctamoi, acid acetyl-salicyiỉc, cimetìdine hoặc các thuốc khảng acid (magnesium vả hydroxid
nhôm vả carbonate canxi), warfarin, rimantadine hoặc amantadinc.
Trong cảc nghiên cứu lâm sâng điều trị và dự phòng pha 111, người ta đã dùng Tamifiu chung với cảc thuốc thông dụng khảc
như thuốc ức chế men chuyến (enalapưl, captopril), cảc thiazidc lợi tiểu (bendrofluazide), kháng sinh (pcnicillin,
cephalosporin, azithromycin, erythromycin vả doxycyciìnc), thuốc chẹn thụ thể H2 (ranitidine, cimetìdine), chẹn beta
(propranolol), cảc xanthine (theophylline), thuốc giông giao cảm (pseudoephedrine), chế phấm thuốc phiện (codeine),
corticosteroids, thuốc giãn phế quản dạng hít, và thuốc gìảm đau (aspirin, ibuprofen vả paracetamol). Không thắy có sự thay
đồi nảo về phản ứng phụ hoặc tần suất xuất hiện cảc phản' ưng phụ khi dùng Tamỉf1u chung với cảc thuốc nảy.
z.s. Sử dụng ở các đổi tượng đặc biệt
2.5.1 Phụ nữ có thai
Nguy cơ thai kỳ nhóm 8
Những nghìến cứu về tảc động cùa thuốc lên sự sinh sản ở động vật, được tiến hânh trên chuột vả thò, không ghi nhận hìện
tượng quải thai nảo. Những nghiên cứu về khả nãng sinh sán vả độc tỉnh sinh sản đã được tiểu hảnh trên chuột. Không thấy có
bằng chứng về anh huớng cùa thuốc lên khả năng sinh sản ớ tất cả cảc liều oseltamivir dược nghiên cứu. Ó chuột và thò,
người ta thấy nồng độ cúa thuốc ớ phôi thai khoảng 15-20% nồng độ thuốc cứa thú mẹ.
Trong khi không có thứ nghiệm lâm sảng có đối chứng đuợc tỉến hảnh về việc sử dụng oseltamivir ở phụ nữ mang thai, chi có
it dữ liệu từ cảc bảo các sau khi lưu hảnh thuốc và cảc nghiên cứu quan sát hồi cứu. Những dữ liệu nầy kết hợp với các
nghiên cứu trên động vật không cho thấy những tác hại trực tiếp hoặc giản tiếp dối với thai kỳ, sự phát triến phõi/thai hoặc
sau khi sinh (xem mục 3.3 An toăn tiền lâm sảng). Phụ nữ có thai có thế uổng Tamiflu, sau khi cân nhắc thông tin an toản sẵn
có, khả năng gây bệnh cùa chúng vi rủi cúm hiện hảnh và thể trạng cúa người phụ nữ có thai.
2.5.2 Bà mẹ cho con bú
Ó chuột cho con bú, oseitamivir vả chẳt chuyến hoá có hoạt tính được bải tiểt vảo trong sữa. Có rẩt ít thòng tỉn về trẻ em đuợc
nuôi bằng sữa cùa mẹ đang dùng oseltamivir vả về sự bải tiết cùa oseltamivir vảo sữa mẹ. Cảc dữ liệu hạn chế đã chi ra rằng
oscltamỉvir vả chất chuyến hoá có hoạt tinh cúa nó dã dược tìm thắy trong sữa mẹ, nhưng ớ nồng độ thấp, dưới mức dạt được
ở liều điều trị cho trẻ em. Sau khi cân nhắc thông tin nảy, tính gây bệnh cứa chứng vi rủt cúm hiện hảnh và tình trạng sức
khoẻ cứa bà mẹ cho con bủ, có thế xem xét đến việc sử dụng oseltamivir.
2.5.3 Sử đụng ở trẻ em
Xcm mục 2.2.1 Những hướng dẫn liều dùng đặc biệt và 3.2.5 Đặc tính dược động học ớ những đối tượng đặc biệt.
2.5.4 Sử dụng ở người lớn tuổi
Xem mục 2.2.1 Những hướng dẫn liếu dùng đặc biệt và 3.2.5 Đặc tính dược động học ở những đối tượng đặc bỉệt.
2.5.5 Suy thận
Xem mục 2.2.1 Những hướng dẫn Iiếu dùng đặc biệt và 3.2.5 Đặc tinh dược động học ở những đối tuợng đặc biệt,
2.5.6 Suy gan
Xem mục 2.2.1 Những hướng dẫn liếu dùng đặc biệt và 3.2.5 Đặc tinh dược động học ở những đối tượng đặc biệt.
Ổ :"
2.6. Các tác dụng không mong muốn
Thông báo cho hác sỹ những tảc đụng không mong muốn gặp phải khi sử dụng thuốc.
2.6.1 Các thử nghiệm lâm sảng
Thông tin an toản chung cùa Tamit1u được dựa trên dữ liệu từ hcm 2647 bệnh nhân người lớn/thanh thiếu niên vả 858 bệnh
nhân trẻ em bị củm, vả dụa trên dữ liệu từ hon 1945 bệnh nhân người 1ớn/thanh thiếu niên và 148 bệnh nhân trẻ em được
dùng Tamif1u để dự phòng cứm trong cảc thứ nghiệm lâm sảng. Trong cảc nghiến cứu điếu trị ớ người lớn/thanh thiếu niên,
các phản ứng ngoại y' hay gặp nhất là buồn nôn, nôn và đau đầu. Phần lớn cảc phản ứng ngoại ý nảy được báo cảo chí xuất
hiện một lần, xáy ra trong ngây điếu trị đẩu tiên hoặc thứ hai vả tự hết trong vòng 1-2 ngảy sau đó. Trong các nghiên cứu dự
phòng ớ người lớnlthanh thiếu niên, đa số cảc phán ứng ngoại ý dược bảo cảo là buồn nôn, nôn ói, đau đầu vả đau. Ó trẻ em,
phản ứng ngoại ý thường gặp nhất iả nôn ói. Ở phần iớn bệnh nhân, những phản ứng nảy không dẫn đến ngùng sư dụng
Tamifìu.
Điều trị vả dự phòng cúm ở ugu'ờĩ' lớn vả rluml: thiếu niên ễ ị/
Trong cảc nghỉên cứu điều trị vả dự phòng ớ người lớn/thanh thiếu niên, cảc phán ứng ngoại ý xuất hỉện thường xuyên nhất
(21%) 0 liểu khuyến cáo (75 mg, ngảy 2 lần, trong 5 ngảy để điếu trị và 75 mg ngảy một lần, có thể kéo dải đến 6 tuần để dự
phòng), vả tỷ lệ xuất hiện cảc phán ứng ngoại ỷ cao hơn ít nhẩt là 1% ở nhóm Tamiflu so với giá dược, được nếu trong báng
1.
Nhóm dân số trong câc nghiên cứu điều trị củm có cả những người 1ớn/thanh thiếu niên khoẻ mạnh vả những bệnh nhân “có
nguy cơ" (những bệnh nhân có nguy cơ cao gặp các biến chứng có liến quan với cúm, chắng hạn như các bệnh nhân lớn tuồỉ
vả cảc bệnh nhân bị bệnh timlbệnh hô hấp mạn tinh). Nói chung, thông tin về độ an toản ờ cảc bệnh nhân “có nguy cơ” iâ
tương đương về cảc loại phản ứng ngoại ỷ so với nhóm những nguời lớn/thanh thiếu niên khoẻ mạnh.
Cảc thông tin về độ an toản được báo cảo ở các đối tượng uống Tamif1u với 1iều khuyến cảo để dự phòng (75 mg ngây một
lẩn có thể kéo dải đến 6 tuần) cũng tượng tự về cảc loại phản ứng ngoại ý như những gì thấy được ở các nghiên cứu điểu trị
(Bảng 1), cho dù thời gian sử dụng thuốc trong cảc nghíến cứu dự phòng kéo dải hơn.
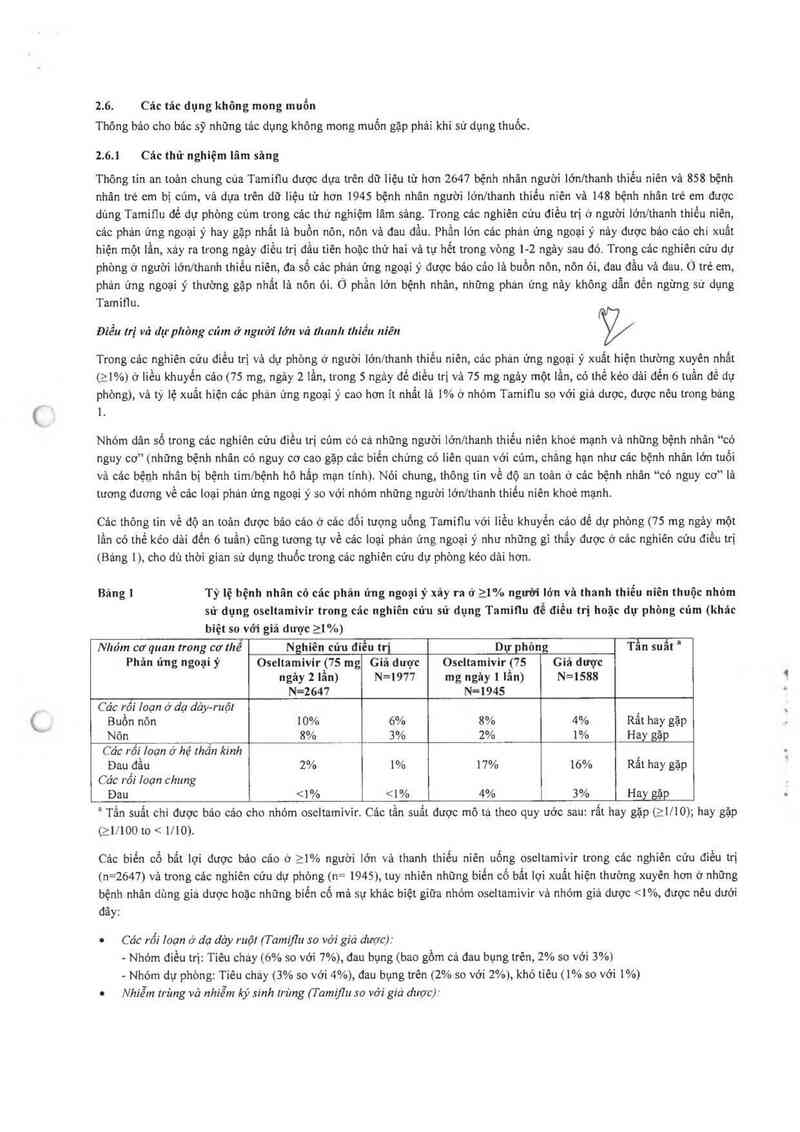
Bảng 1 Tỷ lệ bệnh nhân có các phản ứng ngoại ý xảy ra ở _>_1% người lớn vã thanh thiếu niên thuộc nhóm
sử dụng oseltamivir trong các nghiên cứu sử dụng Tamiũu để điếu trị hoặc đụ- phòng củm (khảc
biệt so với giả dược 21 %)
Nhóm cơ quan trong cơ thể Nghiên cún đìễu tri Dự phòng Tẫn suất “
Phản ủng ngoại ý Oseltamivir (75 mg Giả dược Oseltamivir (75 Giá duợc
ngảy 2 lần) N=1977 mg ngảy 1 lần) N=1588
=2647 N-1945
Các rồi loạn ở dạ da`y-ruộl
Buồn nôn 10% 6% 8% 4% Rất hay gặp
Nôn 8% 3% 2% 1% Hay gặp
Các rối loạn ở hệ lhân kinh '
Đau đầu 2% 1% 17% 16% Rât hay gặp
Các rồi loạn chung
Đau <1% 1% nhóm trẻ từ 1 — 12 tuối đuợc dùng oseltamivir trong các thử nghiệm lâm sảng
để diều trị cúm mãc phải tự nhiên (n= 858) và có tỷ lệ xuất hiện ở nhóm Tamii1u cao hơn ít nhất 1% so với nhóm giả dược
(n= 622), lả nôn ỏi (16% ớ nhóm osc1tamivir so với 8% ở nhóm giả dược). Trong số 148 trẻ được uống Tamìflu với liếu
khuyến cáo ngảy một lần trong một nghiên cứu dự phòng tại nhả sau phơi nhiễm cúm (n= 99), và trong một nghiên cứu khác
dự phòng cho trẻ em trong 6 tuần (n=49), nôn ỏi cũng là phản ứng ngoại ý hay gặp nhất (_8% ớ nhóm oseltamivir so với 2% ớ
nhớm không dự phòng). Tamit1u được dung nạp tốt trong cảc nghiên cứu nảy vả cảc biến cố bất lợi được ghi nhặn hoản toản
phù hợp với những gì đã quan sảt thẳy ớ cảc nghiên cứu điếu nị cho trẻ em bang Tamitiu truớc đó
Các biến cố bất lợi được bảo cáo ở > 1% trẻ cm được uống oseltamivir trong cảc nghiên cứu điều trị (n= 858) hoặc > 5% số trẻ
em trong cảc nghiên cứu dự phòng (n= 148), tưy nhiên những biến cố bất lợi xuất hiện thường xuyên hon ở những bệnh nhi
dùng giả dượclkhông dự phòng hoặc những biến cố mả sự khác biệt giữa nhóm oseltamivir và nhóm giả dượclkhông dự
phòng <1%, được nếu dưới dây:
' Các rối loạn dạ dảy ruột (Tamijlu so với giá dược) :
- Nhớ… điều trị: tiêu chảy (9% so với 9%), buồn nôn «% so với 4%), đau bụng (bao gồm cả đau bụng trên, 3% so với
3%)
o Nhiễm m`mg vả nhiễm ký sinh !rùng (T amifiu so với giả dược):
— Nhóm điều trị: viếm tai giữa tS°/o so với 8%), viêm phế quản (2% so với 3%), viếm phồi u% so với 3%), vìếm xoang
( 1% so với 2%)
0 Các rối loạn ở hệ hô hấp, lồng ngực vả trung Ihầl (T amijlu so với giả dược):
- Nhóm điếu trị: hen (bao gồm cả hen trầm trọng, 3% so với 4%), chảy mảu cam (2% so với 2%)
- Nhóm dự phòng: ho ( 12% so với 26%), sung huyết mũi (11% so với 20%)
0 Các rối loạn ở da và mỏ duới da ( Tamifiu so với giá dược) :
- Nhóm điều trị: vìêm da (bao gồm cả dị ứng và viếm da dị ứng, 1% so với 2%)
0 Các rối Ioạn ở Iai vả mê đao tiền đình (T amifiu so với gia' dươc):
- Nhỏm điều trị: đau tai (1% so với 1000F t' 37,80C) cộng với một triệu chứng vẽ_hỏ hâp (ho hoặc sô mũi), khi đang có sự hiện diện
cưa vi rủt cứm trong cộng đông. Trong nghiên cứu nảy, 67% bệnh nhi nhiêm vi rút củm type A vả 33% nhiêm vi rút củm type
B.
Điếu trị bằng Tamifiu, bắt đẳu tiong vòng 48 giờ khi có tiiệu chứng đằu tiên, đã lảm giảm đảng kế thời gìan bệnh khoảng
35, 8 giờ so với gia dược Thời gian bệnh đuợc xảc định là thời gian cho đến 1úc giảm các ti 1cu chừng ho, sung huyễt mũi, hết
sốt vả tiớ về tình trạng sức khoẻ và hoạt dộng binh thường. Tỷ lệ bệnh nhãn bị viêm tai giữa câp giảm khoảng 40% ớ những
bé được đíễu trị bằng Tamiflu so với dùng giá dược. Những bé được điều 111_ bằng Tamif1u cũng trở về tình uạng sức khoc“ và
hoạt động bình thường sớm hơn khoảng hai ngảy so với nhũng bé được dùng giả dược
Một nghiên cứu thứ hai đã hoản tất ớ 334 bé bị hcn phế quản từ 6 đến 12 tuối tiong đó 53,6% có vi rủt cúm dưong tính Ó
nhóm dược điếu t1ị bằng oscitamivir, thời gian bệnh trung binh khỏng đuợc giám đảng kế. Vảo ngảy thứ 6 (ngây điếu trị cưối
cùng), FEV; tăng khoảng 10_8% ớ nhớm được điếu tiị bằng oscltamivir, tiong khỉ ớ nhóm dùng giả dược chi tảng 4 ,7%
(p=0,0148).
Cảc thử nghiệm piiìmg hện/1 củm
Phỏng bệnh cúm ở người iờn vờ fhơnh thiếu niên.
Tính hiệu quả của Tamiiiu trong việc phòng bệnh củm A và B mắc phái tự nhìên, đă được chứng mỉnh trong ba nghìẽn cứu
pha 111 riêng biệt.
Trong một thư nghiệm pha III ở người lớn vả thanh thiếu niên tiểp xúc với người bị củm sống trong cùng một nhả, Tamiflu
được bât đầu dùng trong vòng 2 ngảy từ khi những đổi tượng nảy có triệu chứng củm đầu tiên vả dùng liên tục trong 7 ngảy,
đã Iảm gỉam đảng kế tỷ lệ mảc cúm do tiểp xúc khoảng 92%.
Trong một nghiên cứu mù dôi, có đối chứng với giá được được tiến hảnh ở những người trường thảnh khóc mạnh chưạ được
tiêm chùng, tuôi từ 18-65, ”lĩamiflu lâm giám đáng kê tỷ lệ măc bệnh củm có biếu hiện lâm sảng khoảng 76%, trong suôt thời
gian có dịch củm tại cộng đông. Những đôi tượng trong nghiên cứu nảy đã dùng Tamifiu trong 42 ngảy
Trong một nghiên cứu mù đôi, có đối chửng với gìả dược ở những người giả sống trong nhà dưỡng lão, 80% trong số họ được
tiêm chùng vảo mùa củm khi nghiên cứu nảy được tiến hảnh, Tamìt1u lảm giảm đảng kể t lệ măc bệnh cúm có biểu hiện lâm
sảng khoáng 92%. Cũng trong nghiên cứu nảy, Tamitìu lảm giảm đảng kế tỷ lệ viêm phe quản, viêm phổi và viêm xoang có
liên quan đến bệnh cúm khoáng 86%. Những đối tượng trong nghiên cứu nảy đã dùng Tamitìu trong 42 ngảy.
Trong cả ba thử nghiệm lâm sảng trên, khoảng 1% số đối tượng dùng Tamit1u dế phòng cùm đã bị cúm trong quá trinh dùng
thuôc.
Trong cảc thử nghiệm lâm sâng pha [H nảy, Tamif1u cũng iảm giảm đảng kế tỷ lệ phảt tản vi rút và ngăn chặn sự lan truyền vì
rủt trong gia dinh một cách thảnh công.
Phỏng bệnh cúm ở Irẻ em
Tính hiệu quả của Tamifìu trong việc n ăn ngùa bệnh cúm mắc phái tự nhiên dã dược chứng minh trong một nghiên cứu
phòng bệnh củm sau khi tiếp xúc với nguôn nhiễm. Nghiên cứu nảy được tỉến hảnh tại nhả va gom những bé từ 1 đển 12 tuối,
cả những trường hợp chi điếm lẫn những trường hợp tiếp xúc trong gia dình. Thông số chĩnh đề đảnh giá tính hỉệu quả của
thuốc trong nghiên cứu nảy là tỷ lệ măc bệnh cúm trên lâm sảng có kết quả xét nghiệm dương tính với vi rủt. Trong nghiên
cứu nảy, Tamiflu dạng huyền dịch uống với liều tù 30mg đến 75mg, mỗi ngảy một lần, trong 10 ngảy đã được dùng cho
những bé chưa bị phảt tản vi rủt lủc ban đầu, cho thấy đã iảm giám tỷ lệ mắc bệnh củm có biều hiện lâm sảng xác nhận bằng
xét nghiệm dương tính với vi rủt từ 21% (15/70) ờ nhóm trẻ không được điều trị dự phòng so với 4% (2147) ở nhóm trẻ được
diều trị dự phòng.
Phòng bệnh củm ở những bệnh nhản suy giảm miễn dịch
Một nghỉên cứu mù đôi 06 đối chứng giả dược được tiển hảnh để dự phòng bệnh cúm theo mùa ở 475 đối tượng suy giám
miễn dịch, trong đó có 18 trẻ cm từ 1 — 12 tuổi Người ta đánh giá bệnh củm có biếu hiện lâm sâng dược xác nhặn bằng xét
nghiệm theo định nghĩa là dương tính với phản ứng RT-PCR kèm theo thân nhiệt đo ở miệng >99, OOF/ 37, 2 0C kèm theo ho
vả/hoặc sổ mũi, tất cả được ghi lại trong vòng 24 giờ. Trong số các đối tượng chưa phát tán vi rủt lúc ban đẩu, Tamiflu lảm
giảm tỷ lệ mắc phái bệnh cúm có biếu hiện lâm sảng được xác nhặn bằng xét nghiệm từ 3% (7/231) trong nhóm không được
điều trị dự phòng xuống còn 0,4% (1/232) trong nhóm dược điều trị dự phòng.
Sư đề kháng cúa vi rút
Sư gìảm nhạy cảm cúa men neuraminidase của vi rút
Các nghiên cửu lãm sảng: N guy cơ xuất hiện các chũng vi rủt cúm vởi tính nhạy cảm giảm hay để khảng oseltamivir đã được
nghiên cứu kỳ trong các nghiên cứu lâm sảng do Roche tải trợ. Tất cả cảc bệnh nhân mang vi rút kháng oseitamivir chi cho
thấy đề kháng thoáng qua, họ vân thải trữ được vi rút như bình thường vả không có diễn tiên xắu về triệu chứng.
Bệnh nhân mang vi rủt có đột biến đề kháng (%)
Nhỏ… bệnh nhân _ _
Kiều hinh* Kiêu hình và kỉêu gen* _
Người lớn vả thanh thiêu niên 4/ 1245 (0,32%) 5/1245 (0,4%)
Trẻ cm (1—12 tuồi) 19l464 (4,1%) 25/464 (5,4%)
* Toản bộ các kiếu gen không đuợc thực hiện trong tẩt cả các nghiên cứu.
Các nghíên cứu lâm sâng duợc tìến hảnh cho đến nay trong việc phòng bệnh cúm sau tiếp xúc (7 ngảy), sau tiếp xúc trong gia
đỉnh (10 ngảy) và phòng bệnh cúm theo mùa (42 ngảy) không cho thây có bằng chứng nảo về sự kháng thuốc liên quan dển
việc sử dụng Tamiflu ở những bệnh nhân có khả năng miên dịch tốt. Không thấy có sự kháng thuốc nâo trong một nghíên cứu
dự phòng 12 tuần ở những đối tượng suy gỉảm miễn dịch
Các dữ liệu lâm sảng vờ Iheo dõi: Cảc chùng đột biến tự nhiên giam nhạy cảm với oseltamivir in vilro đã được phảt hiện ở vi
rủt củm A và củm B phân lập từ bệnh nhân chưa tùng uống oscltamivir. Vi dụ, năm 2008 đề khảng oseltamivir do sự thay thế
H275Y dã được tìm thẩy ờ > 99% cảc mẫu phân lặp cúm HINI lưu hảnh ở châu Âu năm 2008, trong khi củm HlNl năm
2009 (“cúm lợn”) gần như đểu nhạy cảm hoản toản với oseltamivir. Cảc chùng dề khảng cũng được phân lập từ cả những
bệnh nhân có miễn dịch tốt lẫn những bệnh nhân suy giảm miễn dịch được đỉều trị bằng oseltamivỉr. Sự nhạy cảm với
oseltamivir vả tỉ lệ mắc cảc vi rút đề khảng dường như thay đồi theo mùa cũng như theo địa lý. Cũng đã có bảo cảo về sự đề
khảng oseitamivir khi điều trị lẫn khi dự phòng ở nhũng bệnh nhân bị củm trong dịch củm HlNl.
Ty“ lệ xuất hìện đề khảng có thế cao hơn ờ nhũng nhóm tuối nhỏ nhất, vả trong nhóm cảc bệnh nhân suy giảm miễn dịch. Các
vi rủt đề kháng oscltamivìr phân lập được từ các bệnh nhãn điều trị bằng oseltamivir vả các chủng vi rủt cúm kháng
oseltamivir chọn lọc trong phòng thí nghiệm đểu cho thẳy có mang đột biến ớ cảc neuraminidase Ni vả N2. Các đột hiến
kháng thuõc có xu hướng đặc trưng theo phân nhỏm vi t'ủt.
Cảo bảo sỹ nên cân nhắc thộng tin hiện có về cảc_ đạng nhạy cảm với thuốc cúa vi rút cúm cho từng mùa trưởc khi quyết định
dùng Tamif1u hay không (đã có thỏng tin mới nhăt, xin xem trên wcbsite cùa WHO vảlh0ặc chinh quyên sở tại).
3.2 Cảc đặc tỉnh dược động hục
3 2 1 Hẳp …
Oseltamivir được hấp thu nhanh chóng ớ đường tiêu hóa sau khi uống oseltamivir phosphate và một phẩn [ớn thuốc được
chuyến hóa thảnh chât có hoạt tinh, chủ yếu nhờ men cstcrasc ở gan. Nồng dộ trong huyểt tương cưa chẳt chuyến hóa có hoạt
tính có thể đo được trong vòng 30 phút, đạt gần nồng độ đinh 2— 3 giờ sau khi dùng thuốc và cao hơn đảng kề (> 20 lần) nổng
độ cùa tiển dược Có ít nhất 75% lượng thưốc uống vâo dược tuần hoản dưới đạng chẳt chuyến hóa có hoạt tính. Nồng độ cùa
chẳt chuyến hóa có hoạt tinh trong huyết tương tỷ lệ với liều dùng vả không bị ảnh hưởng bới thức ản dùng cùng (Xem mục
2.2 Liều lượng vả Cách dùng)
s.z.z Phân hổ
Thế tich phân hố trung bình (Vss) cúa chẳt chuyến hóa có hoạt tinh lả khoảng 23 lít ở người
Gốc có hoạt tỉnh tới đuợc tắt cả cảc vị uí quan trọng bị nhiễm vi rút cúm qua nghiên cứu trên chồn chuột vả thò T rong
những nghiên cứu nảy, người ta đã thẳy nồng độ chẳt chuyển hóa có hoạt tinh khảng vi rút tặp trung ớ phổi, dịch rưa phế
quản- phế nang, chất nhầy ở mũi, tai giữa vả khí quản sau khi uỏng oscltamivir phosphatc
Mức độ gắn kết cùa chẳt chuyến hóa có hoạt tinh với protein huyết tương ờ nguời lá không đáng kể (xẳp nỉ 3%). Múc gắn kểt
cúa tiên dược với protein huyêt tương người là 42%. Với mửc nảy thì chưa đủ dê gây ra cảc tương tác thuôc có ý nghia.
3.2.3 Chuyến hóa
Một lượng lớn oseltamivìr phosphatcđược chuyển hóa thảnh chắt chuyến hóa có hoạt tinh nhờ mcn cstcra'se, men nảỵ khu trú
chú yêu ở gan. Cả oseltamivir lãn chât chuyên hóa có hoạt tinh đêu không phải là cơ chãt hoặc chât ức chẽ cúa cảc đỏng dạng
cytochromc P450 (Xem mục 2,4.2 Tướng tảC với cảc thuốc khảc vả các hinh thức tương tác thuỏc)
3. 2. 4 Thâi trủ'
Oscltamivir sau khi hắp thu được thải trừ phần lớn (> 90%) bắng cảch chuyến thảnh chắt chuyến hóa có hoạt tinh Chẳt nảy
không bị chuyến hóa tiếp mả bị thải tr ừ qua nước tiếu. Nổng độ đính của chẳt chuyến hóa có hoạt tinh uong huyết tương giam
dần với thời gỉan bản thải từ 6 đến 10 giờ trong da số trường hợp.
l"hưốc có hoạt linh được thải trừ toản bộ (> 99%) qua thận Độ thanh thải thận (18, 8 líthiờ) vượt quá mức lọc cẩu thặn (7,5
litlgiờ) cho thắy thuốc còn được thải trừ tiếp qua ông thặn. Dưới 20% liều uổng có đảnh dắu phóng xạ dược thải trù qua phân.
3.2.5 Dặc tinh dược động học ở những đổi tượng đặc biệt
Bệnh nhân suu thân
Sau khi dùng lỌOmg Tamìiiu, 2 lẳn l ngảy, trong thời gian 5 ngảy cho những bênh nhân bị suy thận ờ cảc mức độ khảo nhatư/
người ta thắy nông dộ chắt chuyển hớa có hoạt tính tỷ lệ nghịch với sự suy giảm chức năng thận.
Điều trị hệnh cúm
Không cần điều chinh liều cho những bệnh nhân có độ thanh thải creatininc trên 60 m l/phủt Ở những bệnh nhân có dộ thanh
thải creatininc từ 30-60 m1/phút, cân giảm liễu Iamilìu xuống 30 mg uống ngảy hai lằn, ttong 5 ngảy. .Ớ những bệnh nhãn có
độ thanh thải creatinine từ 10- 30 mllphủt cần giảm liều Tarnilìu xướng 30 mg uống ngảy một lân, trong 5 ngảy. Ớ nhũng
bệnh nhăn đang thấm phẩm mảu định kỳ, có thể dùng lỉếu khời đầu 30 mg Tamiflu trưởc khi bắt đẩu thắm phân mảu nếu triệu
chứng cúm xuât hiện trong khoảng thời gian 48 giờ giữa hai lần thắm phân máu Dế nổng độ thuốc trong huyết tương được
duy tri trong khoảng trị liệu, nên dùng một liễu 30 mg Tamiilư sau môi chu trinh thầm phân mảu Đối với thẳm phân phúc
mạc, một ]iếu 30 mg Tamii1u trước khi bắt dầu thẳm phân mảu và bổ sung các liếu 30 mg mỗi 5 ngây (Xem muc 3 2.5 Đặc
tĩnh Dược động học ở những đối tượng đặc biệt và mục 2 4 Những Cảnh háo vả Thận trọng). Dược động học cua oseltamivir
còn chưa được nghiên cúư ở những bệnh nhân bệnh thận giai đoạn cưối” (tức lả. dộ thanh thải creatinin < lOml/ phủt) không
dang thầm phãn máu. Do dó, không có liếu khuyên dùng cho nhóm bệnh nhân nảy
Phỏng ngừa bệnh củm
Không cần điều chinh liếu cho những bệnh nhân có độ thanh thải creatinine trên 60 m1/phút. Ở những bệnh nhân có độ thanh
thải creatininc từ 30-60 mi’phút, cẩn giám liều Tamiílư xuống còn 30 mg ưống ngảy một lẳn, trOng 5 ngảy Ở những bệnh
nhân có độ thanh thải creatiníne từ 10—30 m1/phút,cằn giảm líều Tamiflu xuông còn 30 mg, cảch một ngảy uống một lằn Ở
những bệnh nhân đang thấm phân mảu định kỳ, có thể dùng liều khởi đẳu 30 mg Tamifìu trước khi bắt đẳu thầm phân mảu
Đế nông độ thưốc trong huyết tương được duy trì trong khoảng trị liệu, nên dùng một [ìểu 30 mg Tamiflu sau mỗi lần thấm
phân máu xen kẽ. Đối với thầm phân phủc mạc, nên dùng một liều 30 mg Tamifiu trước khi bắt đấu thắm phân mảu vả bổ
sung các lỉềư 30 mg mỗi 7 ngảy (Xem mục 3. 2. 5 Đặc tinh Dược dộng học ở những đối tượng đặc biệt vả mục 2 4 Những
Cảnh bảo và Thận trọng) Dược động học cún oseltamivir còn chưa được nghiến cứu 0 những bệnh nhân “bẹnh thận giai đoạn
Ẩn
cuou (tức iả, dộ thanh thái creatinin < IOmI/ phút) không đang thẩm phân máu. Do đó, không có liều khuyên dùng cho nhóm
bệnh nhân nảy.
Bệnh nhản suy gan
Dụa trên những nghiên cứu trong phòng thí nghiệm và trên dộng vật, ớ những bệnh nhân suy gan nhẹ hoặc trung bình, gia
tăng dảng kề nông độ oseltamivir và chất chuyến hóa có hoạt tính không được ghi nhận và diều nảy dã được xảo đinh lại
trong cảc nghiên cứu lâm sâng (Xem mục 2 2.1 Những hướng dẫn lìều dùng đặc biệt). Độ an toản và đặc tinh dược động học
ở bệnh nhân suy gan nặng chưa được nghiên cứu.
Người gỉả
Ở người lớn tuối (từ 65 đến 78 tuối), nồng độ của chắt chuyền hóa có hoạt tính ở trạng thái ốn định cao hơn khoảng 25- 35%
so với người trẻ khi dùng cùng một lìều Tamif1u. Thời gìan bản thải của thuốc ở người giá tương tự như ở người trẻ. Căn cứ
vảo nồng độ cúa thuốc vả khả năng dung nạp, không cân điều chính liều cho người giả khi dược điều trị hoặc phòng ngừa
bệnh củm (Xem mục 2 2.1 Những hướng dẫn liều dùng đặc biệt)
Trẻ em từ 1 tuổi
Dược động học cùa Tamiiìu đã dược đánh giá trong một nghiên cứu dược động học liều đơn ở trẻ em từ 1 đến 16 tuổi. Dược
động học đa líều cũng đã dược nghiên cứu ớ một số it trẻ từ 3 đến 12 tuổi trong một thư nghiệm lâm sảng Trẻ nhỏ tuối có
mức độ thái trừ các chất chưyên hóa có hoạt tinh nhanh hơn so với người lớn, lảm cho nồng độ thuốc trở nên thấp hơn nếu xét
theo liều được cho tinh bằng mg/kg. Liều 2mg/kg vả cảc iíều 30mg vả 4Smg khi dùng cho trẻ em theo khuyến cáo ở mục 2 2
cho nồng độ tảc dụng cùa oseltamivir catboxylate tương tự với nông độ đạt được ở người lớn dùng liều đơn viên nang 75mg
(xấp xỉ ]mg/kg) Dược động học cúa oseitamivir ở trẻ em trên 12 tuồi tương tự như ở người lớn.
Trẻ em n`r 6-12 tháng
Hiện có ít dữ liệu về nổng độ thuốc trong co thể trong phân nhóm bệnh nhân từ 6—12 tháng tuổi tham gia trong câc nghiên cửu
về dược lực học, được động học và tinh an toản ở trẻ nhiễm củm dưới 2 tuốỉ. Cảc dữ líệu híện có gợi ý rằng nồng độ thuốc
sau khi uống liều 3 mg/kg ớ đa số trẻ 6-12 thảng tuối tường tự như nổng độ đạt dược ờ trẻ lớn hơn và người lớn đang uống
liều dược phê chuẩn. Cảo tác dụng không mong muốn được báo cảo phù hợp với những thông tin về an toản đã thiết iập ở trẻ
lớn hơn.
3.3 Tính an toân tiền lâm sảng
Những dữ liệu tíền [âm sảng không cho` thấy mối ngưy hiếm đặc biệt nảo cúa thuốc cho người dựa trên cảc nghiên cứu thông
thường vê duợc học an toản, dộc tính liêu lặp lại và độc tính trên gen.
3.3.1 Tính sinh ung thư
Ba nghiên cứu về khả nảng gây ung thư '(cảc nghiện cửu hai nảm ở chuột nhắt vả chuột iớn với oseltamivir, và thử nghiệm sảu
tháng về trao đôi gen Tg:AC ở chuột nhãt được tiên hảnh với chât chuyến hóa oỏ hoạt tính) cho kết quả âm tính.
3 3 2 [`ính gay đọt blen S
Oseltamivir vả chẳt chuyến hóa có hoạt tinh cho kết quả âm tính trong lô thử nghiệm chuẩn gây độc trên gen.
3.3.3 Suy giâm khả năng sinh sán
Nghiên cứu về khả năng sinh sản ở chuột với liều lên tới lSOOmg/kg/ngảy đã chứng minh không có tác động có hại nâo lên cả
hai giới.
3. 3. 4 Tính gây quải thai
Cảo nghiên cứu về quái thai đă được tỉển hảnh với iiều lên tởi lSOOmg/kg/ngảy ớ chuột vả SOOmg/kg/ngảy ớ thỏ. Không ghi
nhận được tâc động nảo cùa thuốc lên sự phát triến cúa phôi thai. T rong các nghiên cứu chu sinh ở chuột, quá trình chuyền dạ
kéo dải dược ghi nhận ờ liều lSOOmg/kg/ngảy: giới hạn an toản giữa liều điều trị ở người vả iỉểu cao nhất không gây hại
(SOỌmglkg/ngảy) ở chuột lả gâp 480 lần đối với oscitamivir vả gâp 44 lần đối với chẩt chuyến hóa có hoạt tinh. Nống độ
thuốc ớ phôi chuột vả phôi thò xâp xỉ 15 đến 20% nồng độ ở mẹ
3. 3. 5 Đặc tính khảc
Ó chuột cho con bú, oseltamivir vả chất chuyển hoá có hoạt tinh được bải tiết vảo trong sữa. Ở người, vẫn chưa biết liệu
oseltamivir vả chất chuyền hoá có hoạt tính có được bải tiết vảo tlong sữa mẹ hay khôn Thế nhưng từ phép ngoại suy cúa
cảc dữ liệu ờ động vật, có thể dự đoản có khoảng 0, 01 mg oseltamivir vả 0 ,3mg chất chuyen hoá có hoạt tính được bải tiết vảo
trong sữa mẹ mỗi ngảy
Khả năng da nhạy cám với oseltamỉvir được ghi nhận trong một xét nghiệm “tối đa hóa” ở chuột lang Sau khi ảy kích ứng
với dị nguyên những con vật thí nghiệm nảy, người ta thây cỏ khoáng 50% con vật được điều trị với hoạt ch 1 chính đơn
thuần có xuất hìện ban đó Sự gây kich ứng có hồi phục ở mắt thò củng đă được phảt hiện.
Trong khi liếu rất cao oscltamìvir phosphat đùng đường uổng đã không gây ra một biến cố bắt lợi nảo ở chuột trướng thảnh,
thi liều nảy lại gây dộc tinh 0 chuột con 7 ngảy tuôỉ, kế ca từ vong Những biến cố bất lợi nảy đã được ghi nhận với liều 657
mglkg vả cao hơn Ở liều 500 mg/kg, không có biến cố bất lợi nảo được ghi nhận, kể cả khi điều trị lâu dải (chuột 7 dển 21
ngảy tuối dùng liều soo mg/kg/ngảy).
4. CÁC ĐẶC TỈNH DƯỢC HỌC
4.1 Bảo quán
Viên nang: Bao quán thuốc ở nhiệt độ dưới 30°C.
Bột pha huyền dịch uổng: không bảo quán thuốc ở nhiệt độ trên 300C.
Huyền dịch đã được pha: bao quán thuốc ở nhìệt dộ phòng (không quá 25°C) trong 10 ngảy hay trong ngăn mảt tủ lạnh (2°C
— 80C) trong 17 ngảy.
4.2 Hướng dẫn dặc biệt cho việc sử dụng. hủy bỏ thuốc
Huỳ bỏ thuốc không sử dụng/hết hạn
Cần hạn chế việc thải bỏ dược phầm ra môi trường. Không thải bớ dược phẩm qua hệ thổng nước thải và trảnh vút
bú vâo rảc thải sinh hoạt. Hãy sử dụng “hệ thống thu gom” ở địa phương, nếu cỏ.
Độ ổn định
Không nên sử dụng thuốc sau ngảy hết hạn được ghi ớ vo hộp.
Cách sử dụng và hủy bỏ
Chnân bi bôi Tamiílu cho dang huvền dich uổng ló mE/ml.)
Bột Tamiflu cho dạng huyền dịch uống nên được pha bới dược sĩ trưởc khi đưa cho bệnh nhân (Xem mục 2.2 Liều lượng và
Cảch đùng):
!. Vỗ vảo lọ thuốc đóng kín vải lấn đế thuốc tơi ra.
2 Đong 55 ml nước. Sử dụng cốc lường nước (được cung cấp sẳn) vả đong nước đển mức đã chỉ định.
3. Đồ 55 ml nước vảo lọ thuốc để pha thuốc vả lẳc kỹ lọ thuốc đã được đóng kín trong 15 giây. ỵ
4 Mở nắp lọ thuốc (loại bảo vệ không cho trẻ mớ) và ấn bộ phận tiếp hợp vảo cố lọ thuốc.
5
Đóng nắp báo vệ lọ thuốc iại thật chặt. Điều nảy giúp cổ dịnh đủng chỗ bộ phận tiếp hợp (1 lọ thuốc vả khả năng bao
vệ cua năp iọ thưốc.
Tờ hướng dẫn sữ dụng và ống iấy thuốc sẽ được đưa cho bệnh nhân. Nên viết ngảy hết hạn của huyền dịch đã pha trên nhãn
thuôc.
le khẩn cẩp hỗn 1/ich uống từ viên nang Tamitlu (Nồng đó cuối cùng 6 mc / mL).
Dạng hỗn dịch cùa Tamit1u (6 mg/mL) được ưa chuông cho cảc bệnh nhân trẻ em và người lớn gặg khó khăn trong việc nuốt
các viên nang hoặc cần dùng iiều thẳp hơn. Trong trường hợp Tamifìu dạng hỗn dịch không có săn, dược sĩ có thẻ pha hỗn
dịch (6 mg/mL) từ viên nang Tamitiu.
Pha chế hỗn dich Iai nhả Ihuốc /6 me/mL)
Quy trình sau đây mô tả việc pha chế một dung dich 6 mg/ml tại nhà thuốc sẽ cung cắp đu liều thuốc cho 1 bệnh nhân dùng
trong đợt điều trị 5 ngảy.
Dược sỹ có thể pha chế một huyền địch (6 mg/ml) từ viên nang Tamiflu 30 mg, 45 mg hoặc 75 mg vả nước có chứa 0,05%
sodium bcnzoatc được thêm vảo đề bảo quản.
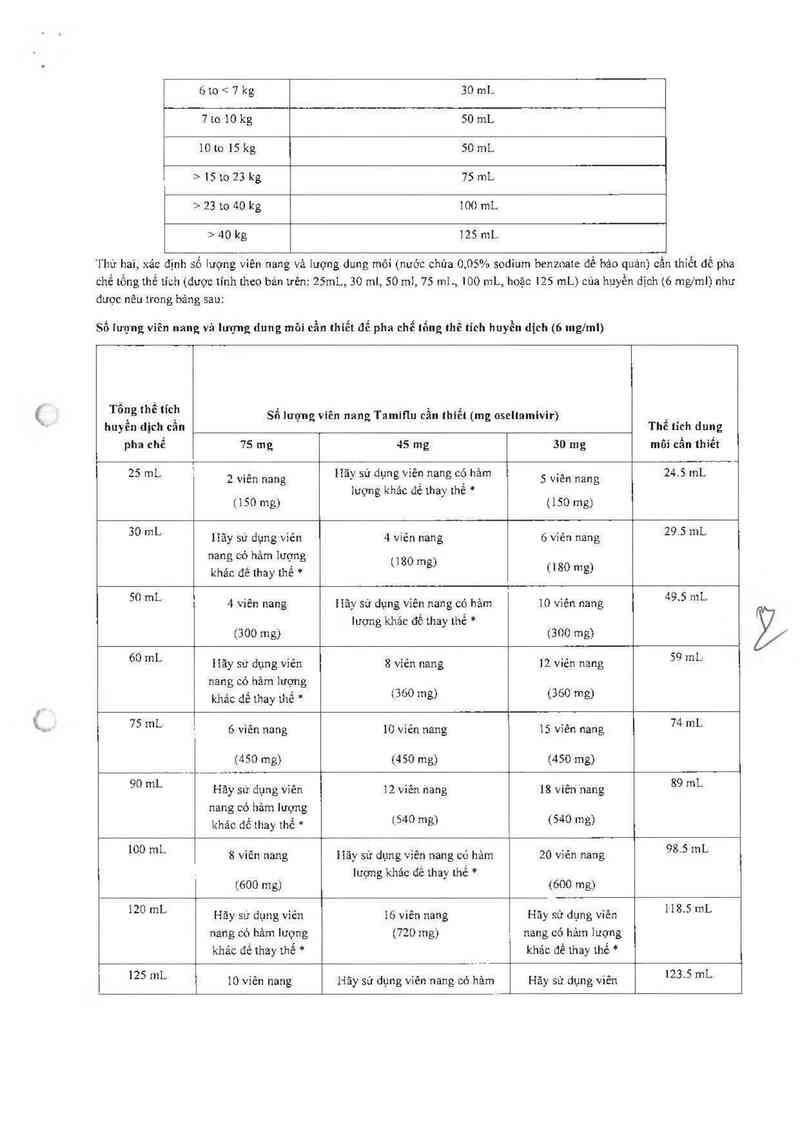
Trước tiên, tinh tống thế tich cần pha chế vã đưa cho từng bệnh nhân. Tống thề tich cần thiết được xảo định bằng cân nặng
cúa bệnh nhân dưa theo khuyến cáo trong báng dưới đây:
Thể tích huyền dịch (6 mg/ml) cần pha chế tại hiệu thuốc cho một đợt điểu trị 5 ngảy dựa trên cân nặng của bệnh nhân:
Cân nặng (kg) Tống thể tich huyền dịch (ml)
<6kg 25 mL
610<7kg 30 mL
7to 10 kg 50 mL
10to 15 kg 50 mL
> lSto 23 kg 75 mi.
>23 to 40 kg 100 mL
>40 kg 125 mL
'I`hứ hai, xảc định số lượng viên nang và lượng đung môi (nước chứa 0,05% sodium benzoate để bảo quản) cẩn thiết để pha
chế tống thể tích (được tính theo bản trên: 2SmL, 30 ml, 50 ml, 75 mI., 100 mL, hoặc 125 mL) của hưyền địch (6 mgiml) như
được nêu trong băng sau:
Số lượng viên nang vả lượng đung môi cần thiết để pha chế tổng thể tích huyền địch (6 mglml)
Tông thể tích Số lượng viên nang Tamifiư cần thiết (mg oseltamỉvir) _
hưyền dịch cân Thê tích đưng
pha chế 75 mg 45 mg 30 mg môi cần thiết
zs mt. T 2 viên nang Hãy sử đụng viên nang cớ hảm 5 viên nang 24.5 mL
lượng khác đe thay the *
(150 mg) (150 mg)
30 mL liãy sư dụng viên 4 viên nang 6 viên nang 29’5 mL
nang cò hâm lượng (180 m
. , ẽ)
khác đê thay thế * f'80 mg)
50 mL 4 viên nang Hãy sử dụng vìên nang có hảm 10 vìên nang 49’5 mL
lượng khác để thay thế *
(300 mg) (300 mg)
60 mL Hãy sư đụng viên 8 viên nang 12 viên nang 59 mi…
nang cỏ hảm lượng
khảc dế thay thế * (360 mg) (360 mg)
75 mL 6 viên nang 10 viên nang 15 viên nang 74 mL
(450 mg) (450 mg) (450 mg)
90 m Hãy sử dụng viên 12 viên nang 18 viên nang 89 mL
nang có hảm lượng
khảo để thay thế * (540 mg) (540 mg)
100 mL 8 viên nang Hãy sử dụng viên nang có hảm 20 viên nang 98’5 mL
lượng khác để thay thế *
(600 mg) (600 mg)
120 mL Hãy sử dụng viên 16 viên nang Hãy sử dụng viên 1185 mL
nang cò hâm lượng (720 mg) nang có hảm lượng
khác để thay thế * khác ơê thay thế *
125 mL 10 viên nang Hãy sử dụng viên nang cỏ hảm Hãy sử dụng viên 1235 mL
f'“~
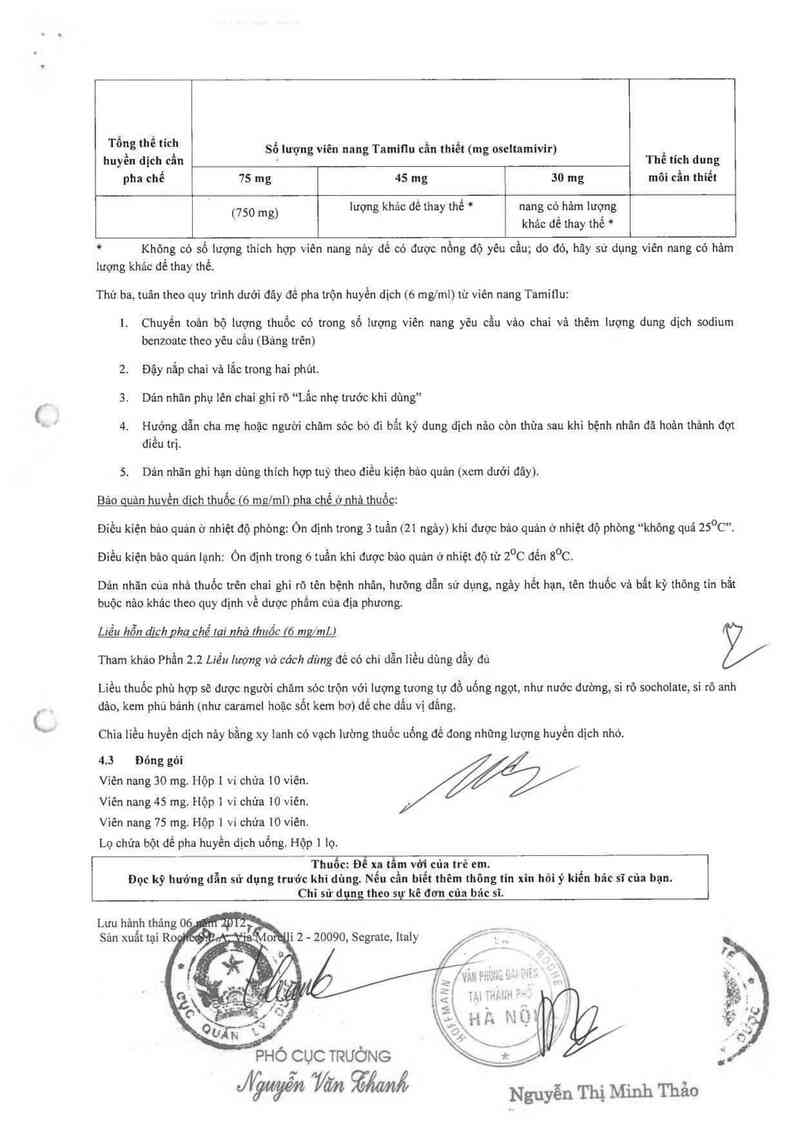
Tong thê tich Số lượng viên nang Tamitlu cần thiết (mg oseltamivir)
huyền dịch cẩn Thể tích dung
pha chế 75 mg 45 mg 30 mg mõỉ cần thiết
(750 mg) lượng khảc dế thay thế * nang có. hảm lượng
khảc đê thay thê *
* Không có sổ 1ượng thích hợp viên nang nảy đế có được nồng độ yêu cầu; do đó, hãy sử dụng viên nang có hảm
iượng khảo để thay thế.
Thứ ba, tuân theo quy trinh dưới đây để pha trộn huyền dịch (6 mg/ml) từ viên nang Tamiflu:
1. Chuyền toản bộ lượng thuốc có trong số lượng viên nang yêu cầu vảo chai vả thêm lượng dung dịch sodium
bcnzoatc theo yêu cầu (Bảng trên)
2. Đậy nắp chai vả lắc trong hai phút.
3. Dản nhãn phụ iên chai ghi rõ “Lắc nhẹ trước khi dùng"
4. Hướng dẫn cha mẹ hoặc người chăm sóc bỏ đi bẩt kỳ dung dịch nâo còn thùa sau khi bệnh nhân dã hoản thảnh đọt
điểu trị.
5. Dản nhãn ghì hạn dùng thich hợp tuỳ theo điều kiện bâo quản (xem dưới đây).
Bảo quản huvến đich thuốc (6 mg/mlì oha chế ở nhà thuốc:
Điều kiện bảo quản ở nhìệt độ phòng: Ôn định trong 3 tuần (21 ngảy) khi được bảo quản ờ nhiệt độ phòng ““không quá 25°C”.
Điều kiện bảo quản lạnh: Ỏn định trong 6 tuần khi được bảo quản ở nhìệt độ từ 2°c đển s°c.
Dán nhãn cùa nhả thuốc trên chai ghi rõ tên bệnh nhân, hưởng dẫn sử dụng, ngảy hết hạn, tên thuốc vả bất kỳ thông tỉn bắt
buộc nâo khác theo quy định về dược phẩm cùa địa phương.
Liều hỗn dich pha chế Iai nhờ lhuốc (6 mQ/mL)
Tham khảo Phần 22 Liều lượng vả cách dùng ơê có chỉ dẫn iiểu dùng đằy đủ
Liều thuốc phù hợp sẽ được người chảm sóc trộn với lượng tương tư đồ uống ngọt, như nước đường, si rô sochoiate, si rô anh
đảo, kem phù bảnh (như caramcl hoặc sốt kem bơ) để che dắu vị đắng.
Chia iiểu huyền dịch nảy bằng xy 1anh có vạch iường thuốc uống để đong những lượng huyền dịch nhò.
4.3 Đỏng gỏi
Viên nang 30 mg. Hộp 1 ví chứa 10 viên.
Viên nang 45 mg. Hộp 1 ví chứa 10 viên.
Viên nang 75 mg. Hộp ] vi chứa 10 viên.
Lọ chứa bột để pha huyền dịch uống. Hộp ] lọ.
Thuốc: Để xn tầnl vởị của trẻ em. '
Đọc kỹ huớng dẫn sử dụng truớc khi dùng. Nêu cân biêt thêm thông tin xỉn hỏi ý kiên bảc sĩ cũa bạn.
Chi sữ dụng theo sự kê đơn của bác sĩ.
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng