











PREPRESS — INFORMATION
PREPRESS - ROCHE BASEL
—Đ
Control Proof New Proof Corrections
Format 68 x 22 x 120 mm
RGngtGI' NT. 10.040 Date: ............................ Date: ............................ Date: ........................
NP 2020
26_03_2010 12:52:15 Visa: ............................ Visa: ............................ Visa: ........................
Grundschrlft 7.5 Punkt
OK for Printing Control File OK for Printing
Date: ............................ Date: ............................ Datez ........................
Visa: ............................ Visa: ............................ Visa: ........................
10117783 FE 10117763 FE 10117783 FE 10117783 FE
FILM1VON 4 FILM 2 VON 4 FILM 3 VON 4 FILM 4 VON 4
Pantone Black PMS 300 PMS 327 PMS 361
26.03.10 26.03.10 26.03.10 26.03.10
+ f“TT —
, /'”`\ ,
, / ` 0;
_ r.l/"/Vị xu…’W yjf,,D H C—
( ` T›À,ị 1Pưuiii f'hẫv
Oseltamivir
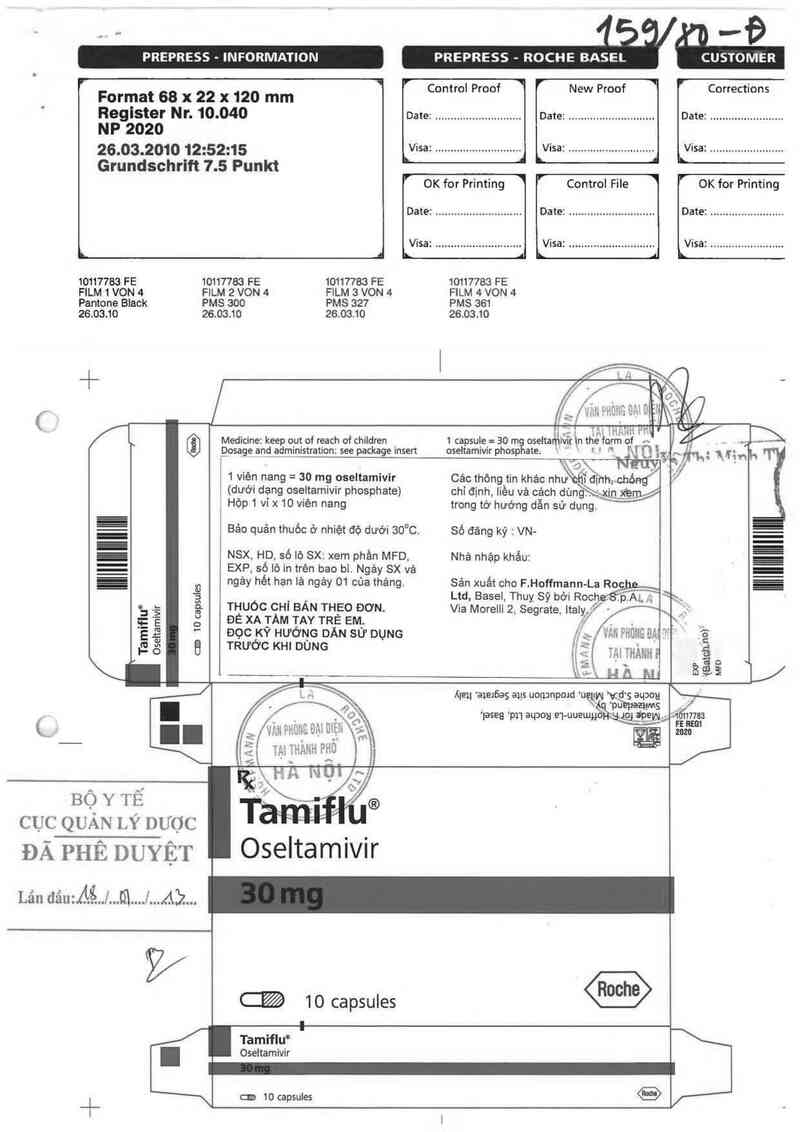
Medicine: keep out of reach of children
_Dosage anEìministration: see package insert
1 capsule= 30 mg oseltarịtiviịẵ tn thẻ form of A
oseitamivir phosphate. \ V ' 1 RH'H
1 viên nang = 30 mg oseltamivir
(dưới dạng oseltamivir phosphate)
Hộp 1 ví x 10 viên nang
NSX HD số lô SX~ xem phần MFD
EXP số lô … trẻn bao bì. Ngảy SX vả
ngảy hết hạn lả ngảy 01 của tháng.
THUỐC CHỈ BÁN THEO ĐỜN.
ĐỂ XA TÀM TAY TRẺ EM.
ĐỌC KỸ HƯỞNG DĂN sứ DỤNG
CĐ 10 capsules
Bảo quản thuốc ở nhiệt độ dưới 30°C.
Các tịhỏngètin khác như 2 ' | đmh`chong/
ẵỀ'…Ề'Êẵ À'ưẳắẵ ẵẵẵễẵ“ẵẵag W
Số đảng ký : VN-
Nhã nhập khẩu:
Sản xuất cho F. Hoffmann La Roc
Ltd Basel Thuỵ Sỹ bởi Roche'SẢ/LẸ—ầ p Al.’ «'
S
m
ỉ
O
_
2
_…
m
…
(Q
4
m
..…
m
=
9.
ẹ_ỉ<
ẫì
Ệz
:?
“Ế
2]
>
i/ /l
“Ả
\\ ;
j ,
.Ỉ!
3 ,~
11
MFD
1…rAN
TRƯỚC KHI DÙNG lí' Ê 'Yếl ĨHÀNHH
ịị tả ,
L._ k 4A
/_Ị\Ộ\ Ắ|eu azmôas eụs uognnpmd ueuw tiỵ~~sủi aư>oỀ
135²8 “011 3L1308 ²1-UUPUJ0ủÉWJ-M
*m, , Hí=,iêũ DiE…i _\
BỘY1Ề
CỤCQUẨNLÝDUỢC
ĐÃ PHÊ DUYỆT
Lán đâu:ÁỄ.J…ÚLJ…AẮỀ…
Oseltamivir
%
C1Ở
10 capsules
>ĩẩmes
FE um
zozo
I
I
Tamiflu°
Oseltamivir
CD 10 capsuies
PREPRESS — INFORMATION PREPRESS - ROCHE BASEL CUSTOMER
120 mm l3_l'Blt, 1 Nutzen Control Proof New Proof Corrections
Blistergrosse 108 x 63 mm Date: ............................ Date: ............................ Date: ............................
Streudruck
30_06_2009 13:04:49 Visa: ............................ Visa: ............................ Visa: ............................
Tamiqu 30 mg
PATEXT halbmanuell OKfor Printing Control File OK for Printing
Grundschrift 9.5 Punkt
Date: ............................ Date: ............................ Date: ............................
Visa: ............................ Visa: ............................ Visa: ............................
1o110417 UN 10110… UN Art.Nr’ 2015-00de Oseltamivir EL
ao mg T 'fl ® ao mg T 'fl ® 30 mg ủi
~— ami U ami U -
Oseltamivir Oseltamivir <Ếỳ
. 30 m . 30 m .
Tamanu® g Tamquu® g Tamtflu®
Oseltamivir Oseltamivir Oseltamivir
30 mg T 'fl ® 30 mg T 'fl ® 30 mg
— ami U ami U — o
{m_ưụ> Oseltamivir <ỄỀ> Oseltamivir Ề
. 30 m . 30 m . "
Tamtflu® g Tamiflu® g Tamiflu® Ê
Oseltamivir Oseltamivir @) Oseltamivir —Ẹẳ
30 mg fl ® 30 mg T fl @ 30 mg ỉ…
—\ Tami u — ami u ><
<Ủ'Ỹ Oseltamivir Oseltamivir <Ề> Oseltamivir @
. 30 m . 30 m .
Tam1flu® g Tamanu® ,ỉ Tam1flu®
Oseltamivir Oseltamivir Oseltamivir Oseltamivir '\ỄI> ễ
. 30 m . 30 m .
Tam1flu® g Tamthu® zi Tamthu®
Oseltamivir (m) Oseltamivir RRWHG) Oseltamivir
Ể.
Rx
Tamiflu®
Oseltamivir
1. MÔ TẢ
1.1 Nhóm dược lý | điều trị
Tamifiu lả một thuốc kháng vi rút
1.2 Dạng dược phẫu:
Viên nang cứng
Viên nang 30 mg gổm thân nang mờ đục_mảu vảng nhạt có in chữ “ROCHE“ vả nắp mờ đục mảu vảng nhạt có in "30mg”.
Chữ in mảu xanh.
Viên nang 45 mg gồm thân nang mờ đục mảu ghi có in chữ "ROCHE“ vả nắp mờ đục mảu ghi có in "45mg”. Chữ in mảu
xanh.
Viến nang 75 mg gốm thân nang mờ đục mảu ghi có in chữ "ROCHE“ vả nắp mờ đục mảu vảng nhạt có in "7Smg”. Chữ in
mảu xanh.
Bột pha huyến dịch uống.
Bột dạng cốm rời hoặc kết khối có mảu ưẳng đến vảng nhạt.
1.3 Đường dùng
Đường uõng.
1.4 Tính vô trùng | Bức xạ
Không áp dụng.
1.5 Tbĩmh phần định tính và dinh lượng
Hoạt chẩt: oseltamivir phosphate.
Mỗi viên nang 30mg chửa 39,4mg oseltamivir phosphate, tương đương với 30mg oseltamivir. Z
Mỗi viên nang 4Smg chứa 59,1mg oseitamivir phosphate, tương đương với 4Smg oseltamivir.
Mỗi vién nang 7Smg chứa 98,5mg oseitamivir phosphate, tương đương với 7Smg oseltamivir.
Bột pha huyền dịch uống, khi được pha với nước tới nống độ 1,2% có chứa ing/m] oseltamỉvir.
Bột pha huyền dịch uống, khi được pha với nước tới nổng độ 0.6% có chứa 6mglmi oseltamivir.
Danh sách tả dược
Sorbitol vả sodium benzoate
Tá dược trong viên nang: Pre-geiatinized starch, Povidone K 30, Croscarmellose sodium, Tale, Sodium stearyl fumarate.
Tá dược trong bột pha hưyền dịch: Sorbitol, Titanium dioxide, Sodium benzoate, Xanthan gum, Monosodium cìtrate,
Saccharin sodium, PERMASEAL 11900-31 Tutti Frutti.
2. CÁC ĐẶC TÍNH LÂM SÀNG
2.1 Chỉ định điều trị
Tamiflu được chỉ định để điều trị bệnh cúm ở người iớn vả trẻ em từ sảu thảng mốitrở lến. (Xem mục 2.2.1 Những hướng
- * liều dùng đặc biệt, 2.4 Những Cảnh bảo vả Thận trọng vả mục 3.3 Tính an toản tiên lâm sảng)
Tamiqu được chỉ định đề phòng ngừa bệnh cúm ở người lớn và trẻ em từ một tuồi trở lên.
2.2. Liều lượng và Cách dùng
Tamifiu có thế được dùng kẻrn hoặc không kèm theo thức ăn. (Xem mục 3.2 Các đặc tính dược động học). Tuy nhiên, dùng
Tamiqu kèm với thức ăn có thế lảm tăng khả năng dưng nạp thuôc ở một sô bệnh nhân.
Trong trường hợp huyền dịch uổng Tamiqu không sẵn có, người lớn, thanh thiểu niên vả trẻ em không thể nuốt viên thuốc
vẫn có thể uống đủng liều iượng (xem phẳn Hướng dẫn pha trộn ở cuối tờ hướng dẫn sử dụng náy). Pha chế tại hiệu thuốc lá
iựa chọn tốt nhắt.
Điếu trị bệnh củm
Nên bắt dẩn điếu trị vảo ngảy thứ nhẳt hoặc ngảy thứ hai khi xuất hiện cảc triệu chứng đằu tiên của bệnh củm.
Người Iởn vả thanh thiểu niên:
Ở người lớn vả thanh thiếu niên từ 13 tuổi trở lên, liếu khuyến dùng lá uống viến nang Tamifiu 7Smg hai lần mỗi ngảy, trong
5 ngảy. Trong trường hợp không thể nuốt được viên nang, có thể dùng dạng huyền dịch với liếu 75mg Tamiflu hai lần mỗi
ngảy, trong 5 ngảy.
Trẻ em~
Trẻ có cân nặng trên 40 kg nếu có thế nuốt được viên nang, cũng có thể được điếu trị vởi Iiếu uổng viên nang 7Smg hai lần
mỗi ngảy hoặc một viên nang 30mg cộng với một viên nang 45mg hai lần mỗi ngảy, thay vì dùng Tamifiu dạng huyền dịch
với liếu khuyến dùng như bảng dưới đây.
Liều uống đươc khuvẻn dùng của Tamiqu cho trẻ từ mỏt tuồi trở lên:
T rọng lượng cơ ihế Liều khuyên dùng trong 5 ngảy Lượng huyền dịch uống ( 6mg/mL)
s 15 kg 30 mg hai lẳn mỗi ngảy 5.0 m1 hai lần mỗi ngảy
> 15 kg đến 23 kg 45 mg hai lần mỗi ngảy 7.5 m1 hai lằn mỗi ngảy
› 23 kg đến 40 kg 60 mg hai lần mỗi ngảy 100 ml hai lần mỗi ngảy
> 40kg 75 mg hai lần mỗi ngảy 12.5 ml hai lằn mỗi ngảy
Liều dùng đường uống của Tamiqu đươc khưvến cáo cho trẻ 6-12 tháng mồi:
Dựa trên dữ liệu dược động học còn hạn chế hiện có, với liếu dùng 3 mg/kg hai iần mỗi ngảy ở trẻ 6 — 12 thảng tuổi ưong 5
ngâY— , , ,
Tamiflu dạng bột pha huyên dịch uõng nến được pha chế bới dược sĩ trước khi dùng cho bệnh nhân (Xem mục 4.2 Hướng dẫn
đặc biệt cho việc sử dụng, hùy bò thuôc).
Phòng ngừa bệnh củm
Người lớn vã lhanh thiếu niẻn~
Liều uống Tamifiu khuyên dùng để phòng ngừa bệnh củm sau khi tiếp xúc với người bị nhiễm cúm 1ả 7Smg ngảy một iằn, 7
ưong 10 ngảy Nên bắt đằu việc sử dụng trong vòng hai ngảy sau khi tiếp xúc với nguôn bệnh. Liều khuyến dùng để phòng ~
bệnh cúm trong suốt thời gian có dịch ở cộng đồng là dùng 7Smg ngảy một lần Tinh an toản và hiệu quả cùa việc dùng thuốc 1
đã được chứng minh cho tới 6 mần. Chừng nảo vẫn còn dùng thuốc thì thời gian bảo vệ cùa thuốc vẫn còn.
Trẻ em Iừ ] tuổi~
Trẻ có cân nặng trên 40 kg nếu có thể nuốt được viên nang, cũng có thể được điều trị phòng bệnh cúm với viẻn nang 75mg '-_
một lần mỗi ngảy hoặc một viên 30 mg cộng với một viên 45 mg một lần mỗi ngảy, trong 10 ngảy, thay vì dùng Tamifiu dạng
huyến dịch với liểu khuyên dùng như bảng dưới đây
Liều uống đươc khưve'n dùng của Tami/Tu để phòng ngừa bẽnh cúm cho zré lừ mó! tuồi trờ lẻn:
Trọng lượng cơ thể Liều khuyên dùng trong ]0 ngảy Lượng huyền dịch uống (6 mg/mL)
5 15 kg 30 mg ngảy một lần 50 ml ngảy một 1ần
› 15 kg đến 23 kg 45 mg ngảy một lần 7.5 ml ngảy một iần
› 23 kg đến 40 kg 60mg ngảy một lần 10.0 m1 ngảy một lần
> 40kg 7Smg ngảy một lẩn 12.5 ml ngảy một lần
Tamiqu dạng bột pha huyến dịch uống nên được pha chế bới dược sĩ trước khi dùng cho bệnh nhân (Xem mục 4. 2 Hướng dẫn
đặc biệt cho việc sử dụng, hủy bỏ thuốc).
2.2.1 Những hướng dẫn liều dùng đãc biệt'
Bệnh nhân suy thận %
Điêu trị bệnh cúm
Không cằn điếu chinh liếu cho những bệnh nhân có độ thanh thải creatinine trên 60 ml/phủt. Ở những bệnh nhân có độ thanh
thải creatinine từ 30-60 m1lphút, cân giảm liếu Tamiflu xuống 30mg uống hai lẩn một ngảy, ưong 5 ng.ảy Ở những bệnh nhân
có độ thanh thải creatinine từ 10- 30 mllphủt, cần giảm liếu Tamiflu xuông 30mg uống ngảy một lần, trong 5 ngảy. Ở những
bệnh nhân đang thẩm phân máu định kỳ, nêu ưỉệu chứng củm xuất hiện trong khoảng thời gian 48 giờ giữa hai lân thẩm phân
máu có thể dùng liếu khởi đấu 30 mg Tamiqu trước khi bắt đẳu thẩm phân máu. Đế nồng độ thuốc trong huyết tương được
đuy tri trong khoảng trị liệu, nên dùng một lỉều 30 mg Tamiflu sau mỗi lần thẩm phân máu. Đối với thấm phân phủc mạc, nến
dùng một liễu 30 mg Tamifiu trưởc khi bắt đầu thẳm phân mảu và sau đó bổ sung cảc Iiếu 30 mg mỗi 5 ngảy (Xem mục 3.2.5
Đặc tính Dược động học ở những đối tượng đặc biệt vả mục 2 4 Những Cảnh bảo vả Thận trọng) Dược động học của
oseltamivir chưa được nghiên cứu ở những bệnh nhân “bệnh thận giai đoạn cuối” (tức là độ thanh thải creatinin < 1011111 phút)
không đang thẩm phân máu Do đó, không có liếu khuyên dùng cho nhỏm bệnh nhân nảy.
Phỏng ngừa bệnh cúm
Không cần điếu chinh liếu cho những bệnh nhân có độ thanh thải creatinine trên 60 ml/phút. Ở những bệnh nhân có độ thanh
thải creatininc từ 30—60 ml/phút, liếu dùng Tamifiu nến được giảm xuống còn 30mg, một ngảy uống một lần. Ở những bệnh
nhân có độ thanh thải creatinine tư 10— 30 ml/phủt, cần giảm liều Tamifiu xuống 30mg uống cách ngảy một lần. Ở những bệnh
nhân đang thấm phân mảu định kỳ, có thể dùng 1iếu khỏi đầu 30 mg Tamifiu trước khi băt đằu thẩm phân máu. Đế nông độ
thuốc trong huyết tương được duy tri trong khoảng trị lịệu, nên dùng một liếu 30 mg Tamifiu sau môi những lần thẩm phân
máu xen kẽ Đổi với thẩm phân phúc mạc, nên dùng ] liếu 30 mg Tamifiu trước khi bắt đẩu thấm phân mảu vả sau đó bố sưng
các liếu 30 mg mỗi 7 ngảy. (Xem mục 3.2.5 Đặc tính Dược động học ở những đối tượng đặc biệt vả mục 2. 4 Những Cảnh báo
vả Thận trọng). Dược động học của oscltamivir còn chưa được nghiến cứu ở những bệnh nhân “bệnh thặn giai đoạn cuối”
(tức là độ thanh thải creatinin < 10m1/ phủt) không đang thâm phân mảu. Do đó, không có Iiếu khuyên dùng cho nhóm bệnh
nhân nảy.
Bệnh nhãn suy gan
Không cần điếu chinh liếu cho những bệnh nhân bị rối loạn chức nãng gan nhẹ hoặc vừa khi được điều trị hoặc phòng ngừa
bệnh cúm (Xem mục 3.2.5 Đặc tính Dược động học ở những đối tượng đặc biệt). Độ an toản vả đặc tính dược động học ở
bệnh nhân suy gan nặng chưa được nghiên cứu.
Bệnh nhân suy giảm miễn dịch
Việc dự phòng cúm mùa cho bệnh nhân suy giảm míễn dịch tư 1 ruổi trở lên được khưyên là 12 tuần. Không cần điếu chinh
liếu (xem mục 2.2).
Người gia“
Không cần điếu chinh liếu cho người giả khi được điều trị hoặc phòng ngừa bệnh cúm (Xem mục 3.2.5 Đặc tinh Dược động
học ở những đối tượng đặc biệt)
Trẻ em
Tinh hiệu quả của Tamiqu ở trẻ dưới một tuối chưa được xảc lập (Xem mục 3.2.5 Đặc tinh Dược động học ở những đổi tượng
đặc biệt). Các dữ liệu dược động học gợi ý rằng Iiếu 3 mg/kg hai lần một ngảy ở trẻ từ 6 đến 12 thảng ruồi cho nông độ chất
chuyển hoá có hoạt tinh trong huyết tương ớ đa số bệnh nhi tương tự như nông độ có hiệu quả lâm sảng ở trẻ lớn hơn vả
người lớn. Những dữ liệu lâm sảng hỉện có chưa đủ để đưa ra lìếu khuyên dùng cho trẻ dưới 6 tháng tưôi (xem mục 2 1 Chỉ
định điều ưi)
2.3 Chống chỉ định
Quá mẫn với oseltamivir phosphatc hoặc với bẩt kỳ thảnh phần nảo cùa thuốc. W
2. 4 Những Cảnh báo và Thận trọng
Co giật và các biến cố tâm thần kinh giống như mê sảng đã được ghi nhận ở những bệnh nhân củm dùng Tamifiu, chủ yếu
xảy ra ở trẻ em và thanh thiếu niên. Trong một vải trường hợp rất hiếm gặp, cảc biến cố nảy gây nẻn chấn thương do tai nạn.
Vai trò cùa Tamiqu đối với cảc biến có nảy hiện vân chưa biết rõ và các biển cố nảy cũng đã được ghi nhặn ở những bệnh
nhân bị cúm mả không dùng Tamifiu. Ba nghiên cứu dịch tễ học quy mô lớn độc lập đã khắng định rằng các bệnh nhân nhiễm
cúm đang dùng Tamiflu không có nguy cơ xảy ra các biến cố vê tâm thần kinh cao hơn so với những bệnh nhân nhiễm củm
không dùng thuốc khảng vi rủt (xem phần 2. 6. 2 Sau khi lưu hảnh thuốc).
Bệnh nhân (đặc biệt trẻ em và thanh thiếu niên), cằn được theo dõi chặt chẽ các dắu hiệu hảnh vi bất thường.
Không thấy bằng chứng về hiệu quả cùa Tamỉfiu trong bắt kỳ bệnh nảo gây bời các tác nhản không phải vì rủt cúm type A và
B.
Để điếu chinh liếu cho những bệnhnhân bị suy thặn, xin xem mục 2.2.1 Những hướng dẫn liểu dùng đặc biệt và mục 3.2.5
Đặc tinh Dược động học ở những đôi tượng đặc biệt
Một lọ Tamifiu 30g để pha huyến dịch uống có chứa 25 ,713g sorbitol. Một liếư 4Smg oseltamivir uống hai lần mỗi ngảy sẽ
đưa vảo cơ thể 2 ,6g sorbitoi. Với những bệnh nhân không dung nạp fructose di truyến, liếu nói trên vượt quá mức sorbitol tối
đa được khuyên dùng hảng ngảy
2.4.1 Tảc động lên khá nãng lải xe và vận hảnh máy móc
Không áp đụng.
2. 4. 2 Tương tảc với các thuốc khác và các hình thức tương tác khác
Thông tin từ những nghiên cứu về dược lý và dược động học của oseltamivir phosphate cho thẳy không có khả năng xảy ra
cảc tương tảo thuốc có ý nghĩa về mật lâm sảng.
Một lượng lớn oseltamivir phosphate được chuyền hoá thảnh hợp chắt có hoạt tinh nhờ esterase, xảy ra chủ yếu ở gan. Cảc
mong tác thuốc do sự cạnh tranh với esterase vẫn chưa được bảo cảo nhiếu trong y vản. Do oseltamivix vả chẳt chuyến hóa có
hoạt tinh đều gắn kết kém với protein hưyết tương, khả năng tương tác đo chiếm chỗ cùa thưốc khó có thể xảy ra…
Cảc nghiên cứu in vitro cho thẳy cả oseltamivir phosphate lẫn chất chuyến hoá có hoạt tinh đều không phải lả chất nền tốt cho
men oxidase có chức nảng hỗn họp P450 hoặc cho men glucuronyl transferases. (Xem mục 3. 2 Cảc đặc tính dược động học).
Không có cơ sơ nảo vẻ mặt cơ chế cho thắy có sự tương tảc với thưốc ngừa thai dùng đường uống.
Cimetidine, một chất ửc chế không dặc hìệu cùa các đồng dạng cytochrome P450 và lá chất cạnh tranh với những thuốc gổc
ba-zơ hoặc thuốc cation hoá để bải tiết qua ống thận, không có ảnh hướng gi lên nồng độ trong huyết tương của oseltamívir
hoặc chất chuyển hoá có hoạt tinh của nó
Xét về mặt lâm sảng, cảc rương tác thuốc quan rrọng có liên quan đến sự cạnh tranh để bải tiểt qua ống thận khó có thể xảy ra
do giới hạn an toản đã được biết của hẩu hết cảc thuốc, đặc điềm thải trừ cùa chắt chuyến hoá có hoạt tính (sự lọc ở vi cầu
thận và bải tiểt ở ống thận dưới dạng anion) và khả năng thải trừ của những đường nảy. Dùng thuốc đồng thời với probenecid
sẽ lảm tảng nổng độ các chắt chuyền hoá có họạt tính lẻn gần gắp đôi do lảm giảm sự bải tiết chủ động của chủng' 0 ống thặn
Tuy vậy, nhờ giới hạn an toản của chẳt chuyển hoá có hoạt tinh rắt rộng nên không cần thiểt phải đỉều chỉnh liều khi dùng
thuốc chung với probenccid.
Dùng thuốc đồng thời với amoxicillin không lảm thay đồi nồng độ cùa cả hai loại thuốc trong huyết tương, điếu nảy cho thẳy
răng sự cạnh tranh để được bải tiểt dưới dạng anion là rất yêu
Dùng thuốc đồng thời với paracetamol không lảm thay đối nồng độ trong hưyết tương cùa oseltamivir, chất chuyền hoá có
hoạt tính cùa nó, hoặc paracetamol.
Không có tương tảc thuốc về dược động học giữa oseltamivir hoặc chẩt chuyền hqá chính cùa nó được ghi nhận khi dùng
chung oseltamivir với paracetamol, acid acetyl—salicylic, cimctidine hoặc cảc thuôc kháng acid (magnesium vả hydroxiđ
nhỏm vả carbonate canxi), warfarỉn, rimantadine hoặc amantadine.
Trong cảc nghiên cứu lâm sảng điều trị và dự phòng pha III, người ta đã dùng Tamiflu chung với cảc thuốc thông dụng khác
như thuốc ức chế men chuyến (cnalapril, captopril), các thiazide lợi tiếu (bcndrofluazide), kháng sinh (pcnicillin,
cephalosporin, azithromycin, erythromycin vả doxycycline), thuốc chẹn thụ thể H2 (ranitidine, cimetidine), chẹn beta
(propranolol), các xanthine (thcophylline), thuốc giông giao cảm (pseudoephedrinc), chế phấm thuốc phiện (codeinc),
corticosteroids, thuốc giãn phế quản dạng hit, và thuốc giảm đau (aspirin, ibuprofen vả paracetamol) Ị(.hông thẩy có sự thay
đổi nảo về phản ứng phụ hoặc tần suât xuât hiện cảc phản ứng phụ khi dùng Tamiflu chung với các thuốc nảy.
z.s. Sử dụng ở các đối tượng đặc biệt
2.5.1 Phụ nữ có thai
Nguy cơ thai kỳ nhóm B
Những nghiên cứu về tác động của thuốc lên sự sinh sản ở động vật, được tiến hảnh trên chuột và thò, không ghi nhận hiện
tượng quải thai nảo Những nghiên cứu về khả nãng sinh sản vả độc tính sinh sản đã được tiến hảnh trên chuột. Không thắy có
bằng chứng về ảnh hướng cùa thuốc lên khả năng sinh sản ở tất cả cảc liều oseltamivir đuợc nghiên cứu. Ó chuột vả thỏ
người ta thẩy nồng độ cùa thuốc ở phôi thai khoảng 15-20% nổng độ thuốc cùa thú mẹ.
Trong khi khỏng có thử nghiệm lâm sảng có đối chứng được tiển hảnh về việc sử dụng oseltamivỉr ở phụ nữ mang thai, chi có
ít dữ liệu từ các báo cảo sau khi lưu hảnh thuốc và cảc nghiến cứu quan sảt hồi cứu. Những dữ liệu nảy kết hợp với các
nghiên cứu trên động vật không cho thấy những tảc hại trực tiêp hoặc gián tiếp đối với thai kỳ, sự phảt triển phôi/thai hoặc
sau khi sình (xem mục 3. 3 An toản tiền lâm sảng) Phụ nữ có thai có thế uông Tamifiu, sau khi cân nhắc thông tin an toản sẫn
có, khả năng gây bệnh cùa chùng vi rủt cúm hiện hảnh và thể trạng cùa người phụ nữ có thai.
2.5.2 Bá mẹ cho con bú
Ó chuột cho con bú, oseltamivir vả chất chưyển hoá có hoạt tính được bải tiết vảo trong sữa. Cỏ rẳt ít thông tin về trẻ cm được
nuôi băng sữa của mẹ đang dùng oseltamivir vả vê sự bải tiêt của oseltamivir vảo sữa mẹ. Cảo dữ liệu hạn chế đã chi ra răng
oseltamivir và chất chuyển hoá có hoạt tính cùa nó đã được tìm thẳy trong sữa mẹ, nhưng ở nổng độ thấp, duới mức đạt được
ở iiẽu điêu trị cho trẻ cm. Sau khi cân nhãc thông tìn nảy, tính gây bệnh của chủng vi n'1t củm hiện hảnh và tình trạng sức
khoẻ của bá mẹ cho con bù, có thế xem xét đên việc sử dụng oseltamivir.
2.5.3 Sử dụng ở trẻ em
Xem mục 2.2.1 Những hướng dẫn liều dùng đặc biệt vả 3.2.5 Đặc tính dược động học ở những đối tượng đặc biệt.
2.5.4 Sử dụng ở ngưới lớn tuổi
Xem mục 2.2.1 Những hướng dẫn liếu dùng đặc biệt vả 3.2.5 Đặc tính dược động học ở những đối tượng đậc biệt.
2.5.5 Suy thận
Xem mục 2.2.1 Nhũng hướng dẫn liều dùng đặc biệt vả 3.2.5 Đặc tính dược động học ở những đối tượng đặc biệt.
2.5.6 Suy gan
Xem mục 2.2.1 Những hướng dẫn liều dùng đặc biệt vả 3.2.5 Đặc tính được động học ở những đối tượng đặc biệt.
2.6. Các tác dụng không mong muốn
Thông báo cho bảc sỹ những tảc dụng không mong mưốn gặp phải khi sử dụng thưốc
2.6.1 Ca'c thử nghiệm lâm sảng
Thông tín an toán chung của Tamifiư được dựa trên dữ liệu từ hơn 2647 bệnh nhân người lớn/thanh thiếu nỉên vả 858 bệnh
nhân trẻ em bị cúm, vả dựa trên dữ liệu từ hơn 1945 bệnh nhân người lớn/thanh thiếu niên vả 148 bệnh nhân trẻ em được
dùng Tamiflư để dự phòng củm trong cảc thử nghỉệm lâm sảng. Trong các nghiên cửu điểu trị ở người lón/thanh thiếu niên,
các phản ứng ngoại ý hay gặp nhất là buổn nôn, nôn vả đau đầu. Phần lởn các phản ứng ngoại ý nảy được báo cảo chi xưắt
hiện một lần, xảy ra trong ngảy điếu trị đầu tiến hoặc thứ hai vả tự hết trong vòng 1-2 ngảy sau đó. Trong ca'c nghiên cửu dự
phòng ở người iớn/thanh thiếu niên, đa số các phản ưng ngoại ý được bảo cảo lả buồn nôn, nôn ói, đau đầu vả đau. Ở trẻ em,
phản ứng ngoại ỷ thường gặp nhất lả nôn ói. Ở phần lởn bệnh nhân, những phản ưng nảy không dẫn đển ngừng sử dụng
Tamifiu.
Điều rrị vả dự phòng cúm ở người lởn và thanh thiểu niên
Trong cảc nghiên cứu điếu trị vả dự phòng ở người 1ớn/thanh thiếu niên, cảc phản ứng ngoại ỷ xưất hiện thường xuyên nhất
(21%) ở liếu khuyến cản (75 mg, ngảy 2 1ẳn, trong 5 ngảy đế điếu trị và 75 mg ngảy một lần, có thể kếo dải đến 6 tuần để dự
phòng), vả tỷ lệ xuất hiện các phản ứng ngoại ý cao hơn ít nhất là 1% ở nhóm Tamiflu so với giả dược, được nếu trong bảng
1.
Nhóm dân số trong cảc nghiên cửu điếu trị củm có cả những người 1ớn/thanh thiếu niên khoẻ mạnh vả những bệnh nhân “có
nguy cơ” (những bệnh nhân có nguy cơ cao gặp các biến chứng có 1iên quan với cúm, chẳng hạn như các bệnh nhân lớn mồi
và cảc bệnh nhân bị bệnh timfbệnh hô hẳp mạn tinh). Nói chung, thông tin về độ an toản ớ cảc bệnh nhân “có nguy cơ" là
tương đương về cảc loại phản ửng ngoại ỷ so với nhóm những người lởníthanh thiếu niên khoẻ mạnh.
Các thông tin về độ an toản được báo cảo ở cảc đối tượng uống Tamiflư với liều khưyền cáo để dự phòng (75 mg ngảy một
lần có thể kéo đải đền 6 tuần) cũng tương tự về các 1oại phản ứng ngoại ý như những gi thắy được ở các nghiên cửu điều trị
(Bảng 1), cho dù thời gian sử đụng thưốc trong các nghiến cứu dự phòng kẻo dải hơn.
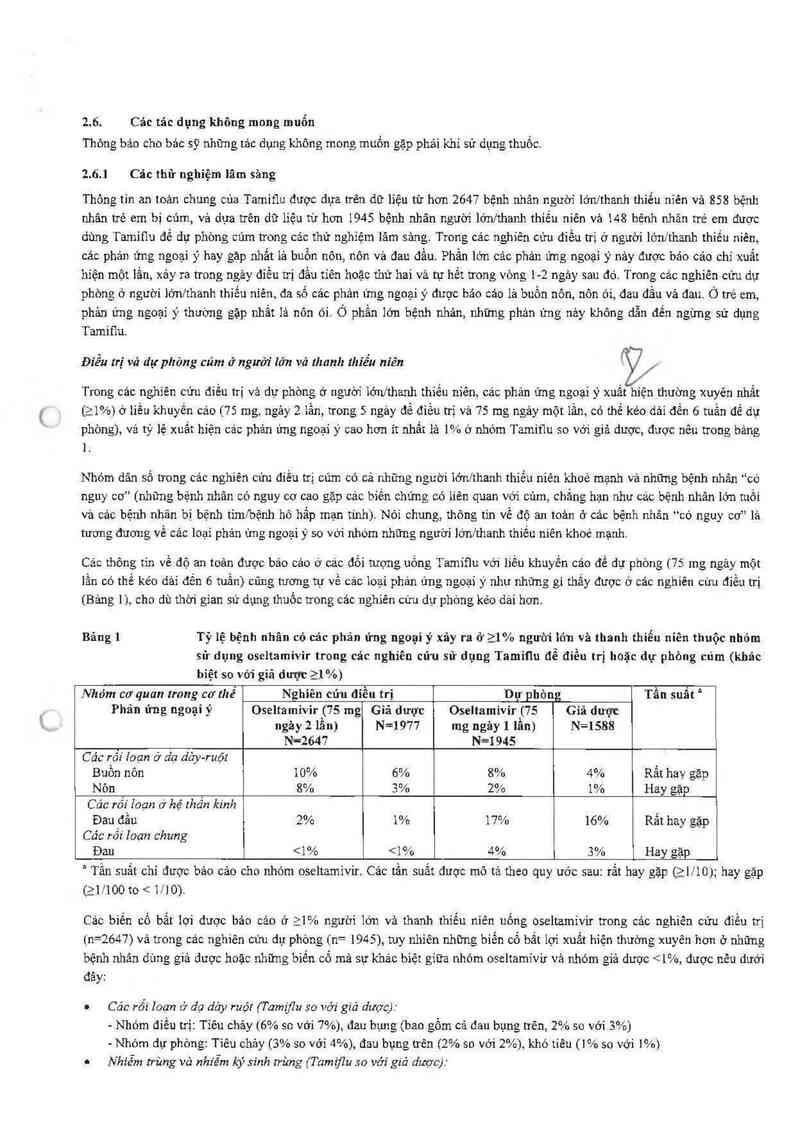
Bảng 1 Tỷ lệ bệnh nhân có cảc phản ứng ngoại ý xảy ra ở 21% ngưòi lớn vả thanh thỉếu niên thuộc nhớm
sữ dụng oseltamivir trong cảc nghiên cứu sử dụng Tamil1u để điều trị hoặc đự phòng cúm (khảc
biệt so với giả dượt 21 %)
Nhóm cơ quan trong cơ thể Nghiên cửu điều trị Dự phòng Tần suất “
Phản ứng ngoại y' Oseltamivir (75 mg Giã dược Oseltamivir (75 Giá dược
ngảy 2 lần) N=1977 mg ngảy 1 lẩn) N=1588
N-2647 N=1945
Cảc rối Ioạn ờ dạ dảy—ruột
Bưồn nôn 10% 6% 8% 4% Rất hay gặp
Nỏn 8% 3% 2% 1% Hay gặp
Cảc rối Ioạn ở hệ thẳn kinh
Đau đầu 2% 1% 17% 16% Rẳt hay gặp
Các rối“ loạn chung
Đau <1% <1% 4% 3% Hay gặp
' Tần suất chi được bảo cảo cho nhóm oseltamivir. Cảc tần suất được mô tả theo quy ước sau: rất hay gặp (21! 10); hay gặp
(ì11100 to < 1l10).
Các biến cố bất lợi được bảo cảo ở 21% người 1ớn vả thanh thìếu niên nống oseltamivir trong cảc nghiến cứu đìều trị
(n=2647) vả trong các nghiên cứu dự phòng (n= 1945), tuy nhiên những biến cố bắt lợi xuất hiện thường xuyên hơn ở những
bệnh nhân dùng giả dược hoặc những biến cố mả sự khác hìệt giữa nhóm oscltamivir vả nhóm giả dược <1%, được nêu dưới
đây:
c Các rổi loạn ở dạ dởy ruộz (Tamijlu so với giả dược) :
- Nhóm điều trị: Tỉêu chảy (6% so với 7%), đau bụng (bao gổm cả đau bụng trên, 2% so với 3%)
- Nhóm dự phòng: Tiêu chảy (3% so với 4%), đau bụng trên (2% so với 2%), khó tiêu (1% so vởi 1%)
* Nhiễm trùng vờ nhiễm ký sinh trùng (Tamijlu so vởi giả dược):
- Nhóm điều trị: viêm phế quản (3% so với 4%), viêm xoang (1% so với 1%), nhiễm herpes simplex (1% so với 1%)
- Nhóm dự phòng: viêm mũi họng (4% so với 4%), nhiễm trùng đường hô hấp trên (3% so với 3%), cúm (2% so với 3%)
' Ca'c rối Ioạn chung (T amiqu so với giả dược):
— Nhóm điếu trị: hoa mảt (bao gồm cả chóng mặt, 2% so với 3%),
— Nhóm dự phòng: mệt mòi (7% so với 7%), sốt (2% so với 2%), giá cúm (1% so với 2%), hoa mắt (1% so với 1%), đau
chi (1% so với 1% nhóm trẻ từ 1 — 12 tuổi được dùng ose1tamivir trong cảc thử nghiệm 1âm sảng
để điều trị cúm mảc phải tự nhiên (n= 858) vả có tỷ lệ xuất hiện ở nhóm Tamifiu cao hơn ít nhất 1% so với nhóm giả dược
(n= 622), là nôn ói (16% ở nhóm oscltamivir so với 8% ở nhóm giả dược). Trong số 148 trẻ được ưống Tarnifiu với liều
khuyến cáo ngảy một lần trong một nghiên cứu dự phòng tại nhà sau phơi nhiễm cúm (n=99), và trong một nghiên cứu khảo
dự phòng cho trẻ em trong 6 tuần (n=49), nôn ói cũng là phản' ưng ngoại ý hay gặp nhất (8% ở nhóm osc1tamivir so với 2% ở
nhóm không dự phòng). Tamifiư được dung nạp tốt trong cảc nghiên cứu nảy và các biến có bất lợi được ghi nhận hoản toản
phù hợp với những gì đã quan sảt thẳy ở các nghiến cứu điều trị cho trẻ em bằng Tamiflu tmớc đó.
Các biển cố bất lợi được bảo cáo ở >1% trẻ em được uống oscltamivir trong các nghiên cứu điều trị (n=858) hoặc > 5% số trẻ
em trong các nghiên cứu dự phòng (n= 148), tuy nhiên những biến cố bất lợi xuât hiện thường xuyên hơn ở những bệnh nhi
dùng giả dượclkhông dự phòng hoặc những biến cố mả sự khác biệt giữa nhóm oseltamìvir vả nhóm giả dược/không dự
phòng 100°F / 37 ,80C) cộng với một triệu chửng vế hô hấp (ho hoặc sổ mũi), khi đang có sự hiện diện
của vi rủt cứm trong cộng đổng. Trong nghiên cứu nảy, 67% bệnh nhi nhiễm vi rủt cúm type A vả 33% nhiễm vi rủt cúm type
B.
Điều trị bằng Tamiflu, bắt đầu ưong vòng 48 giờ khi có ưiệu chứng đầu tiến, đã lảm giám đảng kế thời gian bệnh khoảng
35, 8 giờ so với giả dược Thời gian bệnh được xảc định 111 thời gian cho đến 1ủc giảm các triệu chứng ho, sung hưyết mũi, hết
sốt vả trở về tình trạng sức khoẻ và hoạt động bình thường. Tỷ lệ bệnh nhân bị viếm tai giữa câp giảm khoảng 40% 0 những
bé được điếu trị bằng Tamiflu so với dùng giả dược Những bé được điều trị bằng Tamiflu cững trớ vê tình trạng sức khoẻ vả
hoạt động bình thường sớm hơn khoảng hai ngảy so với những bé được dùng giả dược.
Một nghiên cứu thứ hai đã hoản tất ớ3 34 bé bị hcn phế quản tư 6 đến 12 tuối, trong đó 53, 6% có vi rủt củm dương tinh. Ộ
nhóm được điếu trị bằng oseltamivir, thời gian bệnh trung binh không được giảm đáng kề. Vảo ngảy thứ 6 (ngảy điếu trị cuối
cùng), FEV, tãng khoảng 10, 8% ở nhóm được điều trị bằng oseltamivir, trong khi ở nhóm dùng giả dược chỉ tăng 4, 7%
(p=0,0148).
Các thử nghiệm phòng bệnh củm
Phòng bệnh cúm ở người lớn va` thanh thiếu níên.
Tinh hiệu quả của Tamifiu trong việc phòng bệnh củm A và B mắc phải tự nhiên, đã được chứng minh trong ba nghiên cửu
pha III riêng biệt.
Trong một thử nghiệm pha 111 ở người lớn vả thanh thiếu niên tiểp xúc với người bị cúm sống trong cùng một nhả, Tamiflu
được bắt đấu đùng trong vòng 2 ngảy từ khi những đối tượng nảy có triệu chứng cúm đầu tiến và dùng liện tục ưong 7 ngảy,
đã lảm giảm đáng kể tỷ lệ mắc củm do tiếp xức khoảng 92%.
Trong một nghiên cứu mù đôi, có đổi chứng với giả dược được tiển hảnh ở những người trướng thảnh khỏe mạnh chưa được
tiêm chùng, tuôi tư 18- 65, Tamiilu lảm giám đáng kể tỷ lệ mắc bệnh củm có biểu hiện lâm sảng khoảng 76%, trong suốt thời
gian có dịch cúm tại cộng đồng. Những đối tượng ưong nghiên cứu nảy đã dùng Tamiflu ưong 42 ngảy
Trong một nghiên cứu mù đôi, có đối chứng với giả dược ở những người giả sổng trong nhả dưỡng lão, 80% trong số họ được
tiêm chùng vảo mùa cứm khi nghiến cứu nảy được tiến hảnh, Tamifiư lảm giảm đáng kể tỷ lệ mảc bệnh cúm cớ biền hỉện lãm
sảng khoảng 92%. Cũng trong nghiên cứu nảy, Tamifiu lảm giảm đảng kế tỷ lệ viêm phế quản, viêm phổi và viếm xoang có
liên quan đẽn bệnh cúm khoảng 86%. Những đối tượng trong nghiến cứu nảy đã dùng Tamifiu trong 42 ngảy.
Trong cả ba thứ nghiệm lâm sảng trên, khoảng 1% số đối tượng dùng Tamifiu để phòng cúm đã bị củm trong quá trình đùng
thưôc.
Trong các thử nghiệm lâm sảng pha III nảy, Tamifiu cũng 1ảm giảm đảng kề tỷ lệ phát tán vi rút vả ngăn chặn sự lan trưyền vi
rút trong gia đỉnh một cách thảnh công.
Phỏng bệnh cúm ở trẻ em ạ
Tinh hiệu quả cũa Tamifiu trong việc ngăn ngữa bệnh cúm mắc phải tự nhiên đã được chứng minh trong một nghiên cữu
phòng bệnh củm sau khi tiểp xúc với nguôn nhiễm. Nghiên cứu nảy được tiến hảnh tại nhả vả gôm những bé từ 1 đên 12 tuổi,
cả những trường hợp chỉ điếm lẫn những tiường hợp tiếp xúc trong gia đình. Thông số chính để đánh giá tính hiệu quả cùa
thưốc trong nghiên cứu nảy lả tỷ lệ măc bệnh cúm trên lâm sảng có kết quả xét nghiệm dương tinh với vi rưt. Trong nghiên
cứu nảy, Tamiqu dạng huyền dịch uống với liền từ 30mg đến 75mg, môi ngảy một lẩn, trong 10 ngảy đã được dùng cho
những bé chưa bị phảt tán vi rủt lúc ban đằư cho thắy đă lảm giảm tỷ lệ mắc bệnh cúm có biếu hiện lâm sảng xảc nhận bằng
xét nghiệm đương tính với vi rút từ 21% (15/70) ở nhóm trẻ không được điểu trị dự phòng so với 4% (2/47) ở nhóm trẻ được
điều trị dự phòng.
Phỏng bệnh cúm ở những bệnh nhân suy giảm mỉễn dịch
Một nghiến cứu mù đôi có đối chững giả dược được tiển hảnh để dự phòng bệnh củm theo mùa ở 475 đối tượng sưy giảm
miễn dịch, trong đó có 18 trẻ em từ 1 — 12 tuối. Người ta đảnh giả bệnh cúm có biền hiện lâm sảng được xảo nhặn bầng xét
nghiệm, theo định nghĩa lả dương tinh với phản ứng RT-PCR kèm theo thân nhiệt đo ở miệng >99, OOF/ 37, 20C kèm theo ho
vảlhoặc sổ mũi, tất cả được ghi lại trong vòng 24 giờ. Trong số các đổi tượng chưa phảt tản vi n'lt lủc ban đằu, Tamifiu lảm
giậm tỷ lệ mắc phải bệnh cúm có biếu hiện lâm sảng được xảc nhận bằng xét nghiệm từ 3% (71231) trong nhóm không được
đíều trị dự phòng xuống còn 0,4% (1l232) trong nhóm được điếu trị dự phòng
Sự để khăng cúa vi rút
Sự giảm nhạy cám của men neuraminidase của vi rủi
Các nghiên cứu lăm sờne: Nguy cơ xuất hiện cảc chùng vi rút cúm với tính nhạy cảm giảm hay để khảng oseltamivir đã được
nghiên cứu kỷ trong cảc nghiên cứu 1âm sảng do Roche tải trợ. Tắt cả các bệnh nhân mang vi rứt khảng oseltamivir chi cho
thắy đế khảng thoáng qua, họ vân thải trừ được vi rủt như bình thường và không có diễn tiến xắu vế triệu chứng.
Bệnh nhân mang vi rủt có dột biến đề kháng (%)
Nhóm bệnh nhân … _
Kiểu hình* Kiêu hình và kiêu gen*
Người lớn và thanh thiếu niên 4l1245 (0,32%) 5/ 1245 (0,4%)
Trẻ em (1-12 mối) 19/464 (4,1%) 25/464 (5,4%)
* Toản bộ cảc kiến gen không được thực hiện trong tất cả cảc nghiên cứu.
Cảc nghiên cứu lâm sảng được tiến hảnh cho đến nay trong việc phòng bệnh cúm sau tiếp xúc (7 ngảy), sau tiếp xúc trong gia
đinh (10 ngảy) và phòng bệnh củm theo mùa (42 ngảy) không cho thấy có bằng chứng nảo về sự khảng thuốc 1iến quan đển
việc sử dụng Tamifiu ở những bệnh nhân có khả năng miễn dịch tốt. Không thấy có sự khảng thuốc nảo trong một nghiến cứu
dự phòng 12 mần ở những đối tượng suy giảm miên dịch.
Các dữ liệu Iám sảng vả theo dõi. Các chủng đột biến tự nhiên giảm nhạy cảm với oseltamivir in vitro đã được phảt hiện ở vi
rút cúm A vả củm B phận lập từ bệnh nhân chưa từng uống oseltamivir. Ví dụ, năm 2008 đề kháng oseltamivir do sự thay thế
H275Y đã được tìm thắy 6 > 99% cảc mẫu phân lập củm HlNl lưu hảnh ở châu Âu năm 2008, ương khi cúm H1N1 năm
2009 (“củm lợn”) gần như đều nhạy cảm hoản toản với oseltamivir Các chùng đề kháng cũng được phân lập từ cả những
bệnh nhân có miên dịch tốt lẫn nhũng bệnh nhân suy giảm miễn địch được điều trị bằng ose1tamivir.Sự nhạy cảm với
oseltamivir và tỉ lệ mắc các vi rút đế khảng dường như thay đổi theo mùa cũng như theo địa lý Cũng đã có báo cáo về sự để
khảng oseltamivir khi điều trị lẫn khi dự phòng ở những bệnh nhân bị cùm trong địch củm H1Nl
Tỳ 1ệ xuất hiện đề kháng có thế cao hơn ở những nhóm tuổi nhỏ nhắt, vả trong nhóm cảc bệnh nhân sưy giảm miễn dịch. Các
vi rủt đề kháng oseltamivir phân lập được từ các bệnh nhân điều trị bằng oseltamivir vả các chùng vi rút củm kháng
ose1tamivir chọn 1ọc ưong phòng thí nghiệm đều cho thấy có mang đột biến ở cảc neuraminidase N] và N2. Các đột biến
kháng thuôc có xu hướng đặc mmg theo phân nhóm vi rút.
Các bác sỹ nên cân nhắc thộng tin hiện có về cảc dạng nhạy cảm với thuốc của vi rủt cứm cho timg mùa trước khi quyết định
dùng Tamifiư hay không (để có thông tin mới nhắt, xin xem trên website cùa WHO vả/hoặc chinh quyền sở tại).
3.2 Các đặc tính đuợc động học
3.2.1 Hấp thu
Oseltamivir được hấp thu nhanh chóng ở đường tiêu hỏa sau khi ưống oseltamivir phosphatc và một phần lớn thuốc được
chuyển hóa thảnh chât có hoạt tính, chủ yểu nhờ men esterase ở gan Nông độ trong hưyết tương cùa chắt chuyến hóa có hoạt
tinh có thể đo được trong vòng 30 phút, đạt gần Inổng độ đỉnh 2—3 giờ sau khi dùng thưốc và cao hơn đáng kể (> 20 lần) nổng
độ cùa tiến dược. Có ít nhắt 75% lượng thuốc uỏng vảo được tuần hoản dưới dạng chắt chuyền hóa có hoạt tính. Nồng độ của
chất chuyển hóa có hoạt tinh trong huyết tương tỷ lệ với liếu dùng vả không bị ảnh hưởng bởi thức an đùng cùng (Xem mục
2. 2 Liều lượng vả Cảch đùng)
3 2 2 Phan bo
Thể tích phân bố trung binh (Vss) của chất chuyến hóa có hoạt tinh lả khoảng 23 lít ở người.
Gốc có hoạt tinh tới được tất cả cảc vị trí quan trọng bị nhiễm vi rút cùm qua nghiên cứu trên chồn, chuột vả thò. Tron
những nghiên cứu nảy, người ta đã thẳy nồng độ chât chuyền hóa có hoạt tỉnh kháng vi rủt tập trung ở phổi, địch n’Ja phê
quán-phế nang, chất nhầy ở mũi, tai giữa và khí quản sau khi uỏng oseltamívir phosphate
Mức độ gắn kết của chẳt chưyển hỏa có hoạt tinh với protein huyết tương ở người lá không đáng kể (xấp xỉ 3%) Mức gắn kết
cùa tiền dược với protein huyết tương người 1ả 42%. Với mức nảy thì chưa đủ để gây ra cảc tương tác thuốc có ý nghĩa
3. 2. 3 Chuyển hỏa
Một lưọng lớn oseltamivir phosphatc được chuyền hóa thảnh chắt chuyến hỏa có hoạt tính nhờ men esterase, men nảy khu trú
chủ yêu ở gan. Cả ose1tamivir lẫn chất chuyền hóa có hoạt tính đều không phải lả cơ chắt hoặc chẳt ức chế của các đồng dạng
cytochrome P450 (Xem mực 2. 4 2 Tương tác với các thuốc khác vả các hinh thức tương tảc thuốc)
3. 2. 4 Thãi trừ
Oseltamivir sau khi hẳp thu được thải trừ phần lớn (> 90%) bằng cách chuyến thảnh chẩt chuyến hỏa có hoạt tinh. Chắt nảy
không bị chuyền hóa tiêp mà bị thải ưừ qua nước tiếu. Nồng độ đinh cùa chắt chưyến hóa có hoạt tính trong huyết tương giảm
dần với thời gian bản thải từ 6 đến 10 giờ trong đa số trường hợp.
Thuốc có hoạt tư1h được thải trù toản bộ (> 99%) qua thận Độ thanh thải thận (18, 8 lítlgiờ) vượt quá mức lọc cầu thận (7,5
lít/giờ) cho thắy thuốc còn được thải trư tiểp qua ông thận. Dưới 20% liếc uống có đánh dẩn phóng xạ được thải trừ qua phân
3.2.5 Đặc tính duợc động học 0 những đối tượng đặc biệt
Bệnh nhân suy thận
Sau khi dùng lOOmg Tamifiu, 2 lần / ngảy, trong thời gian 5 ngảy cho những bênh nhân bị sưy thận ở các mức độ khác nhau,
người ta thắy nông độ chất chuyến hóa có hoạt tính tỷ lệ nghịch với sự suy giảm chức năng thận.
Điểu trị bệnh cúm
Không cần điếu chinh 1iểu cho những bệnh nhân có độ thanh thải creatinine ưên 60 ml/phút. Ở những bệnh nhân có độ thanh
thải creatinine từ 30— 60 ml/phút, cân giảm iiều Tamifiu xuống 30 mg uống ngảy hai lẩn, trong 5 ngảy. Ở những bệnh nhân có
độ thanh thải creatinine từ 10- 30 ml/phủt, cần giảm ]iếu Tamifiu xuông 30 mg uống ngảy một lân, trong 5 ngảy. Ở những
bệnh nhân đang thấm phân mảư định kỳ, có thể dùng liếu khới đẳu 30 mg Tamiiiu trước khi bắt đầu thẩm phân máu nếu triệu
chứng củm xuất hiện trong khoảng thời gian 48 giờ giữa hai lần thẩm phân mảu. Đề nồng độ thuốc trong huyết tương được
duy trì trong khoảng trị liệu, nên dùng một liều 30 mg Tamifiư sau mỗi chu trinh thẳm phân máu. Đối với thẩm phản phủc
mạc, một liếu 30 mg Tamifiư trước khi bắt đẩu thẩm phân máu và bổ sung các liều 30 mg mỗi 5 ngảy (Xem mục 3 2 5 Đặc
tinh Dược động học ở những đối tượng đặc biệt vả mục 2. 4 Những Cảnh báo vả Thận ưọng). Dược động học của oseltamivir
còn chưa được nghiên cứu ở những bệnh nhân “bệnh thận giai đoạn cuối” (tức lả, độ thanh thải creatinin < 10m1/ phút) không
đang thẩm phân mảu. Do đó, không có liếu khưyên dùng cho nhóm bệnh nhân nảy.
Phỏng ngừa bệnh cúm
Không cẩn điếu chinh liều cho những bệnh nhân có độ thanh thải creatinine trện 60 mI/phút Ở những bệnh nhân có độ thanh
thải creatinine từ 30- 60 m1/phút, cần giảm liều Tamif1u xưống còn 30 mg uổng ngảy một lần, trong 5 ngảy. Ở những bệnh
nhân có độ thanh thải creatinine từ 10 30 ml/phút, cần giảm 1iều Tamifiu xuõng còn 30 mg, cảch một ngảy uống một lần Ở
những bệnh nhân đang thầm phân máu định kỳ, có thể dùng liều khới đầu 30 mg Tamifiu trước khi bắt đầu thấm phận mảu.
Đê nông độ thưổc trong huyết tương được dưy tri trong khoảng trị 1iệu, nên dùng một liếu 30 mg Tamifiu sau mỗi lần thấm
phân mảu xen kẽ. Đối với thẩm phân phức mạc, nên dùng một liếu 30 mg Tamifiu trước khi bắt đầu thẳm phân máu vả bổ
sung các liếu 30 mg mỗi 7 ngảy (Xem mục 3.2.5 Đặc tính Dược động học ở những đối tượng đậc biệt vả mục 2.4 Những
Cảnh báo vả Thận trọng). Dược động học của oseltamivir cờn chưa được nghiên cứu ở những hệnh nhân “bệnh thặn giai đoạn
cưổi” (tức 1ả, độ thanh thải creatinin < lOmll phút) không đang thẳm phân máu. Do đó, không có 1iều khuyên dùng cho nhóm
bệnh nhân nảy.
Bệnh nhãn suy gan
Dựa trên những nghiến cứu trong phòng thí nghiệm vả trên động vật, ở nhĩmg bệnh nhân sưy gan nhẹ hoặc ưung bình, gia
tăng đáng kể nông độ oscltamivir vả chắt chuyền hóa có hoạt tinh không được ghi nhận vả điêu nảy đã được xảc định lại
trong cảc nghiên cứu lâm sảng (Xem mục 2. 2 1 Những hướng dẫn liếu dùng đặc biệt) Độ an toản và đặc tinh dược động học
ở bệnh nhân suy gan nặng chưa được nghiên cứu.
Người giã
Ở người lớn tuối (từ 65 đến 78 tuổi), nồng độ cùa chẩt chuyền hóa có hoạt tính ở trạng thái ốn định cao hơn khoảng 25 35%
so với người trẻ khi dùng cùng một liều Tamiflu. Thời gian bán thải cùa thưốc ở người giá tương tự như ở người trẻ Căn cứ
vảo nồng độ cùa thuốc vả khả nảng dưng nạp, không cần điếu chinh 1iều cho người giả khi được đỉếu trị hoặc phòng ngừa
bệnh củm (Xem mục 2. 2 1 Những hướng đẫn liếu dùng đặc biệt)
Trẻ em từ ] tuổi
Dược động học cùa Tamiflu đã được đánh giá trongmột nghỉến cứu dược động học iiều đớn ở trẻ cm từ 1 đến 16 tuồì. Dược
động học đa 1iều cũng đã được nghiên cưu ở một sô it trẻ từ 3 đển 12 mổi ương một thử nghiệm 1âm sảng. Trẻ nhỏ tuối có
mức độ thải trù cảc chắt chuyến hóa có hoạt tinh nhanh hơn so với người lớn, lảm cho nổng độ thuốc trở nên thắp hơn nểư xét
theo liếu được cho tính bằng mglkg. Liều 2mg/kg và các 1iếu 30mg vả 45mg khi dùng cho trẻ cm theo khuyến cáo ở mục 2.2
cho nống độ tác dụng cùa oseltamivir carboxylatc tương tự với nồng độ đạt được ở người lớn dùng liều đơn viên nang 75mg
(xẩp xi lmg/kg). Dược động học của ose1tamivir ở trẻ cm trên 12 tuổi tương tự như ở người lớn. 9
Trẻ em [ừ 6—12 tháng
Hiện có ít dữ liệu về nống độ thưốc trong cơ thể trong phân nhóm bệnh nhân từ 6—12 thảng tuồi tham gia trong các nghiên cứu
về được lực học, được động học vả tinh an toản ở trẻ nhiễm cúm dưới 2 tuối. Các dữ liệu hiện có gợi ý rảng nổng độ thước
sau khi uống [iếư 3 mg/kg ở đa số trẻ 6-12 tháng tuối tương tự như nổng độ đạt được ở trẻ lớn hơn và người 1ớn đang uổng
liền được phê chuẩn. Các tác dụng không mong mưốn được bảo cảo phù hợp với những thông tin về an toản đã thiểt lập ở trẻ
lớn hơn.
3. 3 Tính an toản tiến lâm sâng
Những dữ liệu tiền lâm sảng không cho thấy mổi ngưy hiếm đặc biệt nảo cùa thưốc cho người dựa ưẽn các nghiên cứu thông
thường về dược học an toản, độc tính liếư lặp lại và độc tính trên gen
3.3.1 Tính sinh ưng thư
Ba nghiến cứu về khả năng gảy ung thư (cảc nghiện cứu hai năm ở chưột nhẳt vả chuột lớn với oseltamivir, vả thử nghiệm sáu
thảng vê trao đồi gen Tg: AC` ơ chuột nhảt được tiến hảnh với chất chuyển hóa có hoạt tinh) cho kết quả âm tinh.
3.3.2 Tính gây đột biển
Oseltamivir vả chất chuyền hóa có hoạt tính cho kểt quả âm tính trong 16 thử nghiệm chưẩn gây độc trên gen.
3.3.3 Suy giãm khả năng sinh sản
Nghiên cứu về khả năng sinh sản ở chuột với Iiếu lên tới lSOOmg/kg/ngảy đã chứng minh không có tác động có hại nảo iên cả
hai giới.
3. 3. 4 Tính gây quải thai
Các nghiên cứu về quái thai đã được tiến hảnh với liều lên tới 1500mglkg/ngảy` ơ chuột vả 500mgfkg/ngảy ớ thỏ Không ghi
nhận được tác động nảo của thuốc lên sự phảt ưiến cùa phôi thai. Trong các nghiên cứu chu sinh ở chuột, quả trinh chưyển dạ
kéo dải được ghi nhận ở liều 1500mg/kg/ngảy: giới hạn an toản giữa liểư điếu trị ở người vả liều cao nhất không gây hại
(500mg/kg/ngảy) ở chuột lả gâp 480 lần đối với oseltamivir vả gâp 44 lần đối với chât chuyến hóa có hoạt tính Nồng độ
thuốc ở phôi chuột vả phôi thỏ xâp xi 15 đến 20% nổng độ ở mẹ.
3.3.5 Đặc tính khải:
Ở chuột cho con bú, oscltamivir vả chất chuyền hoá có hoạt tinh được bải tiết vảo trong sữa. Ở người, vẫn chưa biết liệu
oseltamivir vả chất chuyền hoá có hoạt tính có được bải tiểt vảo trong sữa mẹ hay không Thế nhưng từ phép ngoại suy của
cảc dữ liệu ở động vật, có thể dự đoản có khoảng 0 ,Olmg oseltamivir vả 0 ,3mg chắt chuyền hoá có hoạt tính được bải tiết vảo
trong sữa mẹ mỗi ngảy.
Khả năng da nhạy cảm với oseltamivir được ghi nhận trong một xét nghiệm “tối đa hóa” ở chuột lang. Sau khi gây kich ứng
với dị nguyện những con vật thí nghiệm nảy, người ta thây có khoảng 50% con vật được điều trị với hoạt chất chính đơn
thưần có xuât hiện ban đó. Sự gây kich ứng có hổi phục ở mãt thò cũng đã được phát hiện.
Trong khi 1iếư rẳt cao oscltamivir phosphat dùng đườn uống đã không gây ra một biến cố bất lợi nảo ở chuột trướng thảnh,
thì liếư nảy lại gây độc tinh ở chưột con 7 ngáy tuổi, ke cả tử vong Những biến có bẩt lợi nảy đã được ghi nhận với liều 657
mglkg và cao hơn. Ở lỉếu 500 mg/kg, không có biến cố bất lợi nảo được ghi nhặn, kể cả khi điếu trị lâu dải (chưột 7 đến 21
ngảy tuổi dùng liều 500 mglkg/ngảy).
4. CÁC ĐẶC TÍNH DƯỢC HỌC
4.1 Bão quãn
Viên nang: Bảo quản thuốc Ở nhiệt độ dưới 30°C.
Bột pha huyến dịch ưống: không bảo quản thuốc ở nhiệt độ trên 30°C.
Huyến dịch đã được pha: bảo quản thuốc ở nhiệt độ phòng (không quá 25°C) trong 10 ngảy hay trong ngăn mát tủ lạnh (2°C
— 80C) trong 17 ngảy.
4.2 Hướng dẫn đặc biệt cho việc sử dụng, hũy bỏ thuốc
Huỷ bỏ thuốc không sử đụnglhết hạn
Cần hạn chế việc thãi bỏ được phẫm ra môi trường. Không thâi bỏ dược phẩm qua hệ thống nước thải vã tránh vút
bỏ vảo rảc thải sinh hoạt. Hãy sử dụng “hệ thống thu gom” ở địa phương, nếu có.
Độ ổn định
Không nến sử dụng thuốc sau ngảy hết hạn được ghi ở vỏ hộp. ạ
Cách sử dụng và hủy bỏ
Chuẩn bi bỏt Tamiqu cho dang hưvển dich uốni.7 (6 mQ/mL)
Bột Tamii1u cho dạng huyến dịch uống nên được pha bới dược sĩ trước khi đưa cho bệnh nhân (Xem mục 2.2 Liều lượng vả
Cách dùng):
]. Vỗ vảo lọ thuốc đỏng kín vải 1ần đế thuốc tới ra.
Đong 55 ml nước. Sứ dụng cốc lường nước (được cung cẳp sẵn) vả đong nước đến mức đã chi đinh.
Đổ 55 ml nước vảo lọ thưôc để pha thưốc vả lắc kỹ lọ thuốc đã được đóng kin ưong 15 giây.
Mờ nắp lọ thuốc (loại bảo vệ không cho trẻ mớ) và ẩn bộ phận tiếp hợp vảo cố lọ thuốc.
'.J'PP’N
Đóng nắp bâo vệ lọ thuốc lại thật chặt. Điểu nảy giúp cố định đủng chỗ bộ phận tiếp hợp 6 lọ thuốc và khả nảng bảo
vệ cùa nắp lọ thuốc.
Tờ hướng dẫn sử dụng và ống lấy thưốc sẽ được đưa cho bệnh nhân. Nên viết ngảy hết hạn cùa huyền dịch đã pha trên nhãn
thuôc.
Pha khẩn cẩg hỗn dích uổng từ viên nang TamiQu (Nồng đó cuối cùng 6 mg / ng.
Dạng hỗn dịch cùa Tamifiu (6 mg/mL) được ưa chuộng cho cảc bệnh nhân trẻ cm và người lớn gặp khó khản trong việc nuốt
cảc viên nang hoặc cần đùng liếu thấp hơn. Trong ưường hợp Tamifiu dạng hỗn dịch không có săn, dược sĩ có thể pha hỗn
dịch (6 mg/mL) từ viên nang Tamifiu
Pha chế hỗn dich tai nhả thuốc rơ mz/mL)
Quy trình sau đây mô tả việc pha chế một dung dich 6 mng tại nhà thưôc sẽ cung cấp đủ liếu thuốc cho 1 bệnh nhân dùng
trong đợt điếu trị 5 ngảy.
Dược sỹ có thể pha chế một huyến dịch (6 mg/ml) từ viến nang Tamiflu 30 mg, 45 mg hoặc 75 mg và nước có chứa 0,05%
sodium benzoate được thêm vảo để bảo quản.
Trước tiên, tính tống thề tich cần pha chế vã đưa cho tùng bệnh nhân. Tồng thế tich cần thiết được xa'c định bằng cân nặng
của bệnh nhân dựa theo khuyến cáo trong bảng dưới đây:
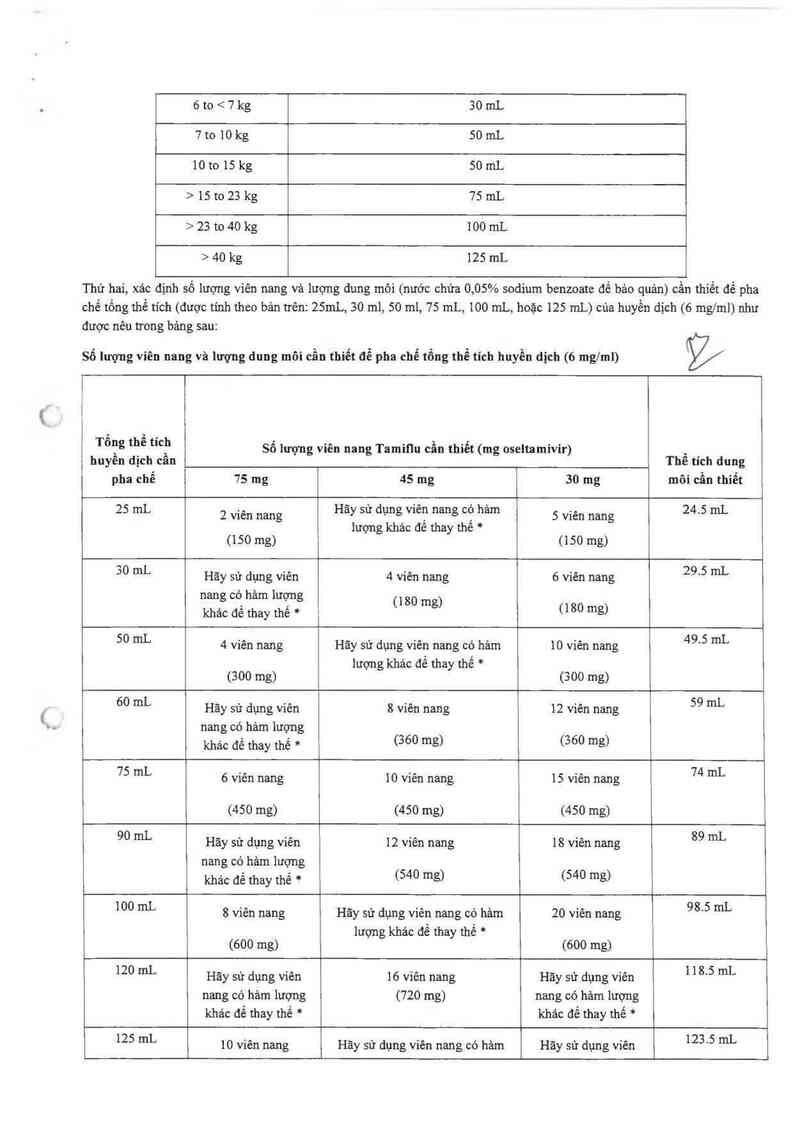
Thế tich hưyến dịch (6 mg/ml) cần pha chế tại hiệu thuốc cho một đợt điếu trị 5 ngảy dựa trên cân nặng cùa bệnh nhân:
Cân nặng (kg) Tổng thể tích huyền dịch (ml)
<6kg 25 mL
6to<7kg 30mL
7to 10kg SOmL
10to 15 kg SOmL
> 15t023 kg 7SmL
>23 to4O kg lOOmL
>40 kg 125mL
Thứ hai, xác định số lượng viên nang và lượng dung môi (nước chứa 0,05% sodium benzoate đề bảo quản) cần thiết để pha
chế tống thể tích (được tính theo bản trên: 25mL, 30 ml, so ml, 75 mL, 100 mL, hoặc 125 mL) của huyền dịch (6 mg/ml) như
được nêu trong bảng sau:
Số Iuợng viên nang vã lượng dung môi cần thiết để pha chế tổng thể tích huyến dịch (6 mg/ml)
%
Tông thể tích Số luọng viên nang Tamiqu cần thiết (mg oselta mivir) ,
huyen dịch can Tbe tích dung
pha chế 75 mg 45 mg 30 mg môi cẩn thiết
25 mL 2 viên nang Hãy sử dụng viên nang cộ hảm 5 viên nang 24.5 m].
1ượng khác đê thay the *
(150 mg) (150 mg)
30 mL Hãy sử dụng viên 4 viến nang 6 viên nang 29'5 mL
nang có hảm 1ượng (180 m
. g)
khác đã thay thế * (180 mg)
50 mL 4 viên nang Hãy sử dụng viên nang có hảm 10 viện nang 49'5 mL
1ượng khác để thay thế *
(300 mg) (300 mg)
60 mL Hăy sữ dụng viên 8 viên nang 12 viên nang 59 ml.
nang có hảm 1ượng
khác để thay thế * (360 mg) (360 mg)
75 mL 6 viên nang 10 viên nang 15 viên nang 74 mL
(450 mg) (450 mg) (450 mg)
90 ml. Hãy sử dụng viên 12 Viên nang 18 viên nang 89 mL
nang có hảm lượng
khảc để thay thế * (540 mg) (540 mg)
100 mL 8 viên nang Hãy sử đụng viên nang có hảm 20 viên nang 98'5 mL
lượng khảc để thay thế *
(600 mg) (600 mg)
120 ml. Hãy sử đụng viến 16 viến nang Hãy sử dụng viên 118'5 mL
nang có hảm lượng (720 mg) nang có hảm lượng
khảo để thay thế * khác để thay thế *
125 mL 10 viên nang Hãy sử dụng viên nang có hảm Hãy sử dụng viên 123 '5 mL
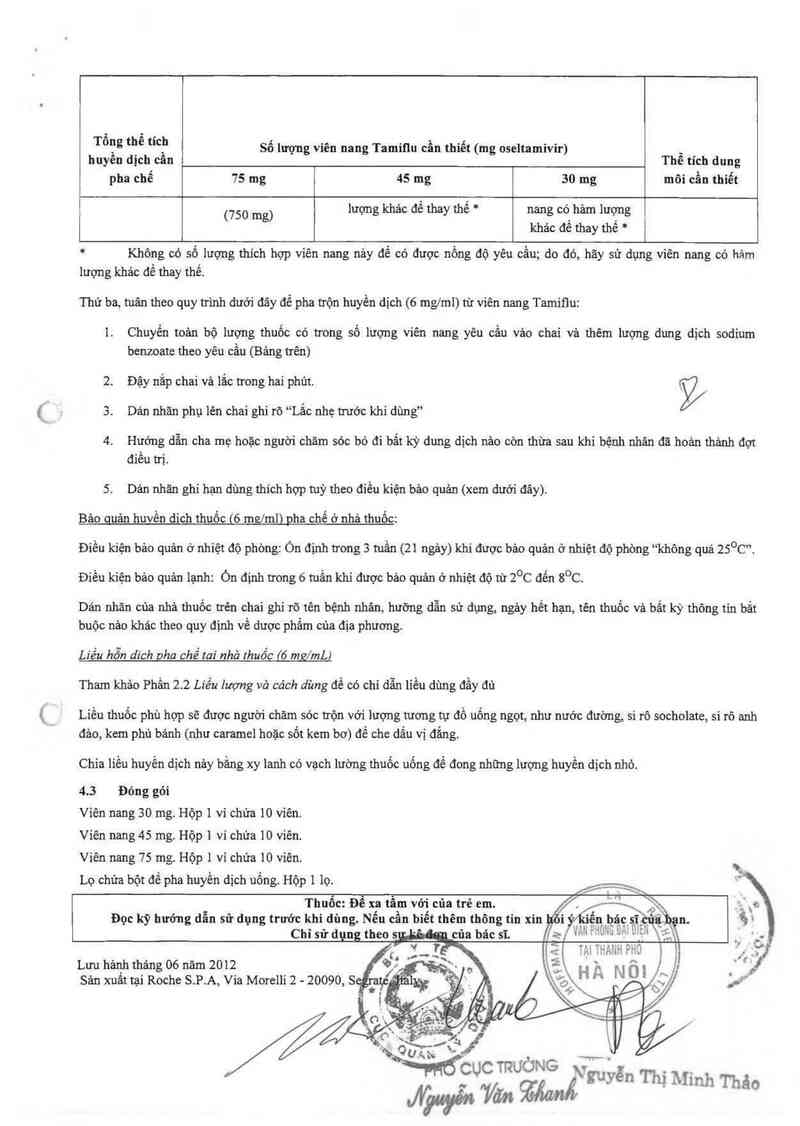
Tông thê tích Số lượng viên nang Tamiflu cần thiết (mg oseltamivir)
huyến địch cần Thể tích đung
pha chế 75 mg 45 mg 30 mg môi cẩn thiết
' (750 mg) lượng khảo để thay thế * nang có_ hảm lượng
khảo đe thay thế *
* Không có số lượng thich hợp viên nang nảy đế có được nồng độ yếu cẩu; đo đó, hãy sử dụng vỉên nang có hảm
lượng khác để thay thể.
Thứ ba, tuân theo quy trinh dưới đây để pha trộn hưyền dịch (6 mg/ml) từ viên nang Tamiflư:
]. Chuyến toản bộ lượng thuốc có trong số lượng viến nang yêu cẳu vảo chai vả thếm lượng đung dịch sodium
benzoate theo yêu cầu (Bảng trên)
2. Đậy nắp chai vả lắc trong hai phủt. ý
3. Dán nhãn phụ lến chai ghi rõ “Lắc nhẹ trước khi dùng”
4. Hướng đẫn cha mẹ hoặc người chăm sóc bỏ đi bẳt kỳ đung dịch náo còn thừa sau khi bệnh nhân đã hoản thảnh đợt
điều trị.
5. Dán nhãn ghi hạn dùng thích hợp tuỳ theo điều kiện bảo quản (xem dưới đây).
ửu_ản huvến đich thuốc (6 ma/ml) pha chế ở nhả thuốc:
Điếu kiện bảo quản ở nhiệt độ phòng: Ón định trong 3 tụần (21 ngảy) khi được bảo quản ở nhiệt độ phòng “không quá 25°C”.
Điếu kiện bảo quản lạnh: on định trong 6 tuần khi được bảo quản ở nhiệt độ ui 2°c đển s°c.
Dán nhăn của nhà thuốc trên chai ghi rõ tên bệnh nhân, hướng dẫn sử dụng, ngảy hết hạn, tên thuốc và bắt kỳ thông tin bắt
buộc nản khác theo quy định về dược phầm của địa phương.
Liều hỗn dich uha chế tai nhả thuốc {ở m2/mL)
Tham khảo Phấn 2.2 Liều lượng vả cách dùng đế có chỉ dẫn liều dùng đầy đủ
Liều thưốc phù hợp sẽ được người châm sóc trộn với lượng tương tự đồ uống ngọt, như nước đường, si rô socholate, si rô anh
đảo, kem phủ bảnh (như caramel hoặc sốt kem bơ) để che dấu vị đắng.
Chia liểư hưyền dịch nảy bằng xy lanh có vạch lường thuốc uống để đong những lượng huyến đich nhò.
4.3 Đỏng gói
Viến nang 30 mg. Hộp 1 vi chửa 10 viên.
Viên nang 45 mg. Hộp 1 ví chứa 10 viên.
Viến nang 75 mg. Hộp ] vỉ chứa 10 viên.
Lọ chứa bột để pha huyến dịch ưống. Hộp 1 lọ.
_ Tbưôc: Đê xa tãm với của trẻ em. , ' ` ầ\
Đọc kỹ hưởng dân sử dụng trước khi đùng. Nếu cần biểt thêm thông tin xin 1 _ jénlhạẹ_srĩ … f n.
Chỉ sử dụng theo 5 ^ …. cũa bảc sĩ. è ’iii'i P.’iỦ›ib … .iiEn …
"t 1… Ễ ti_.i iitiiiii Pho \
Lưu hảnh thảng 06 nãm 2012 ©,“ _ __~~. ụ Ễ H À N ôi ,
Sản xuât tại Roche S.P.A, Via Morelli 2 - 20090, s~.__. tẹwl iự ẹ,_ -_ …Ọ ' gì
"1 ,. . , |. …,;
nt² t" JJ l s ẽLz
' . ' ""Ĩiẫ` . Q '
. Ồ \ 7_ : (
` Qu.ml`jj TRUỞNG — . |
C C ~ . _
U \S'Uyễn Tin Minh Thảo
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng