





















n .
464/89 @; 23/WML
fflGM ASCOU PICW W
. 07649 oon=hm MENHIR
I
"ẨỂ'ỂỦTENT some zscps vu [“ỉẳồưas 00 26.09.2014 ioo1 M Jảè
Í”Ẩẵ“fucoo i"“`WVietnam Mi-iễivetica — Ề\
im STASTOZ93 (92 00 x 47 00 x 47 ,00}
""" “C… A w… mo- 1 wưs 1… n hu FUĩl'ỉLll mvmnsn mm
|W s_n_ắw_u … vỉrir. 541 NT._mỉ | | | …. … … 3’g’",ị… "om
lũnnw ..
. . 1 _!
Agg… . " ' ......- .. _… .. … … w... ~ 1… N
Document Updating: l ] 1 i .
tMiưflrmu Nízer Illiia S.r.l. pm… mau: min uul mumwuwun nm… nummwusmn
BỘ Y TẾ
CỤC QUAN LÝ DƯỢC
ĐÃ PHÊ DUYỆT
|
|
|
|
1
soldea ez io xoa
se|nSdeo puuq
Lẩn dấu:....fflJẮJ…ễQẩỒ
muuiuns
.WỂWS
hun uoudinwd Xu
+
m m… m n M … nmmu
Sutent '
…… _ …
Ru Thuỏc bán theo dm Ri: Prescriptlon onty
lwd un…- up Sutent su te nt vn- ung nhg
la dỡ . › n . nap thư…
' … _ _ _... sunitinib sunitimb
|
.- w Eml
' .
ì :
, ! Viên nang cưng hard capsules uu ,,ủ
Ench clptule cenulut l . Sunitinib (din ahte)
Sunninib In mdnm 50mg ! — 50m mg _
su.… uu… :o'c ' = “" ““ăn ớướ' 3
Raiằnynackino innn : . Đọc Mk_ỹẻiỦlìg dn W'dụn "ước
M uu _
ẵưu ml! o! InIIẸÍI M : _ ễể " hin “7 Vì em
erildnn Ch! đinh cách dùng. … 3 … m…»… 4 … mm… 5 …
Document Updatings
cowmm J momww Pfizer Italia S.r.l. DO N0rtAwen - mu… Armt PRIN'nNG | MƯMA LA …msm - nmom mm … STA…
Each cupouh come
Sunitinib (as malate) 50mg
Slore below 30°C
Sutent“
Manuhdurldb . . .
T sumtinlb
Pũzer Italla s.….. Italy
XXXXXXX
DD/MMJYY
DDlMM/YY
ẵ
ề
E
'—'2
D
…
h
ề
tt
n
đ
ủS
ha capsules }
ư
azmeaeooa 2 capsu|es Ế
..
LEGEND/LEGENDA: 9
.u:Hívi~ tí-ti—t' t.r:=ìtgăH i`ALMN _ —
LOT Batchnum. Lotto
MFN Mfg. Date Preparazione
EXP: Exp.Date Scadenza
LPD dale: A ug 19. .?(H 4
Counny; l'iemam
Reference C DS: verxion 37.0 Reference CDS date: Ang 14. 2014
R, SUTENT® QW
4.2
,(éĩ—fi’Ểi ÉS ,23fio/(íf—
CẨNH BÁO ĐẶC BIỆT:
Thuốc nảy chỉ dùng theo đơn của bác sĩ
Đọc kỹ hướng dẫn sử dụng trước khi dùng.
Không dùng quá liều chỉ định.
Thông báo cho bác sĩ những tác dụng không mong muốn gặp phải khi sử dụng thuốc.
Nếu cần thêm thông tỉn xin hỏi ý kiểu bảc sĩ.
Không sử dụng thuốc đã quá hạn dùng.
Để xa tầm tay trẻ em.
TÊN SẢN PHẨM
SUTENT
THÀNH PHẨN ĐỊNH LƯỢNG VÀ ĐỊNH TÍNH
Mỗi viên nang chứa 12,5 mg; 25 mg hoặc 50 mg sưnitinib (dưới dạng muối malat)
DẠNG BÀO CHẾ
Viên nang cứng gelatin
ĐẶC TỈNH LÂM SÀNG
Chỉ định điều trị
Sunitinib được chi dịnh đỉều trị khối u mô đệm đường tiêu hóa (GIST , _rọđntestinai stroma]
tumor) sau khi thắt bại đ iếu trị bằng ìmatinib mesylat do bị đề khảng hoặc ong dung nạp (xem
Mục 5.1).
Sunitinib được chỉ định đìểu trị ung 11…- biểu mô tế bảo thận tiến triển vả! hoặc di căn (MRCC -
metastatic renal cell carcinoma) ở những bệnh nhân chưa được dùng thuôo (xem Mục 5.1).
Sunitinib được chi định điếu trị ung thư biều mô tế bèo thận tiến trìến vả/ hoặc di căn (MRCC)
sau khi thât bại điêu trị vởỉ cytokin (xem Mục 5.1).
Liễu dùng và phương phảp sữ dụng
Liễu khuyến cảo cùa sunitinib lả uống_một lần duy ithắt 50 mg_mỗì ngảy, dùng trong 4 tuần
liên tiêp, sau đó lả thời gìan nghỉ 2 tuân (thời gian biên 4/2) đê tạo thảnh chu kỳ trọn vẹn 6
tuân.
Có thể dùng sunitinib cùng hoặc không cùng thức ăn.
Khi quên không uống một Iiêu, bệnh nhân khỏng được uỏng Iiêu bô sung. Bệnh nhân cần
dùng iiẽu thông thường đã được chỉ định vảo ngảy hôm sau.
, .n ỈỈủ
4.3
4.4
LPD daiei Aug 19. 2014
('ounhy: I'vemam
chference CDs. version 3 7.0 Reference C DS date. Aug 14. 201—?
Thav đôi liếu
Độ an Ioản vả dung nạp
Thay đối liều theo gia số 12, 5 mg được ảp dụng cản cứ vảo độ an toản và khả năng dung nạp
của từng cá thế để dùng tới 75 mg hoặc giảm xuống 25 mg.
Có thế phải dùng Iiều dựa theo độ an toản và khả năng dung nạp cúa từng cá thể.
Ức chế/ cám ứng CYP3A4
Nên trảnh phổi hợp sunitinib với các chắt gây cảm ứng mạnh CYP3A4 như rifampicin (xem
Mục 4.5). Nếu không thế trảnh phối hợp thì liếu sunitinib cần tăng theo gia sô 12.5 mg cho
tởi iiều tối đa lả 87,5 mg mỗi ngảy, dụa trên cơ sở theo dõi cân thận về khả năng dung nạp
thuốc.
Cân trảnh phôi hợp sunitinib với cảc chât ức chế mạnh C YP3A4 như ketoconazoi (xem Mục
4.5). Nêu khỏng thê trảnh phôi hợp. cân giảm lìẽu sunitinib theo gia sô cho đên Iỉêu tôi thỉêu
môi ngảy là 37,5 mg.
Khuyên cảo khi cân đùng thuôc khảo cùng với sunitinib, nến chọn thuỏc không có hoặc có
rât ít tiêm nảng gây cảm ửng hoặc ức chế CYP3A4.
Sử dụng ở Irẻ em
Chưa xảo định được độ an toản vả hiệu quả cùa sunitinib trên bệnh nhân nhi.
Sử dụng ở người cao !uối
Khỏng cân chỉnh liêu ớ bệnh nhân cao tuỏỉ. Có khoảng 34% sô đôi tượng trong cảc nghiên
cứu iâm sảng vê sunitinib lả 2 65 tuỏi. Không nhận thây sự khảc biệt đáng kê nảo vê độ an
toản vả hìệu quả cùa thưôc giữa bệnh nhân trẻ tuõi vả bệnh nhân cao tuỏỉ.
Suy gan /
Khõng cần điều chỉnh liếu khi dùng sunitinib cho hệnh nhân suy gan nhẹ (Chiổổgh/loại A)
hoặc trung bình (Chỉld—Pugh loại B). Chưa có nghiên cứu sử dụng sunitinib ở bệnh nhân suy
gan nặng (Chiid-Pugh loại C) (xem Mục 5.2).
Suy Ihận
Không cần điều chỉnh liếu khỏi đẩu khi đùng sunitinib cho bệnh nhân suy thận (nhẹ - nặng)
hoặc cho bệnh nhân bị bệnh thận giai đoạn cuối đang phải thẩm tách máu. Việc đỉều chĩnh
liều dùng tỉếp theo nên dụa vảo độ an toản và khả năng dung nạp cùa mỗi bệnh nhân.
Chống chỉ định
Không dùng sunitinib cho bệnh nhãn mẫn cảm với sunitinib hoặc bât kỳ thảnh phân nảo cùa
thuôc.
Cảnh bảo đặc biệt vả thận trọng khi sử dụng
Da vả mô
Đối mảu da có thế do mảu (vảng) của hoạt chất lả tác dụng không mong muốn rất thuờng gặp
được bảo cảo trong cảc thử nghiệm lâm Sảng Bệnh nhân cân đuợc cảnh báo về việc mắt săc tố
LPD đam: Ang 19. 2014
Coumry: l'l'elnơm
Reference CDS: 1-ersion 37, (J Rejemnce CDS dum: A ug 14. 2014
da hoặc tóc có thể xảy ra trong quá trình điều trị với sunitinib Nhũng tảo dụng khảc trên da có
thể gặp bao gồm khô. dảy hoặc nứt da, gỉộp da hoặc có khi phảt ban o gan bản tay, chân
Những hiện tượng trên đây không tích iũy, có thể hồi phục và thường không cẫn ngừng diễu trị.
Phản ứng da nghiêm trọng đã đuợc bảo cảo, bao gồm trường hợp hồng ban đa dạng vả nhũng
trường hợp Ơợi ý hội chun g Stevens-Johnson, trong đó có một số trường hợp gây tử vong.
Nếu có dẩu hiệu hoặc triệu chúng cùa hội chứng Stevens-Johnson hoặc hồng ban đa dạng (ví
dụ: ban da ngảy một nặng thêm thường đi kèm vởi mụn nước hoặc tốn thương niêm mạc),
cần ngung điều trị bằng sưnitinib. Nếu chẳn đoản xác định iả hội chứng Stevens-Johnson,
không đuợc bắt đầu lại liệu pháp sunitinib. Trong một số trường hợp nghi ngờ hồng ban đa
dạng, bệnh nhân đã dung nạp thuốc dùng lại liệu phảp sunitinib ở liều thẩp hơn sau khi gìảì
quyêt tình trạng phản ứơn =,; một số bệnh nhân nảy cũng đuợc dùng biện phảp điều trị đồng
thời với corticosteroid hoặc thuốc khảng histamin.
HÍệlĩ (ượng cháy máu
Các hiện tượng chảy máu đuợc bảo cáo sau khi thuốc đã luu hảnh trong đó có một số ca gây tử
vong, gồm cả xuât huyết đường tiêu hóa, hô hắp, khối u, đường tiẽt niệu vả não Trong cảc thừ
nghỉệm lâm sảng, chảy mảư khối u uặp ở khoảng 2% số bệnh nhân bị u mô đệm đường tiêu hóa
(GIST). Nhũ~nu hiện tưọng nảy có thể gặp đột ngột vả trong truờng họp cảc khối 0 ở phồi. có
thế bỉều hiện bằng ho ra máu hoặc xuất huyết phối nghiêm trọng đe đọa tính mạng. Cảo trường
hợp xuất huyết phối, một vải trường họp dẫn đến tử vong đã được quan sát trong cảc thù
nghiệm iâm sảng vả được bảo cản sau khi thuốc dã 1u~u hảnh ở những bệnh nhân sử dụng
sunitinib để điều trị unƠ thu biểu mô tế bảo thặn, u mô đệm dường tiêu hóa vả ung thư phổi
khônn tế bảo nhỏ có đi căn Sunitinib không được phê duyệt đề đùng cho bệnh nhân ung thu
phồi không tế bảo nhỏ
Cảc hiện tuợng xuất hưyết gặp ở 18% số bệnh nhân dưng sunitinib ở pha điếu tn1Ềlđỷ/cùa
nghiến củu GIST so với 17% ở bệnh nhân dùng giả duọc. Với bệnh nhân dùng shny tnib để
chủ ung thu biếu mỏ tế bảo thận tiến tn'ến vả] hoặc di căn (MRCC) chưa được dùng thuốc
trưởc đó, 39% số bệnh nhân có cảc hiện tượng chảy mảu so với 11% số bệnh nhân dùng
interferon alpha (IFN- u) Có 17 (4,5%) bệnh nhân dùng sunitinib so với 5 bệnh nhân (1 ,7%)
dùnƯ lFN — ot có các hiện tượng chảy mảu từ độ“ J trờ lến. Trong số các bộnh nhân dung
sunitinib để điều t1ị ung thư biếu mô tế bảo thận tiến triến vả/ hoặc di căn (MRCC) khảng
cytokin, có 26% số bệnh nhân bị xuất huyết. Dảnh giả thường quy các hiện tượng nảy cân bao
gôm việc đếm tế bảo máu toản phẩn vả khám sưc khoẻ tồnư Ồquảt
Đưỏn g Jiéu hóa
Cảc bỉên chửng đường tiêu hóa nghiếm trọng, có khi gây tử vong, bao gôm thủng đường tiêu
hóa đã xảy ra ở cảc bệnh nhân bị u ảc tinh trong ô bụng có sử dụng sunitinib.
Các phán ủng về Iíẻu hỏa
Buồn nôn, tiêu chảy, viêm mỉệng, khó tiêu và nôn iả cảc biến cố đuờng tiêu hóa iiên quan tới
thuốc thường gặp nhắt. Diều trị hỗ trợ cảc tác dụng không mong muôn ơ đuờnU tiêu hóa có thế
bao gõm thuốc chống nôn hoặc chống tiêu chảy.
LPD dme; Aug 19. 201-!
COKIITÍI'JI' f 'Jelmmr
Reference C DS. vcrsr'on 3 7.0 Reference CDS đale: Aug 14. 3014
V i'ém tụy
Vĩẽm tuy đã được bảo cảo trong cảc thừ nghỉệm lãm sảng cùa sunitinib. Tăng lipase vả amylase
— huvết thanh được ghi nhận ở bệnh nhân có các khối u đặc khảo nhau sử dụng sunitinib. Sự
tăng nồng độ lỉpase lả nhắt thởi vả thuòng không kèm theo dắu hiệu hoặc triệu chứng viêm tụy
ở những bệnh nhăn có cảc khối u đặc khảc nhau Nê eu gặp cảc hiệu chúng viêm tụy , bệnh nhân
cân ngừng dùnƠ sưnitinib và có biện pháp săn sóc hỗ trợ thích hợp
Độc íỉnh gan
Độc tính gan đã được quan sảt thấy ở nhũng bệnh nhân điều trị bằng sunitinib. Các trường hợp
suy gan, đôi khi dẽ… đến tử vong, được quan sảt thấy ở < 1% bệnh nhân có khối u đặc đỉều trị
bằng sunitinib. Cần theo dõi các xét nghiệm chức năng gan (nồng độ alanin transaminase
[ALT], aspartat transaminase [AST], bilirubin) uuớc khi bắt đầu diều trị, tronư mỗi chu kì
đỉều trị, vả khi được chỉ định lâm sảng. Cần ngùng sunitinib khi gặp cảc tảo dụng khỏng
monU muốn về gan ở độ 3 vả độ 4 và không tỉếp Lục nếu khỏng có giải phảp.
Huyết học
Gìảm số lượng tuyệt đối bạch cầu trung tính và giảm số lượng tỉều cằu đã được báo cảo tnong
các thử nghiệm lâm sảng. Cảo biến cố nảy không tích lũy, có thể hồi phục và không cẩn phải
n gừng thuốc. Ngoài ra, có những trường hợp xuất huyết tử vong có liên quan đến giảm bạch cầu
đã được bảo cảo lrong quá trình lưu hảnh thuốc.
Cân tìên hảnh vỉệc dêm tế bảo máu tnản phần vảo lúc khởi đẩu mỗi chu kỳ điêu trị cho bệnh
nhân dùng sunitinib.
T im mạch
Các biến cố tim mạch, bao gồm suy Lim, bệnh cơ tỉm thiếu máu cơ tim cục bộ và nhồi máu co
tim ,trong đó có một số truờng hợp gãy tủ vong đã được báo cảo trong quá trình luu hảnh thuốc.
Sử dụng sunitinib một cảch thbận trọng ở bệnh nhân có nguy cơ hoặc có tiên sử bị những biến cố
nảy. TronU cảc thử nghiệm lâm sảng ,sự gìảm phân suất tống mảu thắt trái ở > 20% và duới
ranh gỉởi thấp cùa múc bình thưởngồ xảy ra ở khoảng 2% bệnh nhân có khối u mô đệm đường
tỉêu hóa đìếu trị bằng sunitinib, ở 4% bệnh nhânung thư biền mô tế bảogh n le xa khánƯ
cytokin và ở 2% bệnh nhân đùng giả dược. Sụ giảm phân suất lống mảu thắix\J iỵnay không có
vẻ tiến Lrỉến và thường duợc cải thỉện khỉ tĩếp tục điều trị.
Nghỉên cửu ung th ư biều mô tế bảo thận ở bệnh nhân chưa điều trị thẳy có 27% bệnh nhân dùng
sunitinib vả 15% bệnh nhân dùng lFN— [I. có giả lrị phân suất tống mảu thắt trải duới ranh giới
thấp của mức bình thường Có hai bệnh nhãn (< 1%} dùng sunitinib đuợc chắn đoán lá có bệnh
suy tim sung huyết.
Suy lim, suy tim sung hưyết hoặc bệnh tâm thất trải đã gặp ở 0,8% bệnh nhân có khối u đặct vả
ở 1% bệnh nhân dùng giả dược.
Bệnh nhãn có cảc bỉến cố về tim mạch, như nhổi máu cơ Lim (bao,, ơồm đau thắt ngực nghiêm
trọngfkhông ỏn định), đã bị bắc cẩu động mạch ngoại biên / vảnh tỉm bệnh suy tỉm sung huyết
có Lrỉệu chửng, tai biến mạch mảu năo, con thiếu máu cục bộ thoảng qua, hoặc tắc mạch phổi
' Ả s \ , 'A r A ` ằ . Ắ R A … A A `
Ket qua tư cac nghien cưu lam sang ban đau, chu yeu bao gom bẹnh nhan LL mo đẹm đương
tíêu hóa và ung thư biêu mô tế bảo thận khảng cytokin.
LPD date: Aug .’9. 2014
C ommy: [ “iemam
Reference CDS: rerxion 37 0 Reference C DS dam: .4ng H, 20ỉ 4
trong vòng 12 tháng trước khi dùnu sunitinib đã đuợc loại ra khỏi cảc nghiên cứu lâm sảng của
sunitinib. Chua rõ bệnh nhân trong các đỉều kiện nảy có thế có nguy cơ cao hon tronƯ việc ciphảt
triến l`ốỉ loạn chức năng tâm thẳt trái do thuốc hay khỏng. Thầy thuốc nến cản IìlìẳC giữa nguy
cơ nảy VỚI lợi ích của thuốc Cảc bệnh nhân nảy cân được theo dõi chu đảo về các dâu hiệu vả
triệu chứng lâm Sảng cùa suy tim sung huyết mỗi khi dùnƯ sunitinib. Cũng nên cân nhắc đảnh
giả nên và đánh gỉá định kỳ phân suất tống máu thẳt trải khi bệnh nhân sử dụng sunitinib Vởi
bệnh nhản không có các yếu tô nguy cơ vê tìm. nên cản nhắc đảnlL giá phân suất Lống mảu ban
đầu.
Khi có cảc biều hiện lâm sảng của suy tim sung huyết. khuyến cảo ngừng sử dụng sunitinib.
C ung cần ngung vả] hoặc gỉảm Lỉếư sunitinib ở những bệnh nhânkhông có bằng chứng lãm sảng
cùa suy tim sung huyết nhung lại có phân suất Lống mảu < 50% vả dưới mức cơ bản > 20%.
Kéo dải đoạn QT
Với nồng độ gắp khoảng 2 lần nồng độ điều trị. thì có nhận thắy sunitinib gây kéo dải đoạn
QTcF (hiệu chỉnh Friderỉcia) (xem Mục 5 2) Không có bệnh nhân có sự kéo dải đoạn QT/QTc
lớn hon độ 2 theo tiêu chuẩn vê thuật ngữ vế cảc tác dụng không mong muốn v3 _.0 Sụ kéo dải
doạn QT có thể dẫn tới lảm tăng nguy cơ loạn nhịp LILấL bao Uồm xoắn đỉnh. Xoắn đỉnh có gặp ở
< 0, 1% số bệnh nhãn phơi nhỉễm sunitinib Cẩn dưng sunitinib một cảch thận trọng cho bệnh
nhân đã có tiến sủ kéo dải đoạn QT, bệnh nhãn đang dùng thuốc chống loạn nhịp tim hoặc bệnh
nhân trưởc đây đã có bệnh tim, nhịp tỉm chặm hoặc có rối loạn điện giải Việc phốL hợp với các
thuốc ưc chế CYP3A4 có thề lảm tảng nồng độ sunitinib trong huyết tương, do đó cân phải thận
trọng và cẩn giảm liều sunitinib (xem cảc Mục 4. 2 vả 4.5).
Tăng Ìmyể! áp
Tảng huyết áp lả Lảc dụng không monư muốn rắt thường gặp được bảo cáo trong cảc thử nghiệm
lâm sảng ở cảc bệnh nhãn có khối u đặc chu yếu bao gôm LL mô đệm đường tiêu hóa vả ung thư
tế bảo Lhận khảng cvtokỉn Cần giảm lỉều sunitinib hoặc tạm ngưng thuốc ở kh ảng 2 ,7% số
bệnh LL1LâLL.KlLÔng có bệnh nhân nảo phải ngừng điếu trị Tăng huyết ảp nghi
mmHg Lâm thu hoặc 1 10 mmHg tâm trư ơng) xảy ra ở 4 7% sô bệnh nhân. Tănẵhự
ở JS, 9% bệnh nhân dùng sunitinib đế điếu trị ung thư bĩếu mô tế bảo thận tiên triến vải hoặc di
cãn (MRCC) ở người chưa dùng thuốc so vởi 3, 6% bệnh nhân dung IFN—LJL. Tảng huyểt ảp
nghiêm trọng găp ở 12% bệnh nhân dùng sunitinib chua dùng thuốc truớc đó vả ở 1% bệnh
nhân dùng IFN— ơ. Bệnh nhân cần đuợc sảng lọc loại trừ bệnh tăng huyết ap và phải được kỉếm
soát hợp lý. Khuyến cáo tạm ngùng diều trị nếu gặp lăng huyết ảp LLghìêhL trọng mả chưa kiềm
soát được qua chăm sỏc y tế. Có thế tiếp tục đìễu trị một khi tăng huyết ảp đã được kìếm soát
hợp lý.
Rối loạn chức năn g fuyển gíáp
Khuyến cáo xét nghìệm chức nảng giáp trạng ban đằu vả những bệnh nhân nảo bị suy hoặc
cuòng giảp cần được điều trị theo các hưởng dẫn đỉều trị hìện hảnh truớc khi khởi đầu dùng
sunitinib Mọi bệnh nhân cằn được giảm sảt chặt chẽ về cảc dẳu hỉệu vả trìệu chứng rối loạn
chúc năng tuyến giáp khỉ dìếu trị bằng sunitimb. Bệnh nhân nảo có dắu hiệu vả l hoặc triệu
] Kêt quả từ các nghỉên cứu lảm sảng ban đầu, chủ yếu bao gồm bệnh nhân u mô đệm đưòng
tiêu hóa và ung thư bìếu mỏ tế bảo thận khảng cytokin.
Ln
LPD date: Aug 19. 201—í
C ommjr ! ~’ưmam
Reg/erence CDS: L~ersL'on 3 7. 0 Rejèrence C DS date: A ug 14. 20/4
chứng chủ quan về rốị ioạn chức năng tuyến giảp trạng cần được theo dỏỉ xét nghiệm chức năng
tuyến giáp và đưọc điều trị theo cảc hbuớng dẫn hiện hảnh.
Suy chức năng giáp trạng mắc phải được quan sảt ở 6. 2% số bệnh nhân có ư mô đệm đuờng
tiêu hóa đang dùng sunitinib so vởỉ 1% ở nhóm dùngb ơíả dược. Suy chửc năng gỉảp trạng được
coi như tảc đụng không mong muốn ở 16% bệnh nhân dùng sunitinib trong nghiên cứu về ung
thư biếu mõ tế bảo thận tỉến triến vả] hoặc di căn (MRCC) chưa dùng thuốc vả có 3 bệnh nhân
(< 1%) ở nhóm dùng IFN— (I vả 4% bệnh nhân qua 2 nghiên cứu vê ung thư biều mỏ tế bảo
thận kháng cytokin. Ngoài ra, sự tăng hormon kích thích tuyến giảp đuợc bảo cáo ở 2% bệnh
nhân mang ung thư biếu mô tế bảo thận kháng cytokin. Nói chung, có 7% số bệnh nhân ung thư
bỉểu mỏ tế bảo thận khảng cytokin có bằng chứng hoặc trong Eâm sảng hoặc trong phòng thí
nghìệm về suy giảp trạng cấp cưu do thuốc gây ra
Cảc trường hợp tăng chức nãng tuyến giảp, một số kéo theo giảm năng tuyến giáp đă được bảo
cảo trong các thử nghiệm lâm sảng và qua kinh nghiệm sau khi lưu lLảLLlL thuôo.
C 0 gìậL
Trong cảc nghiên cứu lâm sảng với sunitinib, có gặp co giật ở cảc bệnh nhân có bằng chứng di
căn não qua xét nghiệm )( quang. Hơn nữa, cũng có những bảo cảo hỉếm gặp (< 1%), mã trong
đó có một số trường hợp tử vong về bệnh nhân bị co giật vả có bằng chứng X quang về hội
chứng vỉêm năo trăng phía sau có thể phục hồi. Bệnh nhân bị co giật vả có đắu hiệuf triệu
chứng chẳc chắn về hội chưng viêm não tLắLLg phía sau có thể phục hồi, như Lăng huyết’ ap nhức
đẳu kém nhanh nhẹn, hư hại chúc nănư tâm thẩn, mất khả năng thị giác, bao gôm mù do ảnh
hu 011° đến vô năo thùy chẳm, cần được kiếm soát bằng chăm sóc y tế, bao gồm kiếm soát huyết
ảp, khuyến cảo tạm ngừng sunitinib. Sau khi qua khói, có thế tìếp tục dùng thuốc duới sự theo
dõi của bảo sỹ đỉều trị.
Quy frình phẫu ỈỈTUặÍ
Đã có những bảo cáo về suy giảm khả năng lảnh vết thuong trong khi đỉếu toi bằng sunitinib.
Khuyến cáo tạm ngùng điếu trị sunitinib vì lý do thận trong ở nhữnơb nh ưhẩn đang trải qua
cảc quy trình phẫu thuật lởn. Cỏ rẫt ít kinh nghiệm lâm sảng về thời gia 'dụng lại sau khi có
sự phẫu thuật lón. Do đó quyết định tiếp tục điếu trị bằng sunitinib sau phẫu thuật lớn cần đuợc
dựa trẻn việc đảnh giả phục hồi lâm sảng sau phẫu thuật.
Hoại lư xmm g hẻm:
Bệnh hoại từ xương hảm được quan sát thắy không thường xuyên trong cảc thù nghỉệm IâLLL
sảng vả cảc bảo cáo hậu măỉ & bệnh nhân điều trị bằng sunitinib. Phần 1óLL với cảc trưởng hợp
bệnh nhân đã đuợc chữa trị trước đó hoặc đồng thời với biphosphonat tỉêm tỉnh mạch (IV) thì
bệnh hoại từ xương hảm là một nguy cơ xảc định. Do đó, cân thận trọng khi sử dụng sunitinib
vả biphosphonat tìêm tĩnh mạch (IV) đồng thời hay tuần tự
Giải phẫu nha khoa cũng là một yếu tố nguy cơ gây bệnh hoại từ xương hảm. Trước khi đìều trị
bằng sunitinib nên cân nhắc khảm răng vả có bỉện pháp phòng ngừa nha khoa thỉch hợp. Ở
nhũng bệnh nhân được diếu trị bằng sunitinib mả trưởc đó đã sử dụng hoặc đang sử đụng
biphosphonat tiếm tĩnh mạch, nên trảnh gỉải phẫu nha khoa nếu có thế.
LPD dale: A ug 19. 2014
(`mmny: 1'iemmn
Reference CDS; rer.non 37.0 Reference CĐS dale: A ug M. 2014
Hội chửng ly gL'ảỉ khối u (T LS)
Các trương hợp ly giải khôi u một số trường hợp tử vong được quan sát thảy vởi tần
suất hiếm trong các thử nghiệm lâm sáng và báo cảo hậu mải ở những bệnh nhản
điêu trị bằng sunitinib. Bệnh nhãn thường có nguy cơ xuất hiện hội chứng ly giải khối u
lả những bệnh nhãn có khối u lởn trước khi phẫu thuật. Những bệnh nhản nảy nèn
được theo dõi chặt chẽ và điều trị dựa trên cảc triệu chứng lâm sáng.
VÍêm cán mạc hoại rủ-
Các trường hợp viêm cãn LLLạc hoại tử hỉêm gặp, bao gôm cả viêm cân mạc hoại từ vùng đảy
chậu, đôi khi gây từ vong ,đã được bảo cảo. Cân ngưng ìiệu pháp sunitinib Ở bệnh nhãn phát
triến viêm cân mạc hoại tử và bắt đẳu phương phảp điếu trị thích hợp nưay lập tức
Protein m'ệu
Trường hợp bị protein niệu vả hội chứng thặn hư đă được bảo cảo. Khuyến cáo nến tiến hảnh
phân tích nước tìểu ban đầu vả bệnh nhân cằn được giảm sảt protein niệu mởi bị hoặc bị nặng
thêm. Tính an toản của việc tiếp tục liệu phảp sunitinib ở bệnh nhân protein nỉệu trung bình
và nặng chưa được đánh giá một cảch có hệ thống. Ngưng sử dụng sunitinib ở bệnh nhân bị
hội chứng thận hư.
Hạ đưòng huyêt
Việc giảma nlucose huyết, trong một số trường hợp có triệu chứng iâm sảng, đã dược bảo cáo
trong qua trình đỉêu trị với sunitinib. Mức đuờng glucose trong mẽ… ở bệnh nhân đái tháo
đường cân được kiếm tra thường xuyên nhằm đánh giả xem có cân điếu chỉnh Iỉều thuốc điều
trị đái tháo đư ơng hay không để giảm thiều nguy co hạ đuờng huyết.
Tương tác vởi các th uốc khảc và các dạng tương tảc khảc
C ác Lhuốc có thế Iảm lăng nổng độ sunitinib Lrong huyết iương
Phối họp sunitinib vởỉ chắt ức chế mạnh CYP3A4, ketoconazol sẽ lảm tăng 49% nồng độ tối
đa (Cmax) và tăng 51% các giá trị diện tích dưới đường cong A , cừấ phuc hợp
[sunitinib + chắt chuyển hóa chủ yếu có hoạt tính] sau khi dùng liếu du1 sunitinib cho
người tình nguyện khỏe mạnh.
Dùng sunitinib cùng chắt ức chế mạnh họ CYP3A4 (ví dụ ritonavir, itraconazol,
erythromycin, clarỉthromycỉn, nước bưới ép) có thề lảm tăng các nỗng độ cùa sunitinib. Cần
tránh không dùng sưnitinib cùng các chắt ưc chế CYP3A4 hoặc lựa chọn phối hợp với một
thuốc mả không có hoặc có rất Ít tỉếm năng úc chế CYP3A4. Nếu lại khõng có khả năng như
vậy thì cẩn giảm liều sunitinib (xem Mục 4.2).
Các Ihuốc có thế lảm gíảm nống độ sunílỉnib lrong huyết !ương
Phối hợp sunitinib với chẳt gây cảm ứng CYP3A4, rífampicin sẽ 1ảm giám 23% nồng độ tối
đa (Cmax) và giảm 46% diện tích dưới đường cong (AUCOm} của phức hợp [sunitinib + chẳt
chuyến hóa chủ yếu có hoạt tínle sau khi dùng Iiều duy nhất sunitinib cho người tình nguyện
khỏe mạnh.
Dùng sunitinib vói các chắt gây cảm ứng mạnh nhóm enzym CYP3A4 (ví dụ phenytoin,
đexamethason, carbamazepin, rifampicin, phenobarbưal hoặc Hyperỉcum per_~foralupz còn gọi
là cây St. John’ 5) sẽ có thế lảm giảm nông độ cùa sunitinib. Vì vặy, cản tránh phối hợp với
`~J
4.6
4.7
4.8
LPD daLe~ Aug I9. 20H
Coumer l'iemam
Rẹ/erence C DS: rersion 37.0 Reference CDS dale: Aug !4. 2014
cảc chất gây cảm úng hoặc lả chọn phối hợp vởỉ một thuốc thay thế mả không có hoặc Lất ít
có tìềm năng gậy cảm ủng CYP3A4. Nếu trường hợp bắt buộc phải phối hợp thuốc, có thể
cần phải tăng lìều sunitinib (xem Mục 4.2).
Ảnh hường đến khả năng sinh sản, phụ nữ có thai và thời kỳ cho con bú
Mang Ihai
Chưa có những nghiên cứu về sử dụng sunitinib trong thai kỳ ở người.
Nghiên cứu trên động vật cho thắy thuốc có độc tính trên sự sinh sản, bao gồm eây quải thai
(xem Mục 5.3). Không dùng sunitinib trong thai kỳ hoặc cho phụ nữ khỏng có biện pháp
ngừa lhaì hữu hiệu trừ khi lợi ích cho mẹ vượt hẳn LLơuy cơ tỉềm tảng với thai nhi Nếu dung
sunLtinỉb khi có [hai, hoặc nếu bệnh nhận trót có thai trong khi đang dùng sưnitinib thì bệnh
nhân cằn được cảnh bảo về nguy cơ tiềm tảng với thai nhi. Phụ nữ có khả năng mang thai
đuọc khuyến nghị tranh mang thai khi điều trị bằng sunitinib
Liều sunitinib (0,3; I,O; 3,0 mg/kglngảy) đã được đảnh giả trong cảc nghiên cửu trưởc vả sau
khi sinh trên chuột cống đang mang thai. Với iiều ì [ mg/kg/ngảy, sự tăng cãn cùa chuột mẹ
giảm trong quá trình mang lhaì vả cho con bú, nhưng không thấy có sự nhiễm dộc thai sản
cho tởi tận liều 3 LLLgÍkg/Ligảy (ước tỉnh mủc LLhìễm độc > 2, 3 lần diện tích dưới đuờng cong Ở
bệnh nhân dùng lỉều khuyến cảo hậng ngảy). Ở liều3 mglkg/ngảy, quan sát thắy sự giảm
trỌnU lượng của chuột con trong suốt thời kỳ còn bú mẹ vả sau cai sủa. Khỏng Lhắy có xuất
hiện nhỉễm độc ở lìều lmg/kg/ngảy (ưóc tỉnh mửc nhiẽm độc E 0,9 lẩn diện tĩch dưới đường
cong ở bệnh nhân dùng liều khuyến cảo hảng ngảy).
Khá nãng sinh sán
Cảm cứ vảo cảc kêt quả tiên lâm sảng, khả năng sỉnh sản của cả nam và nữ có thế bị ảnh
hưởng bởi việc điêu trị băng sunitinib (xem Mục 5.3).
Thời kỳ cho con bú
Sunitinib vả | hoặc cảc Chẳt chuyển hóa cua thuốc bảỉ tiết đuợc qua sủa của chu _tcống mẹ.
Chưa rõ sunitinib vả chắt chuyển hóa chính có hoạt tính cùa nó có bải tiết qua sủ 1ng'ỜỈhay
không Vì có nhỉều thuốc thải trù được qua sữa mẹ và vì có tiềm năng cảm phảL pg/có hại
nghỉêm trọng cho trẻ bú mẹ nên người mẹ không nên cho con bú trong thời kỳ mẹ dùng
sunitinib.
Anh hưởng trên khả nãng ]ảỉ xe và vận hânh máy móc
Chưa tỉên hảLLh nghiẽn cứu vê ảnh hưởng của sunitinib tới khả năng lảỉ xe vả vận hảnh máy
móc. Bệnh nhân cân được cảnh bảo lá có thẻ bị chóng mặt trong khi dùng sunitinib.
Tác dụng không mong muôn
Tần số của các tảo dụng không mong muốn (ADR) trình bảy trong mục nảy lả tần số cùa biến
cố xảy ra ở nhũng bệnh nhân điều trị bằng sunitinib không phụ thuộc vảo kết quả đánh giả.
quan hệ nhân quả.
LPD daLe: Aug ỉ9. .7014
Courmer J 'L'elnam
Reference C DS: L~ersmn 37, 0 Iỉẹfereuce CDS dnte; A ng M, 2014
Những tảc đụng không mong muốn quan trọng nhất ở bệnh nhân có khối u đặc iả Lắc mạch
phổi… 0iảm tiều cầu, chảy máu khối u, giảm bạch cầu trung tính có sồL, tảng huyết áp (xem Mục
4.4).
Nhũng tảc dụng khỏng mong muốn thưởng gặp nhắt ở mọi mủc độ bao gồm: Mệt mòi; rối ioạn
tiêu hóa như Liêu chảy, buồn LLôLL vỉêm miệng, khó tiêu, nôn; đổi mảu da; phảt ban, vết ban đỏ
mắt cảm giảc; viêm LLìêLLL mạc ở lòng bản tay Óchân; khô da; đổi mảu tóc; suy nhược; rối Ioạn vị
giảc; chản ăn vả tăng huyết áp. Mệt mỏi, tăng huyết ảp và giảm bạch cẳu trung tính là các tảo
dụng khỏng mong muôn độ J thường gặp nghiêm trọng nhắt vả tănư lỉpase lả tác dụng không
mong muốn độ 4 thường gặp nghiêm trọng nhất ở bệnh nhân có khối u đặc.
C hay máu cam lả tảc dụng không mong muốn về xuất huyết thưòng Lfặp nhắt, đã được bảo cáo
ở khoảng một nứa số bệnh nhân có khối u đặc* bị cảc biến có về xuất huyết (xem Mục 4. 4).
Trong các nghiên cứu iâm sảng với sunitinib, có gặp các cơn co gỉật ở bệnh nhân có bằng chứng
X quang về di căn não. Ngoải ra có một sổ bảo các (<1%) trường hợp xuất hiện cơn co giật và
có chứng cứ X quang về hội chứng viêm não trắng phía sau có phục hồi. trong đó có trường hợp
tử vong (xem Mục 4.4).
Các hiện lượng !Ìmyén lắc huyếĩ khối lĩnh mạch
Trong nghiên cứu mù đôi trên bệnh nhân có khối LL mô đệm đườnư tiêu hóa (GIST) 0 giai đoạn
điểu trị, 7 bệnh LLhảLL (3 %) dùng sunitinib vả không có bệnh nhân đùng giả duợc nảo bị hiện
tượng thuyên lắc huyết khối tĩnh mạch; 5 trong số 7 người bị huyết khối tĩnh mạch sâu độ 3; còn
2 ngưòi thi ở độ [ hoặc 2. Bốn trong số 7 bệnh nhân GIST nảy phải ngùng thuốc sau khi huyềt
khối tĩnh mạch sảu đuợc quan sát lẩn đẩu. Có 13 bệnh nhân (3%) dùng sunitinib để chữa ung
thư biếu mô lế bảo thận lỉến triền vả/ hoặc di cãn (MRCC) chua dung thuốc trước đó, và 4 bệnh
nhân (2%) trong các LLUhiêLL cứu MRCC khảng cytokin đã được bảo cảo gặp cảc hLỆLL tuợng
thuyên tắc huyết khối tLLLlL mạch Có 9 trong sô cảc bệnh nhân đó bị tắc tmh mạch phối,l ngươi
ở độ 2 vả 8 ntfười ở độ 4. Tảm bệnh nhân bị huyết khối tĩnh mạch sâu, trong đỏ 1 nguời ở dộ ],
2 nơười độ 2, 4 người ở độ 3 vả ] nguời ở độ 4. Một bệnh nhân bị tắc mạch phồi trong nghiên
cứu MRCC khảng cnokin phải ngừng dùng thuốc. Với bệnh LLhâLL ung thu bỉếLĩịẬl’lõ tợỗ ảo LILặLL
vả/ hoặc di căn (MRCC) chưa dùng thuốc mà dùng IFN-cx, có gặp 6 (2%) hiên \ưwấthuyẻn tắc
huyết khối tĩnh mạch; ] bệnh nhân (< 1%) 0 độ J của huyết khối Lth mạch sảu"Vả 5 bệnh nhân
(1%) bị tắc mạch phối, tắt cả đều ở độ 4.
Tắc mạch phổi được bảo cáo ở khoảng2 ,2% số bệnh nhân có khối u dặc² đã đùng sunitinib.
Không có ]LỉệLL Lượng nảo khiến bệnh nhân phải ngừng dùng sunitinib, tuy nhiên có phải gỉảm
lỉều hoặc tạm trì hoãn diễu trị trong vải trường hợp. Không có xảy ra tỉếp hiện lượng Lắc mạch
phối ở các bệnh nhân nảy sau khi Liêp tục điều trị trở lại.
Kêt quả từ cảc nghiên cứu Iâm sảng ban đâu, chủ yếu bao gồm bệnh LLhâLL u mô đệm đường
tỉêu hóa vả ung thư bỉẻu mô tê bảo thận khán g cytokin.
7 Ẩ ~ ` v ~a , a \ ì vJ Ả % ^ … A A L
~ Ket qua tư cac nghien cưu lam sang ban đau, chu yeu bao gom bẹnh nhan u mo đẹm đương
tỉêu hóa và ung thư biêu mô Lê bảo thận kháng cytokin.
LPD dam: Ang @, 20H
C oumry: ! ’L'etnam
Rơerenee C 05: verston 37.0 Reference CDS date: Aug 14. 2íJ/J
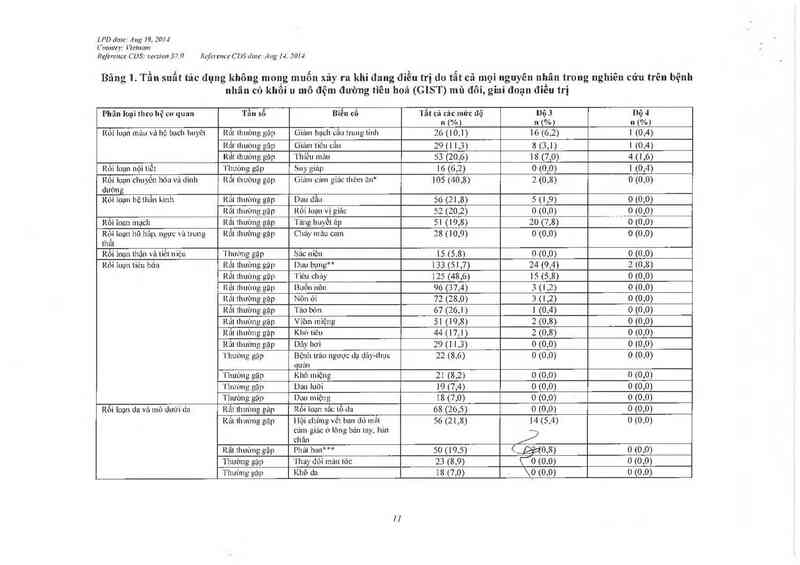
Tần sỏ cùa cảc Lảc dụng không mong muốn xảy ra khi đang điều trị do Lất cả mọi nguyên nhân
được báo cảo ở nhũng bệnh nhân dùng sunitinib trong nghiên cúu đơn trị liệu trên bệnh ung thư
tế bảo thận và LL mô đệm đường tiêu hóa ơiaỉ đoạn tiển triền vả từ các báo cảo hậu mãi được liệt
kê bẽn dưới tcho hệ thốngf cơ quan, tằn sô và độ nặng
Tần số đuợc quy định nhu sau: rắt thường gặp (> 1/10), thưò1Lg gặp .(>1 1/100 tởi
'I`iLuimg gsz Khô da 18 (7,0) \0 (0,0) 0 (0,0)
Ìl
LPD da/e: Ả LLg 19. 2014
C'oLmtly: l~'L'emmn
Refiu-ence C DS: L-ersion 37.0 RỰưrence CI)S Lkươ: Aug 14. 3014
Phân loại t1leo hệ cơ quan 'I'ầLL số lìiễn cỗ 'l'ất cả các mửc dộ l)ộ 3 l)ộ 4
LL 1%) llí°Íu) nt%)
Rôi loạn cơ xuong và mỏ Iiên Rãt LILLrờLLg gặp Dau ờ dâu cảc chi 37 (14,4) 2 (0,8) 0 (0,0)
kết Râl lhường gặp Dau khớp 35 (13,6) 2 (0,8) 0 (0,0)
Thường gạp Da… co 17 (6,6) 0 (0,0) 0 (0,0)
Rối loạn chung tìỂl Linh trạng Lại Rãt Lhường gặp Mệt móí“** 184 (71 ,6) 36 (14,0) 0 (0,0)
nơi sử dụng thuõc Rắt thường gặp mmw… 53 (20,6) 3 {1,2) L (0,4)
Râl thường gập Viêm niêm LLLạc 36 (14,0) 0 (0,0) 0 (0,0)
'I`ILLLL`LLLg gập “I`L'LLLg cnz_vm lipaLse 14 (5,4) 5 (1,9) 5 (l ,9)
'l`hường gặp (ìiLìLLL sò lượng tiêu câu 13 (5,1) 2 (0.8) 1 (0,4)
Chỉ số xẻt nghiệm Ilị1nl(mg gặp (ÌLỈĩÌITI hacmoglohin 17 (6,6) 3 (1,2) 0 (0,0)
ỉhương gặp 1 ăng enzym crcath 15 (5,8) 1 (0,4) 0 (0,0)
phosphokinase trong máu
'I`ILLLL`LLLg gập I’ILãLL suất Lống máu gì£Lm 13 (5,1) 1 (0,4) 0 (0,0)
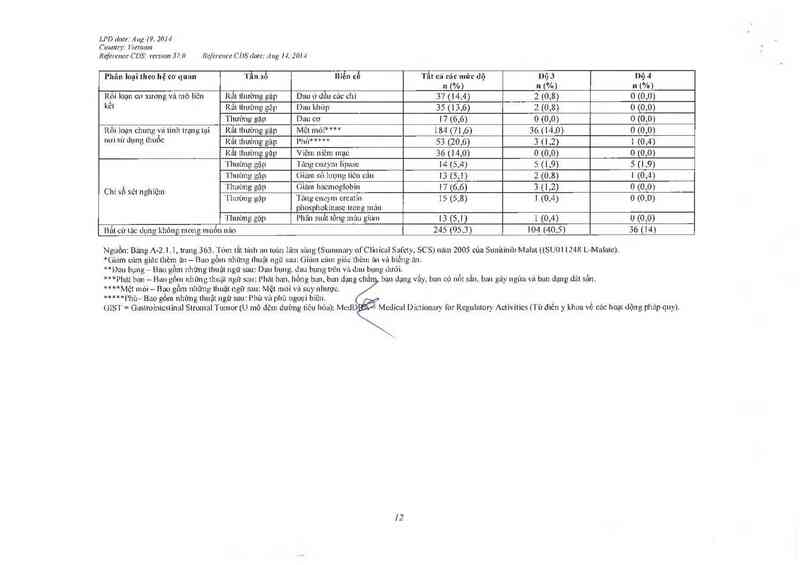
Bắt cứ Lác dụng khỏng mong LLLLLổLL LLL`LO 245 (95,3) 104 (40,5) 36 (14)
Nguồn: Bang A-2. 1 I, lrLLLLg 363.16… lẳt lính Lm mùn lLìLLL sỉLng (Summary ofClỉnical Sach SCS) lLãm 2005 của Sunitinib MLLILLt ((SUOI 1248 L- Malatc).
"Giam cam gìác lhèm ãLL — Bam gổm LLILng lhuâl ngư suu: Giảm câm giấu: thèm L'LLL vả biếng ẩm.
**Đau bụng— Bao gồm nhũng lhuậl ngử sau~ Dau bụng đan hung nên vả dLLLL bung dưới.
***l’hátbzm— Bangnm nhĩnLgL1LuãirLgtmau l’1ìdlbdl'llìổllgbzlll ban dụng
MMMệt mòi - BLLLL gLLLLL những thuật ngư sau: Mệt mói \’Ể\ suy nhược.
M""“Phù— Bao gồm LL1Lng thuật ngữ sau: Phủ và phù ngoại biên.
GIST = GaLeìroỉntcstinal SlromalT LLmor [U mô đệm đưòng Liêu hóa); McdD
12
chắn bau dụng vẳy ban có nm sần ban gây ngửa … ban dạng dái sẩn.
Mcdical Dictionary for chulatory Activitics (Tù diên y khoa về các hoạn dộng pháp quy).
LPD dale: Aug 19. 2014
Coumth I'L'eluum
Refirrence C`DS: remiou 37.0 Reference C DS eiare: Aug |4` 2014
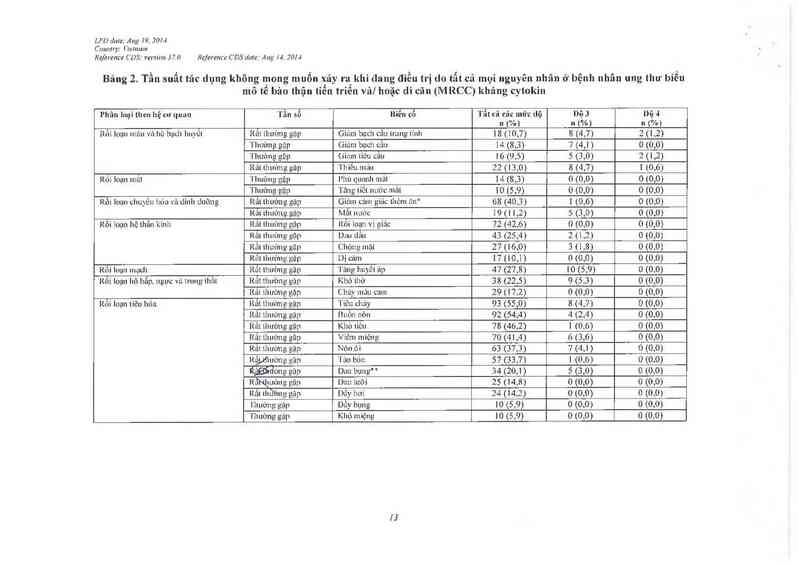
Bảng 2 Tần suất tác dụng không mong muốn xãy ra khi đang điểu trị do tẩt cã mụi nguyên nhân ở bệnh nhân ung thu biểu
mô tế bảo thận tỉến triễn vâl hoặc di cãn (MRCC) kháng cytokin
Phân loại t1Leohệcư quan Tẫn sổ Bỉễn cổ 'l'ẫt cả các mửc Llộ Dộ 3 Dũ 4
n (%) n ["/o) I] {%)
Rối Ioạn mảu vả hệ bụch ILLL_VẺL Rất thường gặp Giúm bạch cẩu lmng Lính 18 (10,7) 8 (4,7) 2 (1,2)
'1`ILường gập GiL'LLLL bạch cầu 14 (8,3) 7 (4,1 ) 0 (0,0)
'l`lLuòng gặp (iiL'LLLL Liêu câu 16 (9,5) 5 (3,0) 2 (1,2)
Rất thường gập '1`11iôu mủu 22 (13,0) 8 (4,7) 1 (0.6)
Rối Ioạn LLLL'ìL 'l`huòng gặp Phủ quanh LLLL'L! 14 (8,3) 0 (0,0) 0 (0,0)
'l`lLường gặp '1`L'LLLg tiết nước mẳl 10 (5,9) 0 (0,0) 0 (0,0)
lẫỗL Ioạn chuyến 1LủzL và dinh dưỡng Rất lhưònggập Giảm czìm giác lhèm ũLL’1 68 (40,3) 1 (0,6) 0 (0,0)
Rât lhuòug gập Mâl nuớc 19 (1 1,2) 5 (3,0) 0 (0,0)
Rối loạn hệ llìầlì kỉnh Râl IILLLL`JLLg gập I(ối 1oạn vị gỉâc 72 (42,6) 0 (0,0) 0 (0,0)
Rễ]! llnrò'ng gập DLIU dân 43 (25,4) 2 (1,2) 0 (0,0)
Rắt LlLường gặp Chóng mặt 27 (16,0) 3 (1,8) 0 (0,0)
RíLL lhưimg gặp Dị củm 17 (10,1) 0 (0,0) 0 (0,0)
Rõi lnụn LLLL_LCIL Rắt thrờLìg gặp 'l`ẽmg huyêt L'Lp 47 (27,8) 10 (5,9) 0 (0,0)
[lòi loạn hô hắp. ngực và LrLLng LILL'LL RẫL thưòug gập Khó thủ 38 (22.5) 9 (5,3) 0 (0,0)
RL'LL thường gập Chảy máu ca… 29 (17,2) 0 (0,0) 0 (0,0)
Rối 1ơạn liêu hỏa Rẫt thường gập ”l`íêu chảy 93 (55,0) 8 (4,7) 0 (0,0)
Rất LL…ng gập Buôn nôn 92 (54,4) 4 mm 0 (0.0)
Rât thường gặp Khó líẻu 78 (46,2) 1 (0.6) 0 (0,0)
Rất Lhườug gặp Viêm miệng 70 (41,4) 6 (3.6) 0 (0,0)
RL'LL llll.rờng gặp Nôn ỏi 63 (37,3) 7 (4,1) 0 (0,0)
Rịuũưòng gặp 'l`ảo bón 57 (33,7) 1 (0,6) 0 (0.0)
Ễịũẵửờng gặp DLLLL bụng“ 34 (20,1 ) 5 (3,0) 0 (0,0)
RầNịLường gặp Dau 1ưỡỉ 25 (14,8) 0 (0,0) 0 (0,0)
Râl những gặp Dây hai 24 (14,2) 0 (0,0) 0 (0,0)
`1`1LLLLLLLg ngLp Đây hụng 10 (5,9) 0 (0,0) 0 (0,0)
Thường gặp Khô miệng 10 (5,9) 0 (0,0) 0 (0,0)
13
LPD dafe: Aug 19. 2014
C'ơLmlry: 1'iemum
Rẹfivrencc CDS: version 37.0 Reference CDS Llute: A ug 14. 201-!
Phân luại then hệ cơ quan 'I'ần số Bỉễn cổ Tất cả cảc mức tlộ Dộ 3 Dộ 4
n(°/o) n(%) n(%)
Rôi loạn da và mô dưới da RắL LlLưỉmg gặp l’hảl haLL*** 60 (35,6) 1 (0,6) 0 (0,0)
Rắt LILLLÒLLg gặp Rõi lL›L_LLL sảc Lô da 55 (32,5) 0 (0,0) 0 (0,0)
Rủi LL…ng gặp Khô da 29 (17,2) 0 (0,0) 0 (0,0)
RẫL IILLLờLLg gặp 'l`hay dôi mẽm lóc 26 (15,4) 0 (0,0) 0 (0,0)
Rất LlLLrờLLg gập Dò da 26 (15,4) 0 (0,0) 0 (0,0)
Rẩl LL…ng gập 1[ội chứng vết ban dò mẫ1 cảm giác Ở L (12,4) 6 (3,6) 0 (0,0)
lòng bản Lay. bỉm chân
Rã] LlLuờng gập Rung Lỏc 17 (10,1) 0 (0,0) 0 (0,0)
Thường gập Mụn I'LƯỞC 15 (8,9) 4 (2,4) 0 (0,0)
'1`ILLrùng gập Viêm da Irỏc vây 10 (5,9) 2 (1,2) 0 (0,0)
Rôi loạn cơ x…mg viL mô Iiên kõL RâL thuờng gập Dau ở đầu các chi 39 (23,1 ) 1 (0,6) 0 (0,0)
RâL Lhưửng gặp Dau cơ 29 (17,2) 1 (I],6) 0 (0,0)
Rôi Ioạn phung và tình lrụng lại chế sử Rất LILLLL`mg gặp Mệt mòí**“ 140 (82,9) 23 (13,6) 0 (0,0)
dụng llLuôc Rz'u Lhưòng gặp Víẻm niêm mạc 30 (17,8) 1 (0,6) 0 (0,0)
Chỉ sô xél nghiệm (N glLiêLL cửu) Rắt thường gập '1”L'Lng cnzym lipLLsc 20 (1 1,8) 15 (8,9) 3 (1,8)
Rã! thường gặp Giám cân 19 (1 1,2] 1 (0,6) 0 (0,0)
`I'lLưừng gập Táng cnz_vm aLLL_vleLsc máu““* 9 (5,3) 6 (3,6) 0 (0,0)
'l`ILLLùLLg gập Tảng bạch căn 10 (5,9) 3 (1,8) 0 (0,0)
']“huừng gập I’ILL'LLL suỉLl Lổng máu bẩl thường 16 (9,5) 1 (0.6) 0 (0,0)
'I`ILLIL`LLLg gặp Giám số1ưm1gliêucằu 13 (7,7) 3 (1 ,8) 2 (1,2)
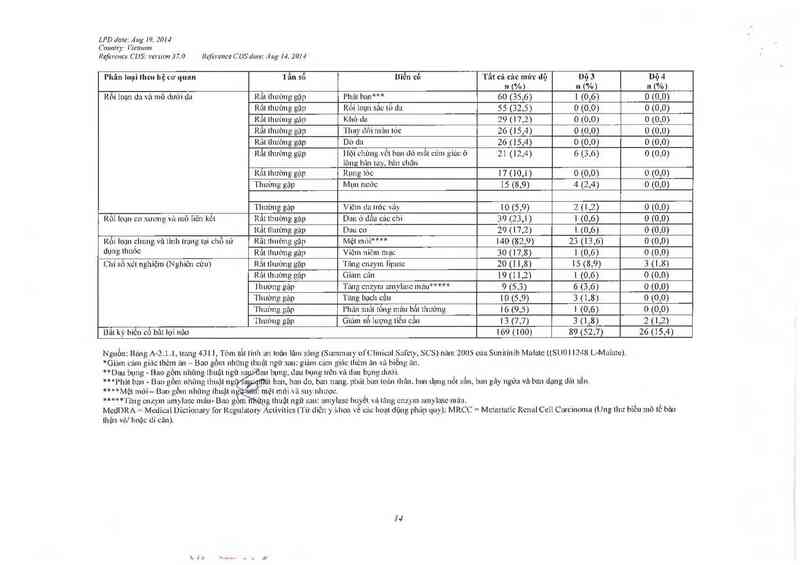
Bẫl kỳ hiểu có bât lợi nảo 169 (100) 89 (52,7) 26 (15,4)
Nguồn; Báng A—2. 1. [ lLaLLgB 4131 ] 1L'LLLL LLLI linh an loản lâm sủng LSLmemV o] Clinichl Safety, SCS) nã… 2005 của Sunilỉníb Malatc {(SUOI 1248 L-MLLILLLe)
*Gizìm cám giác LILòLLL LLLL — Bao gồm nhung Lhuậl ngư sau: gỉLìm cảm giễu: thèm :… vả biềng L’LLL.
“ Dau bụng- Bao gỏm LLhùng thuật ngữ sMLLLL bụng đun bụng Lwẽu vả đau bụng dưới
***l’hảl ban - Ban gòm nhung 111Uịlllìglfẫ L'LL ban, ban dù ban nang. phảL ban LL›L`LLL Lhân ban dạng nm sân, ban gay ngứa vả ban dạng dải sắn.
****Mệl mòi- Bao gồm nhũng LILLLặL ng :Lnệl mỏi va SU) nhược,
*****' l` ủng CI'LZ)'IIL umy'1stc LLLL'LLL- Bao gỏLLLÌILủỊLg llLuật ngũ sau: amylase huyềt VL'L lăng cLLJ.yLLL Lunylasc LLLL'LLL
McdDRA= McdìcLL1 lJícLionary 1`0L Regulatory Activilics ['“1 U diên y khoa x-é các hoa! dộng phảp quvz) MRCC= Mctastatỉc Rcual Cell CarcinomLL (Ung Lhư bỉẻu mô lổ bảo
IILLLLL vả] lLoậc di cĩuL)
14
LI’D LlaIe: .Jltfg l9. 2014
C ouuuy: 1'iemnm
Reference CDS: L'ersipn 3 7.0
Reference C DS date; A ug H. 20] 4
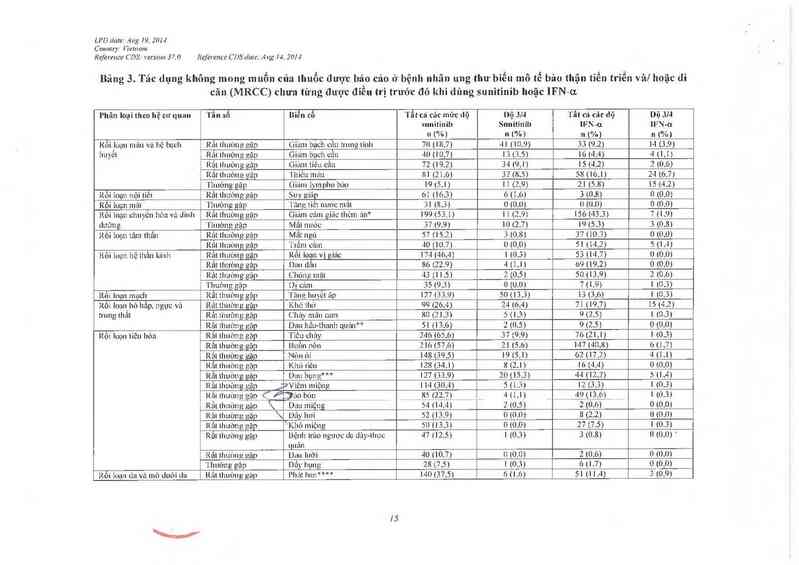
Bâng 3. Tác dụng không mong muốn của thuốc được bảo cảo ở bệnh nhân ung thu' biễu mô tế bâo thận tìễn triển vâf hoặc di
căn (MRCC) chưa từng được điêu trị trước đó khi dùng sunitinib hoặc lFN-ơ.
l’hân loại Lhcn hệ cư quan 'l'ẫn sổ Biển cố 'l`ẩt cá cảc mức Llậ I)ộ JM 'I'ất t"Ả L~âc L1ộ Dộ Jlal
sunitinib Sunitinib llL`N—ũ lFN-a
n (%) n (%) n (%) n (%)
Rối IL›L_LLL LLLL'LLL VL`L hệ bạch Rât LlLườug gặp Giám bạch cằn 11`lll'1glỉllh 711 (18.7) 41 (10.9) 33 (9.2) 14 (3.9)
L…yéL Rảt LL…ng gặp Giám bạch cầu 40 (10.7) 13 (3.5) 16 LsL.LLL 4 (LI)
Rắl LLmng gặp Giá… tiền cằn 72 (19.2) 34 (9.1) IS (4L21 2 (0.6)
Râl thường gặp 'Linéu máu 81 (21.6) 32 {8.5) 58 (16,1) 24 LoL7 )
'l`huởng gặp (ỉìL'Lm lvmphobùn 19 (5.1) 1 1 (2,9) 2] (5.8) 15 (4.2)
Rôi loạn nội LiẽL Rắt thường Ẹập Suy giáp 61 (16.3) 6 (1.6) 3 (0.8) 0 (0.0)
Rõì ỉuạn mãi Thường gặp '1'L'Lan Liẽt LLLLL'LL:LLLLìL 31 (8.3) 0 (0.0) () (11.0) 0 (0.0)
Ròi loạn chuyên hóa và dinh Rắt LILm'LLLg gập GiL'LLLL cảm giảc Lhèm L'…* 199 (511) 1 1 (2,9) 156 (43.3) 7 (1,9)
(1ưõììg 'l`lLuờng gặp Mầl nước 37 (9.9) 10 (2.7) 19 (5.3) 3 (0.8)
Rôi loạn tâm thẩn RâL thường gặp Mât ngủ 57 (15_2) 3 (0.8) 37 (10.3) 0 (1),0)
Rắt tlLuimg gặp '1'rẩm cảLLL 40 (10.7) 0 (0.0) 51 (142) 5 (1.4)
Rối loạn hệ thần kinh Râl Llìưừng gặp Rối loan vi gỉác 174 (46,4) 1 [0.3) 53 (14.7) 0 L0.0)
Rảt lhưòng gặp Dau đẩu 86 (22.9) 4 (1.11 69 (19.2) 0 (0.0)
Rắt thuimg gặp Clu'mg …L_LL 43 (1 l_.5) 2 Lo.sL 50 (13,9) 2 «Lm
'l`hường gặp Dị cảm 35 (9.3) 0 (0.0) 7 (1.9) 1 [0,3)
Rôỉ loạn mạch Rãt Ihuỉmg gập _Timg huyêt áp 127 (333) 511 (13.3) 13 (3,6) | (().3)
Rôi loạLLhỏ lLâp. ngực vả Rất thườmz gặp Khó thở 90 (26.4) 24 (6.4) 71 (193) 15 (4,2)
trung LILL'LL Rắt Lhường gặp (.'ILảy máu cam 80 (21.3) 5 (1.3) 9 (2.5) | (0.3)
Rất llìưỏ'ng gập Dan hẩu-thanh quản** 51 (13.6) 2 ((1.5) 9 (2.5) 0 (0.0)
Rõi Iuạn liêu hỏa Râl llurờng gặp '1`ỉêu chảy 246 {65.6) 37 (9.9) 76 (21.1) 1 L0,3)
Râl Lhuòng gặn Buôn nõn 216 (57,6) 21 (5.6) 147 (40.8) (› (1L7)
RâttlLuừnggìp NL`LLLL'Li 148(395) 19 (5.1) 62 (172) 4 (1.1)
Rắt llLuờng gặp KL… Liêu 128 (34J) x (2.1 ) … H… 0 «Lm
Rẫl thuò'ng gặp DLLLL bụnpf** 127 (33.9) 20 (153) 44 (12L2) 5 (1 A)
Rắt lhuc'mg gập ’7Vìêm miệng | 14 (30,4) 5 (1.3) 12 (3,3) 1 (0.3)
Rất lhưỉmg gặp K ệj'áo bón ss L22.7L >_ 4 (1.1 › _ _ 49 (13.61 _ L Lo.sL
Rắl IILLLùLLg gập \ DL… Lnìệng 54 (14.41) 2 (0.5) 2 (0.6) 0 (OLO)
Rấlthưửnggặp \ Dằyhơi 52 Ll3.9) LL Lom 8 (252—) LL (0.0)
Rât Lhườnggặp \Khô miệng 50 (13.3) 0 (0.0) 27 (7.5) ] (().3)
Râl LhuL'mg gặp lỉộnh lrLìo nguch dL_Ldảy~1hực 47 (12.5) 1 (0.3) 3 (0.8) 0 (0.0) '
quan
Rắt thuimg gặp Đau lưỡi 40 (10.7) 0 (0.0) 2 (0.6) 0 (011)
'I'lluờng gặp Dây hụng 28 (7.5) 1 {0.3} 6 (LT) 0 (0,0)
Rối loạn Lln Vả mô duớì da Râl llLưùng gặp Phát I›LLLL““ 140 (37.5) 6 {1,6) 51 (I IA) 3 (0.9)
l5
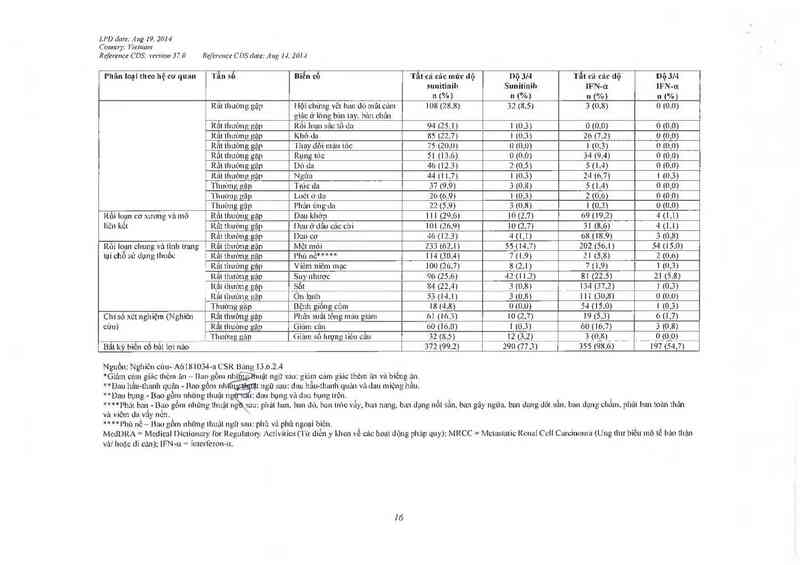
LPD dale: A ug 19. 2014
C omury; l’iemam
Rẹửrznce CDS; verxiou 37.0 Rẹference C DS dafe: Aug H. 2014
Phân lnại theo hệ cơ quan 'I`ần số Biến cố 'I`ẩt cả cảc mửc dộ Độ .314 'l`ất cả các dộ I)ộ 314
sunitinib Sunitinib ]FN-a lFN-u
n (%) n (%) n (%) n (%)
Rã! lhường gặp Hội chửng về! hìLll đỏ mắlcám l08 (28.8) 32 {8.5} 3 (0.8) 0 [0.0)
giác ở lòng bản tay. hỉ… chân
Rắt lhưỉmg gặp Rối lnạn sẳc tố da 94 (25.1) 1 (0.3) 0 (0,0) 0 (0.0)
Râl lhưỉmg gặp Khô da 85 (22.7) ! (0.3) za (7.2) 0 «›,0)
Rắt lhuờng gặp l'llay đôi mảu lỏc 75 (20.0) 0 ((),U) | ([),3) 0 (l).(l}
Rắt thuờng gặp Rụng lóc SI (l3.ủ) [) (0.0) 34 (9.4) 0 [0.0)
Rắt thuờng găp Dò da 46 (12.3) 2 (0.5) 5 (IA) 0 (0.0)
Rã! lhường gập Ngủa 44 (] L7) ! (().3) 24 (657) I (I).3)
Thuimg gập 'l`rúc da 37 (9.9) 3 (0.8) 5 (IA) 0 ([),(l)
'l`huùng gặp Loét ở da 26 (69) | (0.3) 2 (0,6) 0 {0.0}
'l`huờng gặp l’hz'm ứng da 22 (5.9) 3 ((),8) l ([).3) 0 (0.0)
Rối loạn cơ xương vả mô Rắt lhường gặp Dau khởp ! I | (29.6) 10 (2.7) (›9 (l9.2) 4 (],I)
lỉên kể! Rất thường gặp Duu ờdẩu các chi IOI (26.9) 10 (2.7) 31 (8.6) 4 (1.1)
Rắt tlurỉmg gập Dau cơ 46 (12.3) 4 u,1 ) os [18.9) 3 (0,8)
Rôi loạn chung vả lỉnh trạng Rất thường gặp Mệt mỏi 233 (62.1) 55 ( l4.7) 202 (56.l ) 54 (| 5.0)
lại chỗ sử dụng thuốc Râi thường gập Phủ nẻ***“ | M (30,4) 7 ( l.9) 2! (5,8) 2 ((),ô)
Rãt lhường gặp Viêm niêm mạc 101) (26,7) 8 (2.1) 7 (1.9) 1 (0.3)
Râl thường gặp Suynhuợc % (25.6) 42 (] I.2) 8! (22.5) 2] (5,8)
( R_ẩtẶl_lufíỉlẵ gặp Sốt 84 (22,4) 3 ([).8) 134(37,2) 1 (0,3)
Rất lllm'mg gặp ồn lạnh 53 (l4,l) 3 (0,8) ] ] [ (30,8) (] (0,0)
Thường gập Bệnh giông củ… l8 (4.8) 0 (KLO) 54 (IS.O) l ([).3)
Chi sỏ xét nghiệm (Nghiên Rắt thường gặp Phân suất tống máu giùm (11 (I63) I(l (2,7) 19 (5,3) 6 (1,7)
cùu) Rắt lhuờug gặp Giám cân 60 (16.0) | (0,3) 60 [ló. 7) 3 ((LBJ
_ _ Jh_m`ỵg gặm (ìỉzìm số lượng tiêu cân 32 (8.5) l2__(3.2) 3 (0, 8) _ _ _ _ ÊÍQỆÙẬ
Bât ký biên có bât lợi nản 372 (99.2) 290 (77.3) 355 (08 6) l97 (54, 7)
Nguồn. Nghiên củu- AúIBIOS4—zl CSR Bảng 13 .0 .2 .4
BanJ gồm (lhỉtmầhuật ngữ sau: gỉảm cám giản: thèm a'm vù biềng ăn
ậl ngữ sau đau hẫu-thanh qui… vảdau miũng Jhầu.
|:dau hụng vâdau hụng lrên.
*Giảm cảm giác thèm ăn—
**Đau hẩu-lhanh quản- lìao gồm nh
**Đau bụng- Bao gôm nhửng lhuậl ng
**“l’hảl ban- Bao gô… nhũng thuậtngũ sau: phải bam han dó ban lrúc vẳy, bam nang. ban dạng nốt sằn_ ban gây ngứa ban dạng dải sần ban dạng châm, phát ban loản lhân
và viêm da vắv nén
**"I’hù nề— Bau gổm những lhuậl ngũ sau- phù vả phù ngoại biên
McdDRA= Mcdical Diclionzưy l`or Regulalorv Aclívỉlícs( l`ừ đíổn y khoa về cáchoạt dộng pháp quy): MRCC= Mclaslalỉc Renal Cell Czưcinoma (Ung thư biên mô tô bảo thận
vâ/ hoặc di căn); lFN-ot — ĩnlerl`eron—oz
16
LPD dale; A ug 19. 2014
Counny: l'ìemam
Rejèrence (`DS' version 37 0 Refemnce CDS da1e: Aug I 4. .?014
Báo cáo sau khi thuốc lưu hảnh
Cảc ADR phảt hìện sau khi thuốc được lưu hảnh từ tắt cả cảc nguồn (thử nghiệm lâm sảng,
bảo cảo tự phát và cảc nguồn khác) đuợc lìệt kê bên dưói (xem thêm Mục 4 ..4) Vì những
phản ứng nảy đuợc bảo cảo một cảch tụ gíảc tù một quần thể có cỡ mẫu không rõ rảng việc
uớc lượng một cảch đảng tìn cậy tần số hoặc thìết lập mổi quan hệ nhân quả với vìệc dùng
thuốc khỏng phải luôn có thể thực hìện đuợc.
Rốí loạn máu vả hệ bạch huyết
Các truờng hợp bị huyết khối trong mao mạch đã được bảo cáo. Nên tạm thời ngưng dùng
sunitinib; sau khi gỉảỉ quyết biến có xong, có thế đỉều trị tỉếp theo quyết định của bác sĩ đỉều
tri.
Rối Ioạn Iim mạch
Suy tỉm, suy tim sung huyết, suy thẳt trải, khoảng QT kéo dải vả xoắn đỉnh, bệnh cơ tỉm, thỉếu
mảu cục bộ cơ tỉm vả nhòỉ mảu cơ tỉm, trong một sỏ trường hợp gãy tử vong, đã được báo
cảo.
Rối loạn nội tíế!
Cảo trường hợp bị cường giáp một sô dẫn đên suy gỉáp, đã được báo cáo trong cảc thử
nghỉệm lâm sảng vả qua trải nghiệm sau khi thuốc luu hảnlt (xem Mục 4. 4). Cảo trường hợp
bị vỉêm tuyến gỉảp đả đuợc báo cảo
Rối Ioạn tiêu hóa
Vìêm tụy, thủng đường tiêu hóa vả viêm thực quản.
Biến cỏ liẻn quan ẩẻì'i xuỏf huyêt
Cảc trưòug họp bị xuất huyết phối, đuờng tỉêu hóa, khối u, dường tiết niệu vả xuất huyết não,
một sô trường hợp gây tử vong đã được báo cáo ở bệnh nhân đỉêu trị băng sunitinib.
Rối loạn gan mật
Suy gan vả viêm túi mật, đặc bìệt vỉẽm túi mật không do sói.
Rối Ioạn hệ miễn dịch
Phản ứng quả mẫn, bao gồm phù mạch, đã được bảo cáo.
Nhiễm trùng và nhíễm ký sinh Irimg
Cảc truòng hợp bị nhiễm trùng nghìêm trọng (kèm hoặc không kèm giảm bạch cầu trung
tính) trong một số trưởng hợp dẫn tởi kết quả là tử vong, đã đ 's ao cảo. Nhiễm trùng
thuòng gặp nhất trong đỉều trị bằng sunitinib lá các loại nhiễm trùng, n hình ở bệnh nhân
ung thư, ví dụ: nhiễm t1ùng hô hắp (nhu viêm phối, vỉêm phế quản), nhìễm trùng đuòng tiết
nỉêu_ nhỉễm trùng da (như vỉêm tế bảo), sốc do nhíễm trùng/nhiễm trùng máu vả ảp-xe (như
mỉệng, đường sình dục hậu môn, da_ chân tay, nội tạng) Nhìễm trùng có thể do vi khuẩn
hoặc nấm Các tru òng hợp viêm cân mạc hoại tử hiếm gặp, bao gồm viêm cân mạc hoại tù
vùng đáy chậu, đôi khi gãy tử vong, đă đuợc bảo cảo (xem Mục 4.4).
C hí sỏ xét nghiệm (Nghiên cứu)
Tảng TSH (hormon kỉch thích tuyến giáp) vả acid uric trong mảu đã được bảo cáo.
4.9
LPD đale: Aug l9, 201-1
Connny: 1'iemam
Reference C DS: version 3 7 0 Refưlvnce CDS date: Aug 14. 201 J
Rỏí loạn chuyên hóa vò dinh dưỡng
Các tru’Ềmg hợp hội chứng ly giải khối u (TLS), đôi khi gây tử vong, dã được bảo cáo ở bệnh
nhân điêu trị băng sunitinib.
Việc gỉảm glucosẹ huyêt, trong một sô trường hợp có trìệu chứng lâm sảng, đã được bảo cảo
trong quá trình đỉêu trị băng sunitinib.
Rỏi loạn cơ xưowg vả mỏ liẻn kẻ!
Cảc trường hợp bệnh cơ vả/hoặc ly Ơiảì cơ vân kèm hoặc không kèm suy thận cẳp, trong một
số trưòng hợp dẫn tóỉ tử vong, đã đuợc bảo cáo Đa số nhũng bệnh nhân nảy có yêu tô nguy
cơ tù truớc vảfhoặc dang dùnơ thuốc đồng thời có liên quan đến những tảc dụng không mong
muốn nảy. Bệnh nhân có dẳu hiệu hoặc triệu chúng ngộ độc cơ cần được kỉểm soát theo thực
hảnh y tẻ chuẩn.
Các trường hợp hình thảnh lỗ rò, đôi khi liên quan đến hoại tử vả/ hoặc thoải trìến khối u,
trong một sô trường hợp dân tới kêt quả là tử vong, đã được bảo cáo.
Cảo truòng hợp hoại từ xương hảm dã dược bảo cáo ở bệnh nhân điều trị bằnƠ sunitinib đa số
xảy la ở hệnh nhân có yếu tố nguy cơ xác định đối vởỉ hoại từ xương hảm, đặc bìệt lá đã dùng
cảc chất bìsphosphonat IV vải hoặc có tìển sủ bị bệnh nha khoa đòi hòi phải dùng thủ thuật
nha khoa xâm lấn (xem Mục 4.4)
Rỏi Ioạn hệ lha'n kinh
Rôỉ loạn vị gìác, bao gôm mât vị gỉảc, đã dược bảo cáo.
Rỏi loạn zhặn vờ liếl niệu
Cảo truờng hợp bị yếu và suy thận, trong một số trường hợp dẫn tởỉ kết quả [ả tử vong, đă
được báo cảo. ’l`rường hợp bị protein nìệu và hội chứng thận hư đã được báo ca'o (xem
Muc 4.4)
Róỉ loạn hô hầp, ngực vả nwzg thẩl
Thuyên tăc mạch phồi, trong một sô trường hợp dẫn tới kêt quả lả từ vong, đã được bảo cảo.
Rồi Ioạn da vả mỏ dưới da
Cảc trường hợp vỉêm da hoại thư sinh mù, hông ban đa đạng và hội chứng Stevens—Johnson
đã dược bảo cảo.
Róỉ Ioạn mạch
Cảc trường họp bìến cố thuyên tắc huyết khối động mạch đôi khi gãy tù v ìg, đã được báo
cảo ở bệnh nhân điều trị bằng sunitinib. Bỉến cố th ường gặp nhắt bao gổồu ưb’lến mạch mảu
não, cơn thìếu mảu cục bộ thoáng qua vả nhồi mảu năo Yếu tố nưuy cơ lì quan đến thuyên
tắc huyết khối động mạch ngoải bệnh ac tính sẵn có vả dộ tuổi 2 65, còn có tãng huyết ap, đảỉ
thảo đuờng vả có tiền sử mắc bệnh thuyên tắc huyết khối.
Quá ]ỉều
Chua có thuôc gìải độc đặc hiệu khi quá liêu sunitinib và điêu trị quả lỉêu nên dụ'a vảo cảc
biện phảp hô trợ chung. Khi có chỉ định, cân thải lượng thuôc chưa hâp thu băng cảch gây nỏn
LPD dcưe: Aug 19. 2014
Coumay; í’ư'emam
Rẹference (`DS: verwm 3 7. o Reference CDS dam.- .4 ug 141. 2014
hoặc rửa dạ dây Các truờng hợp quá liều dã đuợc bảo cảo một số truờng hợp liên quan đến
các tảc dưng khônU mong muôn phù hợp vởi đặc tính an toản đã đuợc bỉết cùa sunitinib.
CÁC ĐẶC TÍNH DƯỢC LÝ HỌC
Các đặc tính dược lực học
Sunitinib ức chế nhiều thụ thể tyrosin kỉnase (RTKS) liên quan tới sự phảt triển của khối u, sự
tân tạo mạch mảu vả sự tỉến triên cùa ung thư. Sunitinib ức chế được các thụ thế yếu tố tăng
truờng có nguồn gốc tỉều cẳu (PDGFR a vả PDGFR [3), cảc thụ thế yếu tố tăng trưởng cùa nội
mô mạch máu (VEGFRI, VEGFR2 vả VEGFRS), thụ thế yếu tố thân tế bảo (KIT), tyzosin
kinase — 3 gỉống Fms (FLT 3), thụ thể loại ] của yếu tố kỉch thích cụm tế bảo (CSF-l R) vả
thụ thế yếu tố dinh dưỡng thần kỉnh dẫn xuất từ dòng tế bảo sao (RET). Sự ức chế cùa
sunitinib tới hoạt tính của cảc RTK đã được chứng mỉnh bằng cảc thử nghiệm về tế bảo học
vả hỏa sỉnh học, còn sụ úc chế về chức năng đã được chứng minh trong cảc thủ nuhỉệm tăng
sinh tế bảo Chất chuyền hóa chính cùa sunitinib cũng có hoạt tính tuơng tụ so vói chắt mẹ
sunitinib trong cảc thử nưhiệm về tế bản học và hóa sinh học.
Sunitinib úc chế sự phọsphoryl hóa của cảc thụ thể RTK (PDGFR B, VEGFR2, KIT) trong
cảc khối u cắy ghép bỉều hiện RTK ín vivo vả đuợc chủng minh có ức chế sụ phát triền của
khối u hoặc Iảm thoải trìển khối u vả/hoặc ủc chế được di căn trong một số mô hình thục
nghiệm về ung thư. Sunitinib dược chửng minh có khả năng ức chế sự phảt triển của cảc tế
bảo u biền lộ sự rối loạn điều hòa mục tiêu RTK (PDGFR, RET hoặc Kl'l`) in vilro vả ửc chế
được sự tân tạo mạch khối u phụ thuộc PDGFR |3 vả VEGFR 2 in vỉvo.
Cảc nghiên cứu Iâm sảng
Độ an toản vả hỉệu quả điểu trị trên Iâm sảng của sunitinib dã được nghiên cứu trên bệnh nhân
có khối u mô đệm dường tiêu hóa ảc tính đã kháng với imatinib (tức lả cảc bệnh nhân đã gặp
bệnh tìến triến trong và sau khi dùng imatinib) hoặc không dung nạp vởi imatinib (tức lả cảc
bệnh nhãn gặp độc tính rõ rảng trong khi dùng imatinib trước khi dùng thuốc khảo); và ở bệnh
nhân có ung thu’ biểu mô tế bảo thận tiến triền vả/ hoặc di cảu (M RCC).
Hiệu quả của sunitinib căn cứ vảo thời gian tới khi khối u tỉến triền (TTP - tìme to tumor
progression) và sự tăng tỷ lệ sông sỏt trong trường họp u mô đệm đườnư tìêu hóa (GIST).
Hiệu quả cùa sunitinib cũng dụa vảo thời gian sống không bệnh tỉến triểt _S- -proưressỉon-
írce survival) vả vảo cảc tỷ lệ đáp ứng khách quan (ORR- objective resụohbe’rates), tuơng
ứng trong truờng hợp ung thu biểu mô tế bảo thận vả/ hoặc di căn (MRCC) chưa đỉều trị và
kháng cytokin.
U mó đệm đưòng liêu hóa (GIST)
Một nghiên cứu nhãn mở ban đầu có tãng dần liều dùng đã được tiến hảnh với bệnh nhân bị u
mỏ đệm đuờng tỉêu hóa sau khi thắt bại vởì imatinib (lỉều tối đa mỗi ngảy tính trung binh là
800 mg) do để khảng hoặc không dung nạp. Có 97 bệnh nhân tham gia dùng các liều vả thời
gian biểu khác nhau: 55 bệnh nhân dùng 50 mg trong thời gian biều đỉều trị khưyển cáo là 4
tuần dùng thuốc/ 2 tuần ngùng thuốc ( "thời gian bỉều 412 ’). Trong nghiên cứu nảy,t thời gian
tởi khi khối u tỉến trỉến vả thời gìan sống khỏng bệnh tiến tríền trung binh là 34 ,0 tuần lễ
(khoảng tỉn cậy ò mức 95% lả 22,0— 46,0 tuần).
LPD datr Aug 19. 201-l
Country. l'remnm
Reference C DS: rersmn 3 7, 0 Reference CDS dam: Aug 1 4. 2014
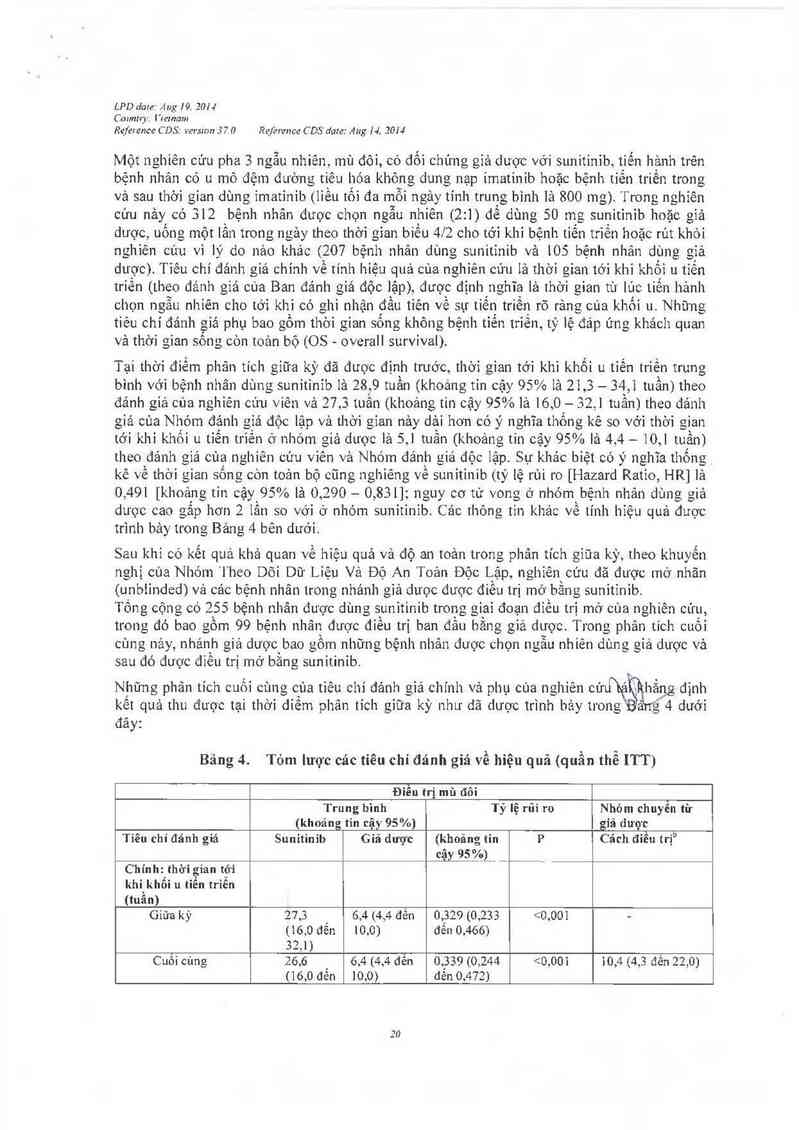
Một nghiên cứu pha 3 ngẫu nhiên, mù đỏỉ, có dối chứng giả dược vởi sunitinib, tiến hảnh trên
bệnh nhân có u mô đệm đường tiêu hóa không dung nạp imatinib hoặc bệnh tiến triển trong
và sau thời gian dùng imatinib (liều tối đa mỗi ngảy tỉnh trung bình là 800 mg) Irong nghỉẽn
cúu nảy có 312 bệnh nhân đuợc chọu ngẫu nhỉên (2:1) đề Ộdùng 50 mg sur_1itỉnib hoặc gìả
duợc, uống một lần trong ngảy theo thời gian biều 4/2 cho tởi khi bệnh tiến triền hoặc rút khỏi
nghiên cúu vì lý do nảo khác (207 bệnh nhãn dùng sunitinib vả 105 bệnh nhân dùng giả
duợc). Tiêu chí đánh giá chinh về tính hiệu quả cùa nghỉên cún là thời gian tới khi khối u tĩến
triên (theo đánh gìá của Ban đảnh giá độc lập), được định nghĩa là thởi gỉan tù Iủc tiến hảnh
chọn ngẫu nhiên cho tởi khi có ghi nhận đầu tiên về sụ tiển triến rõ rảng của khối u. Nhũng
tiêu chí đánh giá phụ bao gồm thời gian sống không bệnh tiến trỉền, tỷ lệ đáp úng khách quan
và thời gian sống còn toản bộ (OS- overall survival)
Tại thời đìểm phân tích gỉũa kỳ đã đưọc định truớc, thời gỉan tới khi khối u tỉến triển trưng
bình với bệnh nhân dùng sunitinib là 28, 9 tuần (khoảng tin cặy 95% lá 21,3 — 34,1 tuân) theo
đảnh giả của nghiên cúu viên và 27,3 tuần (`khoảng tin cậy 95% lá 16,0 — 32,1 tuầit) theo đảnh
giả của Nhóm đảnh gỉá độc lập vả thời gỉan nảy dải hơn có ý nghĩa thống kê so vởi thời gian
tởi khỉ khối u tìến tlỈềh ở nhỏm giả dưọc là 5, ] tuần (khoảng tin cậy 95% là 4, 4 — 10,1 tu_ần)
theo đánh gìả cùa nghiên cúu viên và Nhóm đánh giá độc lập. Sụ khảo biệt có ý nghĩa thống
kê về thời gian sống còn toản bộ cũng nghiêng về sunitinib (tỷ iệ rùi ro [Hazard Ratio, HR] là
0 ,49I [khoang tin cậy_ 95% lá 0,290—0,831]111guy cơ tử vong ờ nhóm bệnh nhân dùng giả
duọc cao gâp hơn 2 Iẳn so vởỉ ở nhóm sunitinib. Cảo thông tin khác về tính hiệu quả đuợc
trình bảy trong Bảng 4 bên dưới.
Sau khi có kềt quả khả quan về hiệu quả vả độ an toản trong phân tích giũa kỳ, theo khuyến
nghị cùa Nhóm lheo Dõi Dữ Liệu Vả Độ An Toản Độc Lập. nghỉên cứu đã đuợc mở nhăn
(unbiinded) và các bệnh nhân trong nhánh giả dưọc được điều trị mở bằng sunitinib.
Tống cộng có 255 bệnh nhân đuợc dùng sunitinib troụg giai đoạn điều trị mở cúa nghiên củu,
trong đó bao gồm 99 bệnh nhân đuợc điều trị ban đầu bằng,, OÌả duọc Tmng phân tich cuối
cùng nảy, nhánh giả duợc bao gồm những bệnh nhảm đuợc chọn ngẫu nhiên dùng gỉả duợc và
sau đó đuợc đìều trị mở bằng sunitinib.
Nhũng phân tich cuối cùng của tiêu chí đảnh giá chính và phụ cùa nghiên củđẦạ àhẳng định
kết quả thu đuợc tại thời đỉểm phân tich gỉũa kỳ như dã duợc trình bảy uong g4 dưới
đãy:
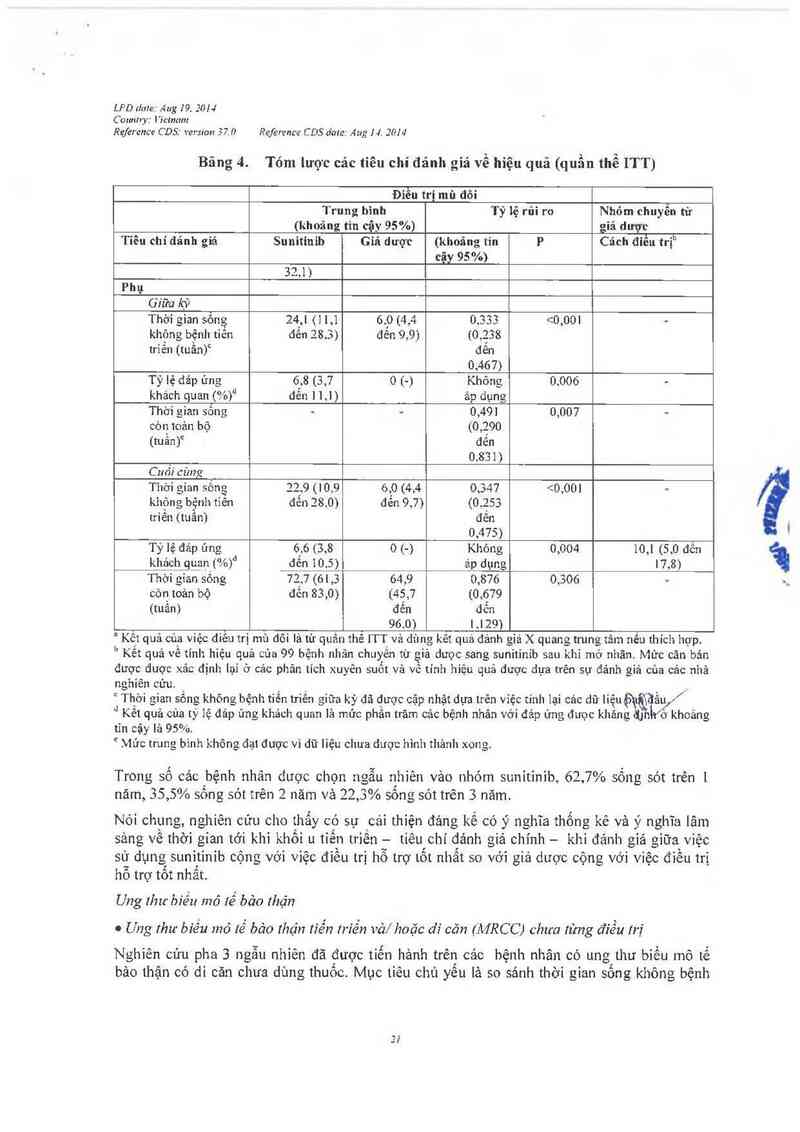
Băng 4. Tóm lược các tiêu chí đánh giá về hiệu quả (quẩn thể ITT)
Đỉêu trị mù đôi
Trung bình Tỷ lệ rủi ro Nhóm chuyên từ
(khoảng tin cậy 95%) gỉả dược
Tiêu chí đánh gỉả Sunitinib Giã dược (khoăng tín P Cách điêu trịb
cậy 95 %)… _ ,
Chính: thời gian tới
khi khổi 11 tiểu triễn
(tuần)
Gíữa kỳ 27,3 6,4 (4,4 đến 0,329 t0.233 <0,001 …
(16,0 đến mm đến 0,466)
32,1)
Cuối cùng 26,6 6,4 (4,4 đén 0,339 (0,244 <0,001 10,4 (4,3 đên 22,0)
(16,0 đến 10,0) đến 0,472)
LPD time: Áng 19. 201-J
Connhy: l'ictnum
Rejỉzrence CDS: version 37. () Reference C DS date: Ang 1 4. 2014
Bãng 4. Tóm lược cảc tiêu chí đánh giá về hiệu quả (quần thể ITT)
Điêu trị mù đôi
Trung bình Tỷ lệ rủi ro Nhóm chuyên tù~
(khoăng tin cậy 95%) giả dược
Tiêu chí đánh gìả Sunitinib Giả dược (khoâng tin p Cách điều trịb
cậy 95%)
32,1)
Phụ
Giữa kỳ
Thời gỉan sông 24,1 (11,1 6.0 (4,4 0,333 <0,001 —
không bệnh tiền đến 28.3) đến 9,9) ((),238
trĩển (tuần)° đến
0,467)
Tỷ lệ dáp ứng 6,8 (3,7 0 (…) Khỏng 0.006 -
khách quan (%)d dển ] ],l) áp dụng
Thời gian sõng — - 0,491 0,007 -
còn toản bộ (0,290
(tuân)c đến
0,831)
Cuối cùng
Thời gian sỏng 2229 (10,9 6,0 (4,4 0,347 <0,001 —
khộng bệnh tỉẻn đẽn 28.0) đẻn 9,7) (0,253
triẽn (tuân) đên
0,475)
Tỷ lệ đáp ứng 6,6 (3,8 0 (-) Không 0,004 10,1 (5,0 đến
khách gưalj (%)d đến 10.5) ảp dụng l7,8)
Thời gỉan sống 727 (6 I ,3 64,9 0,876 0,306 -
còn toản bộ đến 83,0) (45,7 (0,679
(tuần) đến dến
96,0) l,129)
° Kêt quả cùa việc diêu trị mù đôi là từ quân thẻ ITT vả dùng kêt quả đánh giá X quang trung tâm nêu thích hợp.
b Kết quả về tính hiệu quả của 99 bệnh nhân chuyên từ giá dược sang sunitinib sau khi mở nhãn. Mức cản bản
được dược xảo định lại ở cảc phân tich xuyên suốt vả về tính hỉệu quả được dựa trẻn sự đảnh giả cùa cảc nhả
nghiên cứu.
c Thời gian sống không bệnh tỉến triên giữa kỳ dã được cập nhặt dựa trên việc tính lại cảc dữ liệuỡạ Hầu/
d Kêt quả của tỷ iệ đảp ứng khảch quan lả mức phân trăm cảc bệnh nhân vởi đảp ứng đưọc khăng (()lth’ố' khoảng
tĩn cậy iâ 95%.
² Mức trung binh không đạt được vì dữ lỉệu chưa được hình thânh xong.
Trong sô cảc bệnh nhân được chọn ngẫu nhiên vảo nhóm sunitinib, 62,7% sông sót trên 1
năm, 35,5% sông sót trên 2 năm vả 22,3% sông sót trên 3 năm.
Nói chung, nghiên cửu cho thây có sự cải thỉện đáng kể có ý nghĩa thông kê và ý nghĩa lâm
sảng vê thời gian tới khi khôi u tiên triên — tiêu chí đảnh giả chính — khi đánh giá giữa việc
sử dụng sunitinib cộng với việc điêu trị hô trợ tôt nhât so vởi giả dược cộng vởi việc điêu trị
hô trợ tôt nhât.
Ung Ihư biêu mỏ lê bảo Ihận
o Ung thư biêu mỏ Iế bảo thận tiển rriển vả/ hoặc di cãn (MRCC) chưa fừng điểu Irị
Nghiên cửu pha 3 ngẫu nhỉên đã được tiễn hảnh trên cảc bệnh nhân có ung thư bỉếu mô tế
bảo thận có di cản chưa dùng thuôo. Mục tiêu chủ yêu lả so sảnh thời gian sông không bệnh
.-J`-
LPD dam: Ath 19. 2014
Counny; l’t'elnam
Reference CDS: rersmn 3 7, 0 Refiznence CDS dam: Aug 14. 2014
tìến triến 01 bệnh nhân dùnƠ sunitinib so với bệnh nhân dùng IFN-a Cảc tiêu chí đảnh giả
phụ bao gổm thời gian tói khi khối u tiến triển, tỷ lệ đáp ứng khảch quan, thời gian sống còn
toản bộ, sự an toản và kết quả do bệnh nhân bảo cảo (PRO). Có tất cả 750 bệnh nhân đuợc
chọn ngẫu nhiên (111) dễ dùng 50 mg sunitinib mỗi ngảy một lần theo thời gian biếu 412 hoặc
tiêm duớì da IFN-a mỗi lẳn 9 MIU, mỗi tuần 3 lằn. Bệnh nhân đuợc điều trị cho đến khi bệnh
tiến triển hoặc ngùng nghỉên củu vi lý do khảo.
Quần thể ITT bao gồm 750 bệnh 11hân, trong đó có 375 nguời chọn ngẫu nhiên để dùng
sunitinib vả 375 người chọn ngẫu 11hỉên để dùng lFN-ơ Cảc tiêu chí ban đầu nhu tuối, giởi,
chùng tộc vả thể trạng bệnh nhân theo Nhóm Hợp tảc ung thu học miền Đông (Eastern
Cooperatỉve Oncoioơ y Group ECOG) iả tương đuong và cân bằng giũa cảc nhóm sunitinib
vả lFN-u. Các đặc tính của bệnh nhân vả nhân chủng học duợc trình bảy ở Bảng 5 Nhũng vị
trí thường gặp nhất về di cãn khi sảng lọc cho tới nay lả phối (78% ở sunitinib so với ở IFN- -0.
iả 80%), sau đó lả hạch bạch h_uyết (58% so với 53 % tuơng úng), xương (30% ở mỗi nhóm)
Phần 1011 số bệnh nhân có nhiều vị trí di căn (> 2 vị trí) khi đảnh giả ban đầu (80% so với
77%)
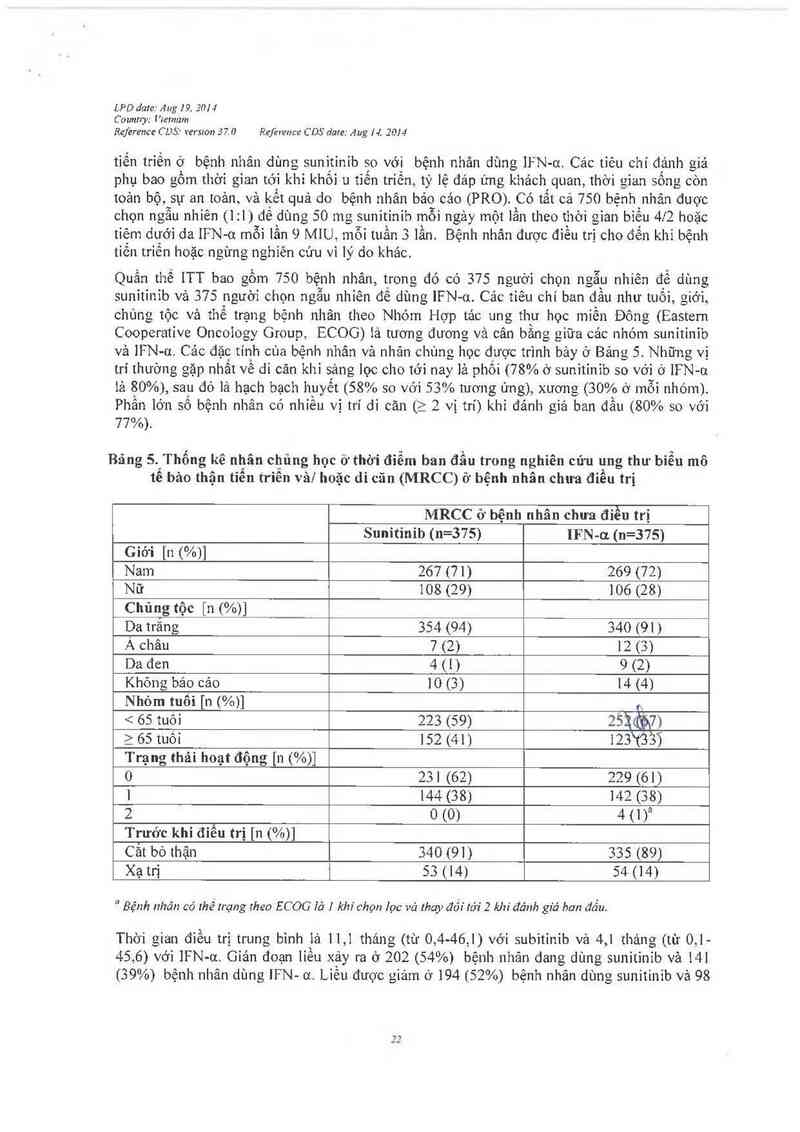
Bảng 5. Thống kê nhân chủng học ỏ thời điểm ban đầu trong nghiên cúu ung thu biễu mô
tế bảo thận tiểu triền vải hoặc di cãn (MRCC) ở bệnh nhân chua điểu trị
MRCC ở bệnh nhân chưa điều trị
Sunitinib (n=375) IFN-ơ. (n=375)
Giới [n (%)]
Nam 267 (71) 269 (72)
Nữ 108 (29) 106 (28)
Chủng tộc [n (%)]
Da trẩhg 354 ('94) 340 (91)
Á châu 7 (2) 12 (3)
Da đcn 4(1) 9 (2)
Khỏng bảo cảo 10 (3) 14 (4)
Nhóm tuốỉ [n (%)] ,
< 65 tuôỉ 223 (59) 2'5ỉủ7)
ì65 tuốỉ 152 (41) 123%3'3)
Trạng thải hoạt động [11 (%)]
0 231 (62) 229 (61)
1 144 (38) 142 (38)
2 0 (0) 4 (1)21
Trước khi điều trị [11 (%)]
Cắt bỏ thận 340 (91) 335 (89)
Xạ trị 53 (14) 54 (14)
“ Bệnh nhân có thẻ lrạng theo ECOG lở ] khi chọn lọr: và thay đỡí tới 2 khi đánh giá ban đồu.
Thòi gian điều trị trung bình iả 11,1 thảng (tù 0, 4- 46 1) vói subitinib và 4,1 tháng (tù 0,1-
45. 6) với IFN- -01. Giản đoạn iiều xảy ra ở 202 (54%) bệnh nhân dang dùng sunitinib vả 141
(39%) bệnh nhân dùng IFN- 0t. Liều đượJc giảm ở 194 (52%) bệnh nhãn dùng sunitinib vả 98
LPD đam. .4 ug 19, 201-1
Counny: I'iemnm
Rẹlèrence C DS: renfon 3 7.0 Reference CDS dme. Aug I J. 2014
(27%) bệnh nhân dùnU IFN- 01 Tỷ lệ ngung thuốc do tảo dụng khỏng mong muốn là 20% cho
sunitinib và 23% cho IFN- u. Cảc bệnh nhân đuợc điều trị cho dến khi bệnh tỉến triển hay rút
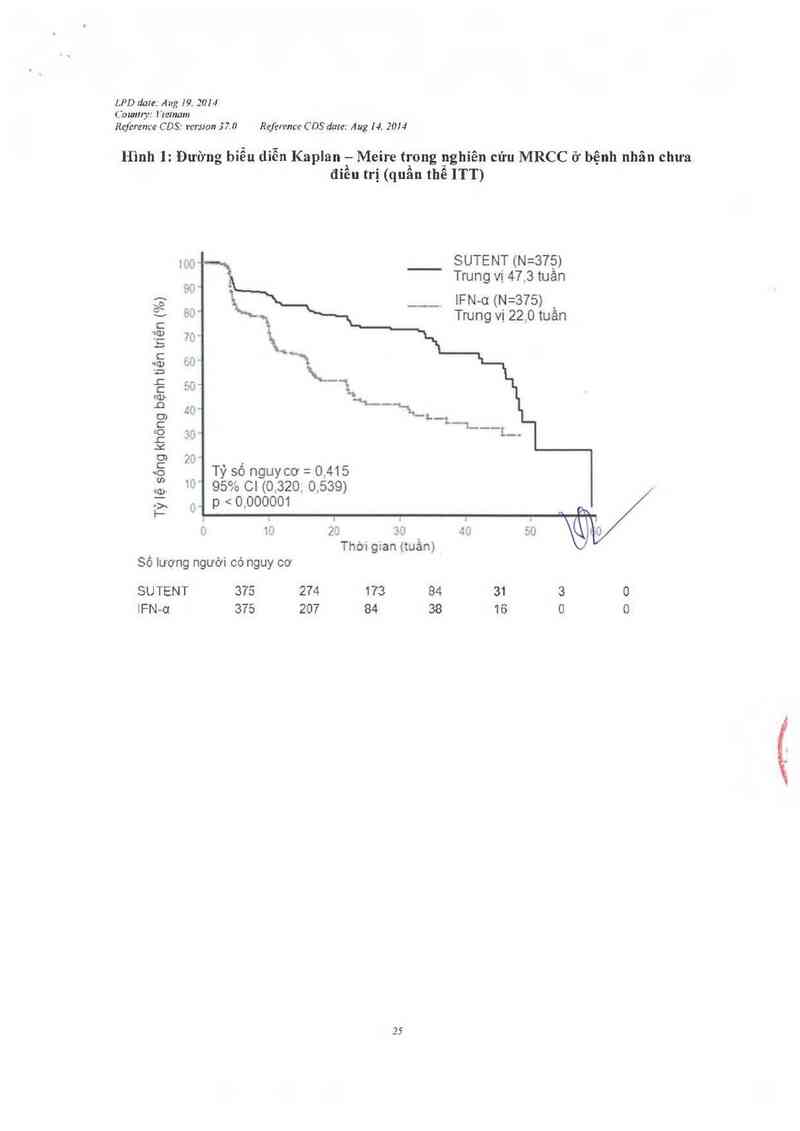
khỏi nUhỉên cún Tiêu chí đảnh giả chính về tính hiệu quả là thòi gian sống không bệnh tiểu
triển. Một phản tích gỉủa kỳ theo kế hoạch định truớc đã cho thây sunitinib cải thỉện có ý
nghĩa thống kê so với lFN-u dựa trên tìẽu chỉ đảnh gíá chính là thời gỉan sống không bệnh
tiên trìển, vởi thời gỉan sống không bệnh tiến triển, cao hơn gắp 2 lằn so với lFN-ơ (tương ửng
47,3 tuần so vởi 22, 0 tuần) Đối với tiêu chí đảnh uỉá phụ về tỷ lệ đảp úng khách quan,
sunitinib cao gấp 4 lần so vởỉ lFN-ơ (tương úng 27,5% so vởi 5 ,3%). Cảc dũ iiệu chưa đầy đủ
để xảo định lọi ích cùa thởi gian sỏng còn toản bộ; trong thời gian phân t1'ch gíữa kỳ, có
374/750 số bệnh nhân (tức 50%) tiếp tục tham gia nghiên cúu, trong đó 248 trong sô 375
(66%) ở nhóm sunitinib vả 126 trong sô 375 (34%) thuộc nhóm IFN—ơ
Tại thời điếm phân tĩch cuối cùng có lợi điếm đảng kế có ý nghĩa thống kê cho sunitinib so
với IFN- -01 dụa trên tiêu chí đánh gìả là thời gian sống không bệnh tỉến triển (xem Bảng 6 và
1). Trong cảc yếu tố để phân tầng bệnh nhân đã định trước: enzym Iactat dehydrogenase
(LDH) (>1, 5 gỉới hạn tối đa cùa mức bình thuờng (ULN) so Vói 51,5 ULN), trạng thải hoạt
động ECOG (0 so với 1), và việc cắt bỏ thận trưởc đỏ (có so với không), tỳ sỏ nguy cơ
nghiêng về sunitinib hơn lả IFN-ơ. Việc đảnh giá chính bằng X quang được ngưng sau khi
tiêu chí đảnh giả chỉnh đạt được . Tỷ lệ đảp ứng khảch quan được đảnh gỉả bởi người nghỉên
cứu lả 46% (khoảng tin cậy 95%: 41, 51) cho nhóm sunitinib vả 12% (khoảng tin cậy 95%: 9,
16) cho nhóm IFN-ơ. [p3 ayểu tố nguy cơ, thì thời gian sống không
tỉến triển trung bình là 12,1 tuần ở nhóm sunitinib và S ,7 tuân ở nhóm IFN- -u (ty sỏ nguy cơ
0,679; khoảng tin cậy 95% [0,3 30— ] ,3981).
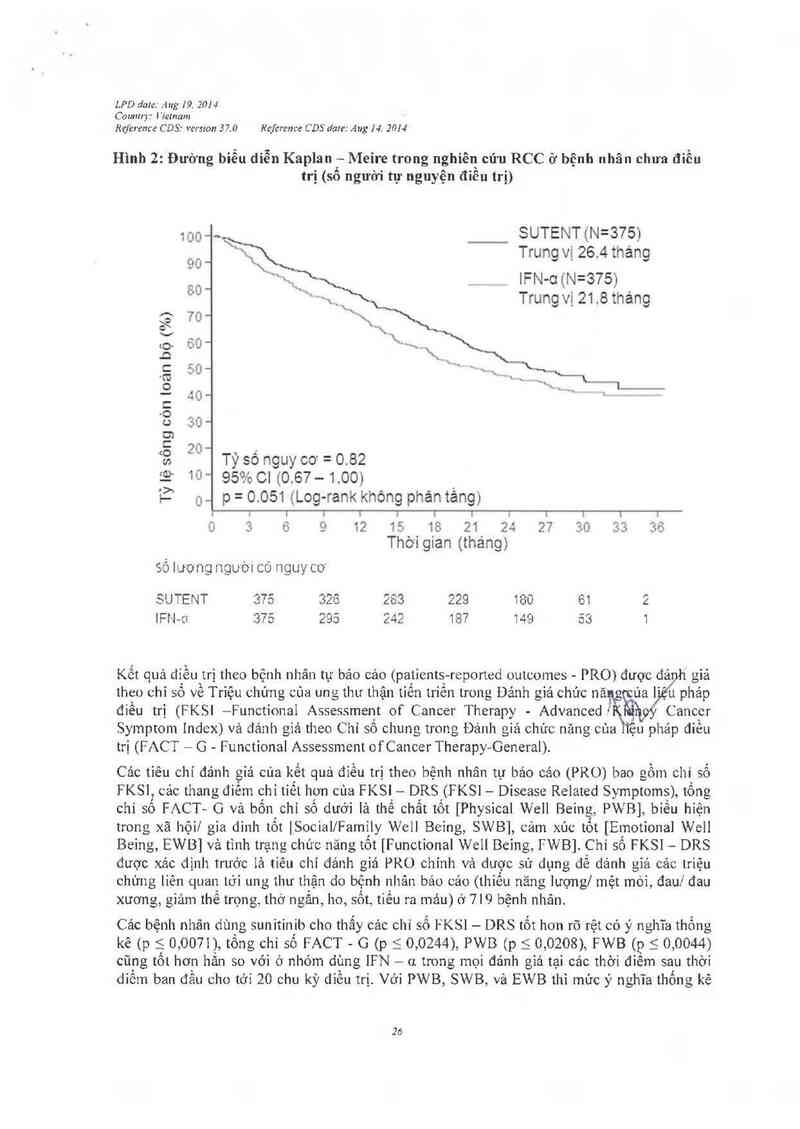
Như trinh bảy trong Hình 2, việc điều trị bằng sunitinib liên quan tới việc sống 5 hqn so
vởi IFN- -01 Thời gian sống còn toản bộ trung binh lả 1 14 6 tuần cho nhóm suriitcixĩiv1u oảng
tìn cậy 95%: 100,1 142,9) vả 94,9 tuần cho nhóm IFN-ơ (khoảng tin cậy 95%: 77,7 117 0) [tỷ
số nguy cơ 0, 82], khoảng tin cậy 95%: 0,673-1,001;p= 0,0510 bằng thử nghiệm log—rank, p=
0,013 bằng thử nghiệm Wilcoxonì. Trong phân tích phân tầng (LDH > 50 vởỉ 51,5 x giởi hạn
tối đa cùa múc bình thuờng (UI N), trạng thái hoạt động theo phân loại ECOG lả 0 so với >1,
và có hay không cắt bỏ thận truớc đó), tỷ số nguy cơ 1ả 0,818 (khoảng tin cậy 95%: 0 ,669-
0,999; p=0,049 theo kiềm định iog- rank). Thời gian sống còn toản bộ trung bình tính cho
nhóm IFN-u tính cho cả 25 bệnh nhân đã ngưng điều trị bằng lFN—ơ. vì bệnh tiểu triển và
chuyến qua đìều trị bằng sunitinib. Sau khi rút khỏi nghỉên cúu 213 bệnh nhân trong nhóm
lFN- -u đuợc tiếp tục điều trị unU thư, tronư đó 32% bệnh nhân dùng sunitinib; 182 bệnh nhân
trong nhóm sunitinib được tiếp tục điều trị ung thu sau nghiên củu, trong dó 11% dùng
sunitinib Trong các phân tích dựa theo dữ liệu kiếm tra cảc bệnh nhân đã chuyền từ điều trị
bằng IFN-ơ sang điếu trị bằng sunitinib, thời gịan sống còn toản bộ trung bình tại thời đìếm
chuyền đỉều trị lả 114,6 so vởi 86,7 tuần (tỷ số nguy cơ không phân tầng: 0,808; p=0,0361
LPD date: Aug 1 9. 2014
C ounny— l'iemam
Rẹference CDS: version 3 7,0 RỰerence C DS dare: Aug 14. 2014
theo kiếm định log—rank, p= 0,0081 theo kiếm định Wỉicoxon). Khỉ loại trừ các bệnh nhân đã
điều trị ung thu sau nghiên cứu, tỷ lệ sống còn toản bộ trung bình là 121,9 so vói 61,3 tuần
trên sunitinib so với lFN—u (tỷ sô nguy cơ: 0, 647; khoảng tỉn cậy 95%: 0, 482- 0,;867 p=
0 0033 bằng thủ nghiệm log-rank; p= —0 ,0013 bằng thử nghiệm Wiicoxon)
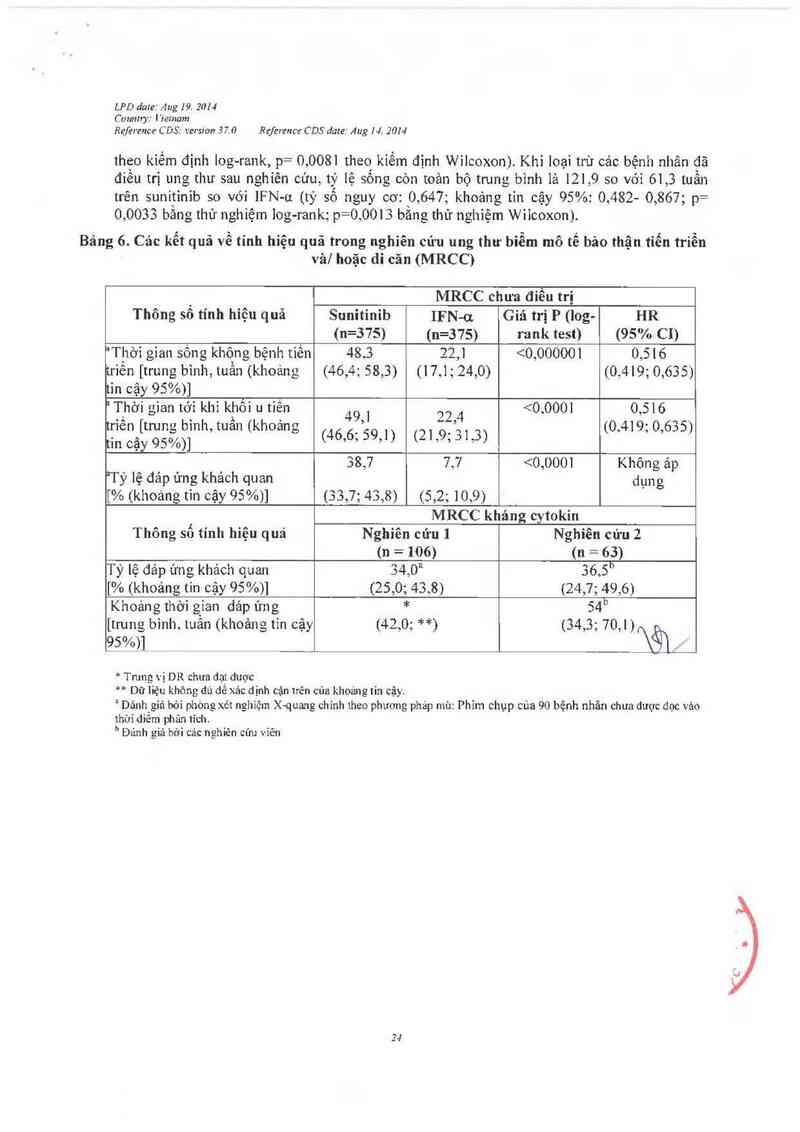
Bảng 6. Cảc kểt quả về tính hỉệu quả trong nghỉên cứu ung thư bỉễm mô tế bảo thận tiến triễn
vả/ hoặc di cãn (MRCC)
MRCC chưa điều trị
Thông số tính hiệu quả Sunitinib IFN-on Giá trị P (log- HR
(n=375) (u=375) rank test) (95% CI)
'Thờỉ gian sông không bệnh tiến 48,3 22,] <0,000001 0,516
triển [trung binh, tuần (khoáng (46,4; 58,3) (17,1; 24,0) (0,419; 0,635)
tin cậy 95%)]
” T_hờỀ gian tếJ'i i 80 mL/ phút) Mặc dù sunitinib vả chằt chuyển hóa chính không đảo thải
bằng thẳm tảch mảu trong các bệnh nhân ESRD (bệnh thận giai đoạn cuối), tống nông độ toản
thân giảm đến 47% với sunitinib vả 31% cho chẳt chuyền hóa chính so vói cảc bệnh nhân với
chức năng thận bình thường.
Điện lâm đó
Đã có đảnh gỉá sự kéo dải đoạn QT ở nghìện cứu pha 1 với 24 bệnh nhân (tuối: 20 - 87) có
khối u ác tính tiến triễn Vởi cảc nông độ điều trị trong huyết tuơng thì sự thay đối tmng bình
của QTcF tối đa so với thòi diềm ban dầu lả 9,6 mỉlỉgiây (khoảng tin cậy 90% với cận trên lá
5.3
LPD dam: Aug 19, .20/4
Counuy: I'iemam
Reference C DS; version 37.0 quemnce CDS dufe. Aug | 4. 20H
15,] mỉligiây). Nếu tăng khoảng gấp 2 lần các nồng độ điều trị, thì sư thay đồi trung bình cùa
QTcF tối đa so với múc cơ bản sẽ là 15,4 milỉgiây (khoảng tin cậy 90% C1 với cận trên là
22 ,4 mỉlìgiãy). Moxifioxaxin [400111O)du110 lảm đối chúng cho thẳy có thay đối trung bình về
QTcF tối đa lả 5 _6 miligiãy so vởi mức ban đẳu. Không có bệnh nhân nảo gặp phản ung, liên
quan dến QTc lởn hơn độ 2 theo tiêu chuẩn về thuật ngũ về các tảc dụng không mong muốn
v3,0. Không có hệnh nhân nảo có loạn nhịp tim (xem Mục 4.4).
Dược động học Irong lmyếl iương
Sau khi dùng liều đơn ở nguời tình nguyện khỏe mạnh thời gỉan bản thải của sunitinib iả
khoảng 40— 60 gỉờ vả cũa chắt chuyền hóa chủ yếu có hoạt tính là 80 — 110 giò. Nếu tiếp tục
liều hảng ngảy, thì thắy sunitipib tích lũy gắp 3— 4 lần còn chất chuyền hóa chủ yếu có hoạt
tính tích lũy 7 — 10 lần. Cảo nồng độ trong trạng thải ốn định của sunitinib vả của Chẳt chuyến
hóa sẽ đạt được trong 10 — 14 nơảy. Sang Ngảy 14, tống nồng độ trong huyết tuong cùa
sunitinib vả của chất chuyền hóa có hoạt tinh là 62. 9 — 101 nanogam/mL, tủc lả dạt nông độ
đích dự đoản tù cảc dữ liệu tiền lâm sảng đủ để úc chế thụ thể phOSphoryl hóa in vitro và đạt
được sụ Ổn định | giảm sự phảt triển của khối u ín vivo. Khônư có thay đối có ý nghĩa về duợc
độnƠ học của sunitinib hoặc cùa chất chuyến hóa chủ yếu có hoạt tính khi dùng liên tiếp cảc
liều hảng ngảy hoặc vói các chu kỳ nhắc lại trong cảc chế độ liễu thử nghiệm.
Dược dộng học là tương đương trong mọi quản thê bệnh nhân có khôi u đặc đã nghiên cửu vả
ở người tinh nguyện khờc mạnh.
Duợc đóng học ở từng quần lhề
Phân tích cảc dữ liệu nhân chủng học về dược dộng học cho thắy không có ảnh hưởng rõ rệt
vê lâm sảng của tuôi, thê trạng, độ thanh thải creatinin, giởi tính, chủng tộc, chi sô ECOG tởi
dược động học cùa sunitinib hoặc của chât chuyên hóa chủ yêu có hoạt tính.
Trọng Iưgmg. (rạng !háỉ hoại động
Phân tích cảc dữ liệu nhân chủng học vẽ dược động học cho thây không cân đỉêù,ẩjiỹh trong
lỉêu ban đâu theo trọng lượng hay trạng thái hoạt động theo phản loại ECOG.
Giới Iính
Các dữ liệu sẵn có cho thẩy nữ giới có thế có độ thanh thải (CL/F) thấp hơn nam giởi khoảng
30%; tuy nhiên sự khảo biệt nảy không yêu câu điêu chinh liêu ban đâu.
Các dữ liệu an toằn tiên iâm sảng
Trên chuột cống và khỉ, nghiên cứu độc tính vởi cảc liều nhắc lại cho tới 9 tháng sủ dụng,
thấy cảc tảc dộng chủ yếu trên cơ quan đich được xảo định là ở đuờng tiêu hóa (nôn vả tiêu
chảy ở khi), tuyến thuợng thận (tụ mảu vả/ hoặc xuất huyết vò thuợng thận ở chuột vả khỉ,
còn ở chuột là hoại tử sau đó là xơ hóa), hệ máu — bạch hưyết (giảm tân sình tế bảo ở tùy
xương và tiêu mỏ bạch huyết ở tuyến ức, lảch vả hạch bạch huyết), tụy ngoại tiết (mắt hạt tế
bảo nang tụy kèm theo hoại từ tế bảo), tuyến nước bọt (phỉ đại nan Đ), khớp xương (tăng bề
dảy các đĩa tảng trường), tù cung (tco) vả buồng trúng (gỉảm phát ttiển nang buổng tiủhg).
Cảc hiện tượng trên xảy ra ở múc nông độ của sunitinib trong huyết tuơng có ý nghĩa lâm
sảnư Cảo tảc dụng bổ sung gặp ở những nghiên cứu khảo bao gỏm kéo dải đoạn QTc, giảm
phân suất tống mảu thắt tiải vả teo ông tinh hoản, tăng chắt trung mô ò gian mạch thận, xuất
huyết ở ống tíêu hóa vả nỉêm mạc miệng, phì đại các tế bảo tuyến yên. Những sụ thay đồi ở tứ
LPD dam: Aug 19. 2014
C 0 tuưry: I'iemmn
Reference C DS; vcrs:on 3 7.0 Reference CDS dare: A ug M, 2014
cung (teo nội mạc từ cung) vả ở sự lớn lên của đĩa xương (Ioạn sản sụn) có thề lỉên quan tới
tảc dụng dưọc lý cùa sunitinib. Nhiều loại trong cảc tảo dụng phụ nêu trên lá có phục hồi sau
2— 6 tuần ngùng đỉều trị
Độc lính với gen
Tiềm năng độc tỉnh với gen của sunitinib đã dược đảnh giả ín vilro vả ín vivo. Sunitinib không
có độc tính gây đột biến trên vi khuẩn sủ dụng sự hoạt hóa chuyển hóa ở gan chuột công.
Sunitinib không gây sai lạc cấu trúc nhiễm săc thể in titro ở tê bảo lympho bảo máu ngoại
biên nguời Tỉnh đa bội (sai lạc số nhiễm sẳc thể) đuợc quan sát ín vilro ở tế bảo lympho mảu
ngoại biên nguời ở cả truờng hợp có hoặc không có hoạt hoả chuyển hoả. Sunitinib không
lảm phá vỡ nhiễm sắc thềờ ơtùy xương chuột cống in w'vo. Chưa có sự đảnh giả với chất
chuyền hóa chư yểu có hoạt tính về tíểm năng gây độc trong di truyền.
Độc tỉnh gáy ung Ihư
"[rong một nghiên cúu ] thảng, dùng thuốc qua ống thông đường uống, đảnh giả các khoảng
liều dùng hảng ngảy liên tục (0, 10, 25,75 hoặc 200 mglkg/ngảy) ở chuột nhắt nhận gen
rasH2, đã gặp u biều mô và tãng sản tuyến Brunner ở tả trảng khi dùng liều cao nhắt (200
mg/kg/ngảy).
Một nghiên cửu về độc tỉnh gây ung thư kéo dải 6 thảng, dùng thuốc qua ống thông đuờng
uống, dùng liều hảng ngảy (0, 8, 2,5 hay 75 [giảm xuỏng 50] mg/kg/ngảy), được tiến hảnh vởi
chuột nhắt nhận gen rasH2. Các khối u ảc tính ở dạ đảy—ruột, tãng tỷ lệ u máu ảc tính vả/ hoặc
sự tăng truờng bất thường cùa cảc tế bảo tìết niêm mạc dạ dảy đă được quan sảt ở liều >25
mg/kg/ngảy sau thòi gian 1 hoặc 6 tháng (27,3 lần diện tích dưới đường cong ò các bệnh nhân
được nhận Iiều khuyến nghị hảng ngảy).
Trong một nghiên cứu về dộc tính gây ung thư kéo dải 2 năm trên chuột cống (0; o ,33; 1 hay
3 mg/kglngảy), dùng sunitinib trong chu kỳ 28 ngảy sau đó nghỉ 7 ngảy, cho thắy có hiện
tuợng phảt triên u và tăng sản bất thường trong tủy thượng thận cùa chuột cống đục nhặn liều
3 mg/kg/ngảy sau >! năm dùng thuốc (>7, 8 lần diện tỉch duởi đường cong ở cảu hênh nhân
đuọc nhặn liều khuyến nghị hảnU ngảy). Ung thư tuyến Brunner xảy ra ở tả 1ÌỆỀỊơ liều >
] mglkg/ngảy ở chuột cái vả 3 mg/kg/ ngảy ở chuột đực, vả việc tãng sản bẩt ti nơ tế bảo
tiết nhầy rõ rệt ở dạ dảy vói liều 3 mg/kgf ngảy ở chuột đực, tương úng với > 0, 9, 7, 8 và 7, 8
lần diện tich dưới dường cong ở cảc bệnh nhân đuợc nhận liều khuyến nghị hảng ngảy. Chưa
rõ mối liên hệ của các kết quả về độc tính gây ung thư quan sảt được ở chuột (nhận gen
rasH2) và chuột cống với việc diều trị bằng suitinib trên người.
ĐỎC tính lrén sự sinh sản vả phát n~ỉến
Không thắy ảnh hưởng trên sự sinh sản cùa chuột cống đục, dùng thuốc 58 ngảy trưởc khi
giao hợp với chuột cải chưa dùng thuốc. Củng không thẳy ảnh hưởng trên sự sinh sản khi cho
chuột cống cái uống thuốc 14 ngảy trước khi giao họp với chuột cống đục không dùng thuốc,
ở liều có thể đạt nông dộ phơi nhiễm toản thân gắp khoảng 5 lần ở nguời. Tuy nhiên, nghiêxi
cứu về độc tỉnh khi dùng liều lặp lại đuợc tiến hảnh trên chuột cống vả khỉ, có ảnh hưởng tởì
sự sinh sản động Vật cải dưới dạng thoải triến nang noãn, thoái hóa hoảng thế thai nghén, thay
đổi nội mạc tử cung… Oiảm cân nặng cùa tử cung và buồng trứng với múc nồng độ toản thân có
ý nghĩa iâm sảng Hơn nũa, nghiên cứu độc tính vởi cảc lỉểu nhắc lại trên chuột cống, thấy
ảnh huỏng trên sự sinh sản chuột đục biền hiện duớỉ dạng teo tỉnh hoản, giảm tinh trùng ở
mảo tinh hoản vả tiêu dạng keo ở tuyến tiền lìệt và túi tinh khi nồng độ phơi nhiễm trong
30
6.2
6.3
6.4
6.5
6.6
LPD date: Aug 19. 201—l
Commạ I ':“emam
Reference CDS~ version 37.0 Reference CDS dum: Aug 14. 201-]
huyết tuơng cao gấp 25 lẩn nồng độ phơi nhiễm toản thân ở ngưởi. Không phải mọi tác dụng
<<ặp ở chuột đục đã được phục hồi vảo giai đoạn cuối của thời kỳ bình phục (6 tuần).
Dối với chuột cống, tỷ lệ từ vong phôi thai liên quan tới thuốc đã cho thắy có giảm rõ rệt về
số lượng thai sông sót, tăng số thai bị tiêu (tiêu sớm và tống số), tuong úng với tăng sảy thai
sau khi trúng đă lảm tô và tổng cộn<< số lượng mất lứa đẻ là 8/28 chuột cải có thai khi nông độ
thuốc trong hưyết tưong cao gấp 5.5 iần liếu phơi nhiễm toản thân ở ngu ời. Trên thỏ, có sự
giảm trọng luợng tù cưng của thủ có thai vả giảm số lượng thai còn sống do tăng số 1ưọug thai
bị tỉêu (tiêu sớm và tồn<< số), tán<< sảy thai sau khi trún<< đă lảm tố vả mẩt lúa đẻ ờ 4”6 thò cái
có thai với nồng độ trong huyết tưong cao gấp 3 1ằn nồng độ phơi nhiễm toản thân ở nơưòi.
Dùng sunitinib trên chuột cống cái tron<< <_ 5 mglk<< bao <<ôm tãng tỷ lệ dị dạng khung
xương của thai, chủ yếu biến hiện ở sự cốt hóa chậm ở dốt sống thắt lưng vả đốt sông ngục.
Tác động trên sự phảt triền của chuột cống đuợc phát hiện ở liều trong huyết tưong cao gâp 6
lần nổng độ phơi nhiễm toản thân ò ngưòi. Trên thỏ, tảo dụn<< trên sự phảt triển biền hiện ở
sự tăng tỷ lệ sút môi khi phoi nhiễm thuốc ở nồng độ tương,< đương vói nồng độ dùng trên
lâm sảng, còn sút môi và nứt khe vòm miệng khi nồng độ huxết tương gắp 2. 7 lần nồn<< độ
phới nhiêm toản thân ờ người.
Chưa tỉến hảnh nghĩên cứu đầy đủ về độc tính trên sự phảt trìến phôi thai cùa thò vì những tảc
động trên phôi thai đă được chửng minh rõ ráng,< trên chuột công và trong các nghiên cứu sơ
bộ trên thò.
CÁC ĐẶC TÍNH DƯỢC HỌC
Danh mục tá dược
Mannitol, Croscarmellose natri, Povidon, Magnesi Stearat, nước tỉnh khiết (nếu cớ).
Vỏ nang (Sutent 12,5 mg) chứa oxid sẳt đò, titan dìoxid, gelatin.
Vỏ nang (Sutent 25 mg) chứa oxid sắt đen, oxid sẳt đò, oxid sắt vảng, titan diox
Vỏ nang (S utent 50 mg) chứa oxid sắt đen, oxid sẳt đó, oxid sẳt vảng, titan dioxid, geiatin.
Tương kỵ
Không.
Thời hạn sửdụng
36 thảng kế từ ngảy sản xuất.
Thận trọug đặc biệt khi bảo quản
Bảo quản dưới 30°C.
Tính chẩt và dung lượng của bao bì đóng gói
Sutent 12,5 mg; 25 mg; 50 mg:
Hộp 1 lọ HDPE chứa 28 viên nang.
Lưu ý đặc biệt về tiêu huỷ
Không có yêu câu đặc biệt.
LPD dam: Aug l9. 2014
(` oumry: l'iemam
Reference CDS: version 37.0 Rejèrence CDS dare: Aug 14. 2014
Tiêu chuẩn: Nhà sản xuất.
Nhà săn xuất:
Pfizer Italia S.r.l., ,
Localita Marino del Tronlo, 63100 Ascoli Pic Y.
®Nhãn hĩệu đã đăng ký
LPD date: Aug 19,2014
Reference C DS date: Au g 14, 2014
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng