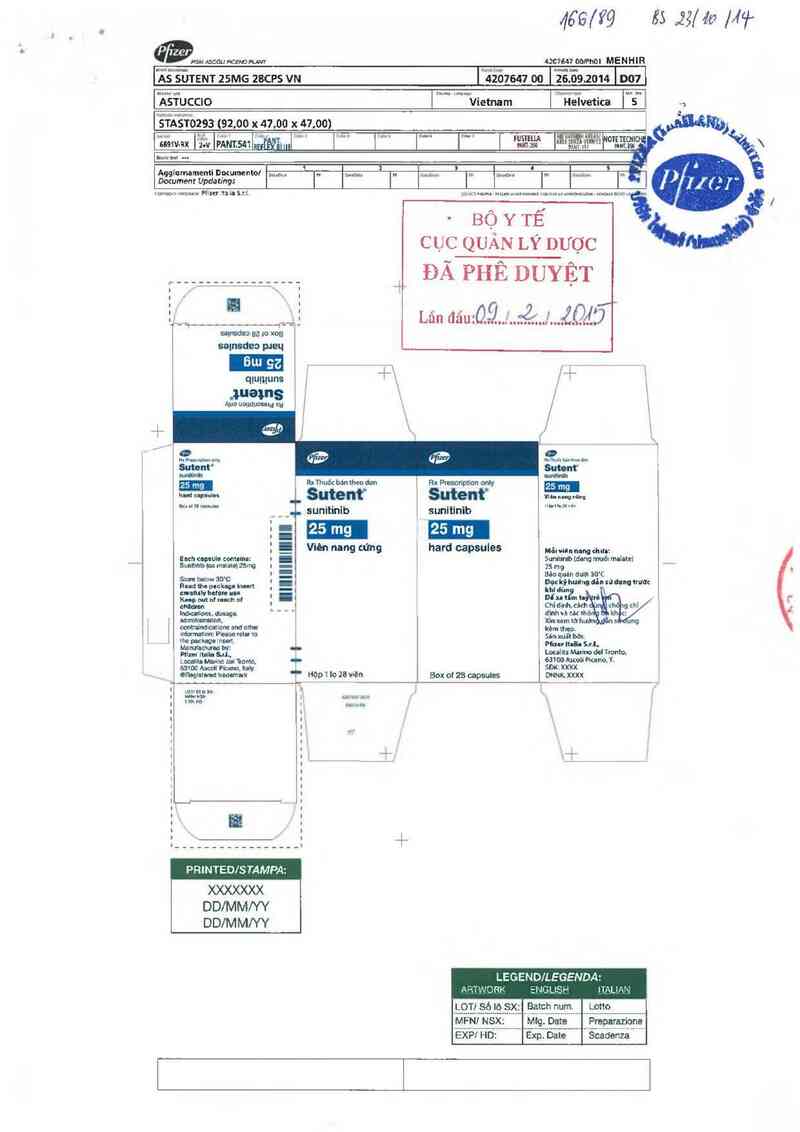





















ửFGM MI mEm nm
4ổ9/Ý9
4207647 00me MENHIR
ĨẵỀỦTENT 25MG 28CP5 VN 'Ĩizỗ7sav 00 1’ỂềĨổ9.zom lno1i
“ẨỀỂUCCIO lmủmwvietnam l'ủ1iãvetica "s"
jÊ1“Ẩẫĩozsa 752.00 x 47,00 )( 47.00)
'1ỉ11111111l’ẳvlèỉntsa1ịfifìml,um 1“ 1"' Im 1"" 1… ”“Ở lWP'ảIỀ“
Ủth!Ỉ -n
588… 11;:31:)1 ' …… ` |~ … ’ |… … |~ …… |…
m…… 14»… Piiltr na in 5.111,
…: 1 umu u u.…mm mv…6 rntuauu…m une… »: «vì
somcdno ae )o xos
semsdeo weq
- BỘ Y TẾ
cục QUẢN LÝ DƯỢC
ĐÃ PHÊ DUYỆT
Lãn tlauỒ—glịJZỌẮẨĨ²
Qiumuns
Jualns
Wo uoiwimua iu
0
"I Mở… M NI M bui Nu 405
.
SIINIW
su… nmtlbib
2g … ,, Rx Thuũc bán theo don Rx Prescription 0111)
11… capsuln q- sutenf “ 11111111…6m11.
Dù H W › « I 1 . : ' b ` -
" _ _ _.,,. sunittnlb sunitinib ' ' " '“
I
I _
: I
, _! Vièn nang c1mg hard capsules ua..." .,Wfflm
E lch uuuư conuim: 1 . Sưn'tml'b (dnng muối mnlite]
SunRInlb (nc mnlals) 25mg 1 = 25 mg
, | Báo quản dươl WC
SFDN Ni°W 311 C 1 = Dọc kỳ huơng dẩn xửdụng mm:
Fuưtggfkm …… 1 _ 11111 11611
cua em 1…- 1 . DỈ
)(n | h l' xu … h
mm ° "'“ " 1 chi dịnh. cAch ~ ch g 65 tuôi. Không nhận thây sự khảo bìệề ngkể nảo về độ 2…
toản và hiệu quả cùa thuốc giũa bệnh nhân trẻ tuồi vả bệnh nhân cao tu
Suy gan
Không cằn điếu chinh liếu khi dùng sunitinib cho bệnh nhân suy gan nhẹ (Child-Pugh loại A)
hoặc trưng binh (Child-Pugh loại B). Chưa có nghiến cứu sử dụng sunitinib ớ bệnh nhân suy
gan nặng (Child-Pugh loại C) (xem Mục 5.2).
Suy lhận
Không cân điêu chinh liêu khởi dâu khi dùng sunitinib cho bệnh nhân suy thận [nhẹ - nặng)
hoặc cho bệnh nhân bị bệnh thặn giai đoạn cuôi đang phải thâm tảch máu. Việc điêu chinh
iiếu dùng tiếp theo nến dựa vảo độ an toản vả khả nãng dung nạp của môi bệnh nhân.
Chống chỉ định
Không dùng sunitinib cho bệnh nhân mẫn cám với sunitinib hoặc bât kỳ thảnh phần nảo cùa
thuôo.
Cảnh báo đặc biệt và thận trọng khi sử dụng
Da vờ mỏ
Đối mảu da có thế do mảu (vảng ) của hoạt chắt lả tảo dụng khỏng mong muốn rất thuờng gặp
được bảo cảo trong các thử nghiệm lâm sảng. Bệnh nhân cân được cảnh bảo về việc mất sắc tố
LPD dơle: Aug | 9. 20l4
Country; 1’1'elnam
Reference C DS ~ version 3 7.0 Reference C DS date: Aug 14, 2014
da hoặc tóc có thể xảy ra trong quả trinh điếu trị với sunitinib. Nhũng tảc dụng khảc trên đa có
thể gặp bao gồm khô, dảy hoặc nứt da, giộp da hoặc có khi phảt ban ở gan bản tay, chân.
Những hìện tượng trên đây không tích lũy, có thể hồi phục vả thường không cần n gừng điều trị.
Phản ứng da nghỉêm trọng đã được bảo cảo, bao gồm trường họp hồng ban đa dạng và những
trường hợp gợi ) hội chứng Stevens- Johnson, trong đó có một số trường hợp gây tử vong.
Nếu có dẳu hỉệu hoặc triệu chủng của hội chúng Stevens-Johnson hoặc hồng ban đa dạng (ví
dụ: ban da ngả) một nặng thếm thường đi kèm với mụn nước hoặc tổn thương niêm mạc),
cẩn ngưng điếu trị bẳng sunitinib. Nếu chẩn đoán xác định là hội chứng Stevens-Johnson,
không được bắt đầu lại liệu phảp sunitinib. Trong một số trường hợp nghi ngờ hồng ban đa
đạng, bệnh nhân đã dung nạp thuốc dùng lại Iỉệu pháp sunitinib ớ liếu thẳp hơn sau khi gỉải
quyết tình trạng phản ứng; một số bệnh nhân nảy cũng được dùng bỉện phảp điếu trị đồng
thời với corticosteroid hoặc thuốc kháng hỉstamin
Hiện lượng cháy máu
Cảo hỉện tượng chảy mảu duợc bảo các sau khi thuốc đã lưu hảnh trong đó có một số ca gã) tử
vong, gồm cả xuất huyết đường tiêu hóa, hô hẩp, khối u, đưòng tiết niệu vả não Tmng cảc thử
nghiệm lâm sảng ,chảy mảu khối u gặp ở khoảng 2% số bệnh nhân bị u mô đệm đuờng tiếu hóa
(GIST). Những hiện tượng nảy có thể gặp đột ngột và trong trường hợp cảc khối 11 ở phổi, có
thể biếu hiện bằng ho ra mảu hoặc xuất huyết phối nghiêm trọng đe dọa tinh mạng Các trường
họp xuất huyết phổi, một vải trường hợp dẫn đến tử vong đã được quan sảt trong cảc thử
nghiệm lâm sảng và được báo cảo sau khi thuốc đã lưu hảnh ở những bệnh nhân sư dụng
sunitinib để điều trị ung thu biều mô tế bầo thận, u mô đệm đường tiêu hóa và ung thư phồi
khộng tế bảo nhỏ có di cãn. Sunitinib khỏng được phê duyệt để dùng cho bếnh nhân ung thư
phối không tế bảo nhỏ
Cảc hiện tượng xưất huyết gặp ở 18% số bệnh nhân dùng sunitinib ở pha điều 1 mù đôi cùa
nghiên cứu GIST so với 17% ở bệnh nhân dùng giả dược Với bệnh 11 dủng sunitinib để
chữa ung thư biếu mô tế bảo thận tiến triển vả! hoặc di căn (MRCC) chưa được dùng thuốc
truớc đó, 39% số bệnh nhân có cảc hiện tưọng chảy máu so với 11% số bệnh nhân đùng
interferon aipha (1FN— 01). Có 17 (4,5%) bệnh nhân dùng sunitinib so với 5 bệnh nhân ( l 7%)
dùng IFN — 01 có cảc hiện tượng chảy mảu từ độ 3 trở lên. Trong số các bệnh nhân đùng
sunitinib để điều trị ung thư biểu mô tế bảo thận tiến triến vả| hoặc di căn (MRCC) khảng
cỵtokỉn. có 26% số bệnh nhân bị xuất huyết Đảnh giả thường quy cảc hiện tượng nảy cân bao
gỏm việc đếm tế bảo mảu toản phần và khảm sủc khoẻ tốnơ ,,quảt
Đường n'ẽu hóa
Cảo biến chứng đường tiêu hóa nghiẻm trọng, có khi gây tử vong, bao gôm thủng đưòng tiêu
hỏa đã xảy ra ở cảc bệnh nhân bị u ác tính trong ô bụng có sử dụng sunitinib.
Cảc phản ửng về tiéu hóa
Buồn nôn, tiêu chảy, viêm miệng, khó tiêu và nôn lả cảc biến cố đường tiêu hóa liên quan tới
thuốc thuờng gặp nhắt. Đỉều trị hỗ trợ cảc tác dụng khỏng mong muôn ở đường tiêu hóa có thể
bao gồm thuốc chống nôn hoặc chống tiêu chảy.
LPD dale: A ug 19. 2014
C uunnỵv. I~'ielnam
Reference CDS: version 3 7. 0 Reference C`DS dale: Aug 14. 20]4
Viêm fụy
Víêm tụy đã được báo cáo trong cảc thử nghiệm lâm sảng cùa sunitinib. Tăng lipase vả amylase
— huyểt thanh được ghi nhặn ở bệnh nhân có cảc khối u đặc khác nhau sử dụng sunitinib Sự
tảng nông độ lipase lả nhắt thời và thường không kèm theo dắu hiệu hoặc triệu chứng vìêm tụy
ở những bệnh nhân có cảc khối u đặc khác nhau Nếu gặp cảc trìệu chúng vỉêm tụy, bệnh nhân
cần n ơưnơ dùng sunitinib và có biện phảp săn sóc hỗ lrọ thích hợp.
Độc Jính gan
Độc tính gan đã đuợc quan sảt thấy ở những bệnh nhân điều trị bằng sunìtỉnìb. Cảc trường` hợp
suy gan dôi khi dẫn đến lù vong được quan sảt thấy ở < 1% bệnh nhân có khối u đặc đỉều trị
bằng sunitinib Cần theo dõi cảc xét nghiệm chúc năng gan (nồng độ alanin transaminase
[ALT], aspartat transaminase [AST], bilirubin) truớc khi bắt dầu đỉều trị, trong mỗi chu kì
điểu trị, vả khi được chỉ định lâm sảng. Cần ngừng sunitinib khi gặp cảc tảc dụng không
mong muốn về gan ở độ 3 và độ 4 vả không tíếp tục nếu không có gìảỉ pháp.
Huyết học
Gìảm số luợng tuyệt đối bạch cầu trung tính và giảm số lượng tiểu cầu đã được bảo cảo trong
cảc thử nghiệm lâm sảng. Cảc bìến cô nảy không tích lũy, có thể hồi phục vả không cẩn phải
ngùng thuốc. Ngoài ra, có nhũng trường hợp xuất huyết tử vong có lỉên quan đến giảm bạch câu
đã đuợc bảo cảo trong quả trinh luu hảnh thuốc.
Cân tìẽn hảnh việc đêm tê bảo mảu toản phân vảo lúc khởi dầu mỗi chu kỳ điêu trị cho bệnh
nhân dùng sunitinib.
Tim mạch
Cảc bỉến cố tỉm mạch, bao gồm suy Iim, bệnh cơ tỉm, thiếu mảu cơ tỉm cục bộ và nhồi mảu cơ
tìm trong đó có một số trường họp gây tử vong đã được bảo các trong quá trình lưu hảnh thuốc.
Sử dụng sunitinib một cảch thận trọng ở bệnh nhân có nguy cơ hoặc có tỉên sư bị những bỉển cố
nảy Trong cảc thù nghìệm lãm sảng, sụ giảm phân suất tống máu thẳt trấì_ Ẩẵỳ 29% và duới
ranh gỉớì thắp của mức bình thường xảy ra ở khoảng 2% bệnh nhân có khốẨ EHOI đệm đường
tỉêu hóa điều trị bằng sunitinib, ở 4% bệnh nhânung thư bỉểu mõ tế bảo thạn tìến xa kháng
cytokin và ở 2% bệnh nhân dùng giả dược. Sự giảm phân suất tống mảu thẳl lrải nảy không có
vẻ tiến triển vả thuờng được cải thiện khi tiếp tục điều tn_.
Nghìên cứu ung … bìều mô tế bảo thận ở bệnh nhân chưa đìều trị thấy có 27% bệnh nhân dùng
sunitinib vả 15% bệnh nhân dùng IFN — a có gỉả trị phân suất tống máu lhất trái dưới ranh giới
thắp cùa mức bình thường. Có hai bệnh nhân (<1%) dùng sunitinib được chẳn đoán lá có bệnh
suy tỉm sung huyết.
Suy tim, suy tim sung huyết hoặc bệnh tâm thẩt trải đã gặp ở 0,8% bệnh nhân có khối u dặc* vả
ở 1% bệnh nhân dùng gìả dược.
Bệnh nhân có các bỉên cô về tìm mạch, nhu nhôì máu cơ tỉm (bao gổm dau Lhẳt ngục nghiêm
trọng/không on định), đã bị bắc cầu động mạch ngoại bỉên l vảnh tìm, bệnh suy tỉm sung huyết
có triệu chúng, tai bìến mạch máu nảo, cơn Lhìếu máu cục bộ thoảng qua, hoặc tắc mạch phổi
' Kết quả từ các nghiên cứu lâm sảng ban đâu, chủ yêu bao gồm bệnh nhân u mõ đệm đưòng
tìêu hóa và ung thư bỉêu mô tê bảo thận kháng cytokin.
LPD dam: Aug 19. 20! 4
Country: l'r'emam
Rẹ/èrence CDS: rersr'on 3 7,0 RegÍerence C DS dalc: Aug H, 2014
trong vòng 12 tháng trước khi dùng sunitinib, đă được loại Ia khỏi cảc nghiên cứu lâm sảng cúa
sunitinib Chưa rõ bệnh nhân trong cảc đ1eu kỉện nảy có thể có nguy cơ cao hơn trong vỉệc phảt
triển rối loạn chức năng tâm thất trải do thuốc hay không Thầy thuốc nên cân nhắc giữa nguy
cơ nảy vởí lợi ích cùa thuốc. Cảc bệnh nhân nảy cân đuợc theo dõi chu đảo về các dẳu hỉệu vả
tríệu chứng lâm sảng của suy tim sung huyết môi khi dùng sunitinib. Cũng nên cân nhắc đảnh
gỉả nền và đánh giả định kỳ phân suất tống mảu thắt trái khi bệnh nhân sử dụng sunitinib. Với
bệnh nhân không có các yêu tô nguy cơ về tim, nên cân nhắc đảnh gỉá phân suất tống máu ban
đầu
Khi có các bỉều hiện lâm sảng cùa suy tìm sung huyễt. khuyến cảo ngùng sử dụng sunitinib
Cũng cần ngung vả! hoặc giảm lìếu sunitinib ở nhũng bệnh nhânkhông có bằng chứng lãm sảng
cúa suy tim sung huyết, nhung lại có phân suất tống máu < 50% Vả dưới mức cơ bản > 20%.
Kéo dải đoạn QT
Vởi nổng độ gấp khoảng 2 lẩn nồng độ đỉều trị, thì có nhận thẫy sunitinib gây kéo dải đoạn
QTcF (hìệu chỉnh Friderìcia) (xem Mục 5.2). Khỏng có bệnh nhân có sự kẻo dải đoạn QT/QTc
lởn hon độ 2 theo tỉẽư chuẩn về thuật ngữ về cảc tảc dụng không mong muốn v3 ,.0 Sụ kéo dải
đoạn QT có thể dẫn tói lảm tảng nguy cơ loạn nhịp thất bao gồm xoắn đỉnh Xoắn đinh có gập ở
< 0,1% số bệnh nhân phơi nhiễm sunitinib. Cần dùng sunitinib một cách thận trọng cho bệnh
nhân đã có tìền sủ kéo dải đoạn QT, bệnh nhân đang dùng thuốc chống loạn nhịp tim, hoặc bệnh
nhân trước đây đã có bệnh tim, nhịp tím chậm hoặc có rối loạn đìện giải. Vìệc phối hợp với cảc
thuốc ức chế C Y1’3A4 có lhể lảm tăng nồng độ sunitinib trong huyễt tương, do đó cẩn phải thận
trọng và cần gỉảm Iièu sunitinib (xem các Mục 4.2 vả 4.5).
Tăng h uyế! áp
Tăng huyết ap là tác dụng không mong muốn rất thường gặp đu ợc bảo cảo trong các thử nghiệm
lâm sảng ở cảc bệnh nhân có khối u dặc chủ yếu bao gôm u mô đệm đường tỉêu hóa và ung lhu~
tế bảo thặn kháng cytokìn'. Cần gỉảm 1ỉểu sunitinib hoặc tạm ngùng thuốc ở khoảng 2,7% số
bệnh nhân. Không có bệnh nhân nảo phải ngừng đỉều trị. Tăng huyết áp nghìêm [rọng (> 200
mmHg tâm thu hoặc 1 10 mmHg tâm trượng) xảy ra ở 4, 7% số bệnh nhân. Tăng huyết ảp xảy ra
ở 33, 9% bệnh nhản dùng sunitinib để điểu trị ung thu bỉểu mô tế bảo Ifil ên Ipỉển vải hoặc di
cãn (MRCC) ở người chưa dùng thuốc so vởi 3 6% bệnh nhân dungĨ—Ì .Tăng huyết ảp
nghỉêm trọng gặp ô 12% bệnh nhân dùng sunitinib chưa dùng thuôc truớc đỏ và ở 1% bệnh
nhân dùng IFN- ư. Bệnh nhãn cần được sảng lọc loại trừ bệnh tăng huyết' ap và phải đuợc kiếm
soát hợp lý Khuyến cảo tạm ngùng đỉều trị nếu gặp tãng huyết ảp nghiêm trọng mà chưa kìểm
soát được qua chăm sóc y tế. Có thể tiếp tục điều trị một khi tăng huyết ảp đã được kỉếm soát
hợp lý.
Rối Ioạn chửc năng luyến giáp
Khuyến cáo xét nghỉệm chức năng giảp trạng ban dầu và những bệnh nhân nảo bị suy hoặc
cường gỉảp cần được điều trị theo cảc hướng dẫn điều trị hìện hảnh trưởc khi khởi đầu dùng
sunitinib. Mọi bệnh nhân cần đuợc gỉảm sảt chặt chẽ về cảc dấu hỉệu và triệu chứng rối loạn
chức năng [uyến giáp khi đỉều trị bằng sunitinib. Bệnh nhân nảo có dấu hỉệu vả / hoặc triệu
] Kết quả từ các nghỉẽn cứu lâm sảng ban đâu, chủ yêu bao gồm bệnh nhân u mô đệm đưòng
tiêu hóa và ung thư bìẽu mô tê bảo thặn khảng cytokin.
Ụl
LPD date: Aug 19. 20H
Country; ỉ'i'emam
Reference (` DS: version 3 7,0 Rẹference (.` DS daie: A ug 14. 2014
chứng chủ quan về iốỉ loạn chửc năng tuyến giảp trạng cần được theo dõi xét nghiệm chức năng
tuyến giáp vả được điếu trị theo cảc huớng dẫn hiện hảnh.
Suy chức năng giảp trạng mắc phải được quan sảt ở 6 2% số bệnh nhân có u mõ đệm đường
tiêu hóa đang dùng sunitinib so với 1% ở nhóm dùng__ giả duợc. Suy chức năng giảp trạng đuợc
coi nhu tảc dụng không mong muốn ở 16% bệnh nhân dùng sunitinib trong nghiẽnq cúu về ung
thu biền mô tế bảo thận tiến triển vải hoặc di căn (MRCC) chua dùng thuốc và có 3 bệnh nhản
(< 1%) ở nhóm dùng IFN — ơ vả 4% bệnh nhân qua 2 nghiên cứu về ung thư biếu mô tế bảo
thận kháng cytokin. Ngoài ra sự tăng hormon kích thích tuyến giảp được Ibáo cảo ở 2% bệnh
nhân mang ung thư biếu mỏ tế bảo thặn khảng cy1okin.Nói chung, có 7% số bệnh nhân ung thư
biều mô tế bảo thận khảng c_vtokin có bằng chứng hoặc trong lâm sảng hoặc trong phòng thí
nghiệm về suy giảp trạng cấp cứu do thuốc gây ra.
Cảc trường hợp Lãng chức nảng tuyên giảp, một sô kéo theo giảm năng tuyến giảp đã được bảo
cao trong cac thử nghiệm lãm sảng va qua kinh nghiệm sau khi lưu hanh thuôo.
Co giật
Trong cảc nghiên cứu lãm sảng với sunitinib, có gặp co giật ở cảc bệnh nhản có bằng chứng di
căn năo qua xét nghiệm X quang. Hơn nữa, cũng có nhũng bảo cảo hiếm gặp (< 1%), mã trong
đó có một số trưòng hợp tử vong ,về bệnh nhân bị co giật vả có bằng chủng )( quang về hội
chứng viêm não trắng phia sau có thế phục hồi. Bệnh nhân bị co giật và có dấu hiệu/ triệu
chửng chẳc chắn vê hội chứng viêm não trắng phía sau có thể phục hồi, như tăng huyết' ap, nhức
đầu, kém nhanh nhẹn, hư hại chửc năng tâm thần, mắt khả nảng thị gỉảc, bao gôm mù do ảnh
hưởng đến vo não thùy chẳm, cần được kiếm soát bằng chăm sóc y tế, bao gồm kiểm soát huyết
ảp, khuyến Cảo tạm ngừng sunitinib. Sau khi qua khói, có thể tiếp tục dùng thuốc duới sự theo
dõi của bảc sỹ điếu trị.
Quy !rinh phẫu íhuật
Đã có nhũng bảo các về suyD Ơiảm khả năng lảnh vết thuơng trong khi điều trị bằng sunitinib
Khuyến cảo tạm ngùng đ 1eu trị sunitinib vì lý do thận trọng ở nhũng bênh nhân đáng trải qua
các quy trình phẫu thuật lớn. Có rất ít kinh nghiệm Iâm sảng về thời gians ỆẺÉRẾ iại sau khi có
sự phẫu thuật lởn Do đó, quyết định tiếp tục điếu trị bằng sunitinib sau phẫ t uật lớn cần dược
dựa trên việc đánh giá phục hồi lâm san g sau phẫu thuật.
Hoại Iủ~xưong hảm
Bệnh hoại từ xương hảm được quan sảt thẳy không thường xuyên trong các thử nghiệm lâm
sảng vả các hảo cảo hậu măỉ ở bệnh nhân dìều trị bằng sunitinib. Phẩn lón với các trường hợp
bệnh nhân đã dược chữa trị nước đó hoặc đồng thời với biphosphonat tiêm tĩnh mạch [IV) thì
bệnh hoại từ xương hảm là một nguy cơ xảc định. Do đỏ, cân thận trọng khi sử dụng sunitinib
vả biphosphonat tỉêm tĩnh mạch (IV) đồng thời hay tuần tự.
Giải phẫu nha khoa cũng lả một yếu tố nguy cơ gây bệnh hoại tử xưong hảm. Tmớc khi điếu trị
bằng sunitinib, nên cân nhẳc khảm răng và có biện phảp phòng ngừa nha khoa thích họp. Ở
những bệnh nhản được điều trị bằng sunitinib mả trưởc đó đã sử dụng hoặc đang sử dụng
biphosphonat tiêm tĩnh mạch, nên trảnh giải phẫu nha khoa nếu có thế.
4.5
LPD dale: A ug 19. 20H
(`mmny: l'íemam
RẬerence CDS: rersi'on 37.0 Reference C`DS dam; A ug M. 20Ì 4
Hội chứng Ìy giải khối u (T LS)
Các trường hợp ly giải khối u. một số trường hợp tử vong, được quan sát thấy với tần
suất hiếm trong các thử nghiệm lâm sảng vả báo cáo hậu mãi ở những bệnh nhân
điếu trị bằng sunitinib. Bệnh nhân thường có nguy cơ xuất hiện hội chứng ly giải khối u
lả những bệnh nhân có khối u lớn trước khi phẫu thuật. Những bệnh nhãn nảy nẻn
được theo dõi chặt chè và điều trị dựa trên các triệu chứng Iâm sảng.
Viêm cán mạc hoại lủ~
Các trường hợp viêm cân mạc hoại tử hỉếm gặp, bao gồm cả viêm cân mạc hoại từ vùng đảy
chậu, đôi khi gây tứ vong ,đã được bảo cảo. Cần ngung ]ỉệu phảp sunitinib ở bệnh nhân phảt
triền viêm cân mạc hoại tứ và bắt dầu phương phảp điểu trị thich hợp ngay lập tức.
Protein niệu
Trường hợp bị protein niệu và hội chứng thận hư đã được bảo cảo Khuyến cảo nên tiến hảnh
phân tích nước tiếu ban đầu vả bệnh nhân cằn được giảm sát protein niệu mới bị hoặc bị nặng
thêm. Tính an toản của việc tiếp tục 1iệu pháp sunitinib ở bệnh nhân protein niẽu trung binh
và nặng chua dược đảnh giả một cảch có hệ thống. Ngưng sủ dụng sunitinib ở bệnh nhãn bị
hội chứng thặn hư.
Hạ đưòng huyết
Việc giảm glucose huyết` trong một số tn.rờng hợp có triệu chứng lâm sảng, đã được bảo cảo
trong quả trinh điếu trị với sunitinib. Mức đường glucose trong mảu ở bệnh nhân đải thảo
đường cần được kiểm tra thường xuyên nhằm đánh giả xem có cần điều chinh liều thuốc đỉều
trị đảỉ tháo đường hay không để giảm thiếu nguy cơ hạ đường huyết.
Tương tảc vỏ~i các thuốc khác vả cảc dạng tương tác khảc
Các Ilmổc có Ihẻ Jảm tăng nồng độ sunilinib trong huyể! tưong
Phối hợp sunitinib với chẳt ưc chế mạnh CYP3A4, ketoconazol sẽ ]ảm tăng 49% nồng độ tối
đa (Cmax) vả tãng 51% các giá trị điện tich dưới đường cong AƯG Gu" cừấ phức hợp
[sunitinib + chẳt chuyền hóa chủ yếu có hoạt tính] sau khi dùng liếu duy t Sunitinib cho
n gu01 tình n guyẹn khỏe mạnh.
Dùng sunitinib cùng chắt úc chế mạnh họ CYP3A4 (ví dụ ritonavir ỉtraconazol,
erytlưmnycin, clarithromycin nước bưới ép) có thế lảm tảng các nồng độ của sunitinib. Cần
trảnh khỏng dùng sunitinib cùng các chất ức chế CYP3A4 hoặc lụa chọn phối hợp với một
thuốc mà không có hoặc có rẳt ít tìểm năng úc chế CYP3A4. Nếu lại không có khả năng như
vậy thì cằn giảm liều sunitinib (xem Mục 4.2).
Các fhuốc có lhế Jòm giâm nổng độ sunỉn'nib trong huyểi m~ơng
Phối hợp sunitinib với chắt gây cảm úng CYP3A4, rifampicin sẽ lảm giảm 23% nồng độ tối
đa (Cmax) vả gìảm 46% diện tích dưới đường cong (AUCOỦ )của phức hợp [sunitinib + chắt
chuyền hóa chủ yêu có hoạt tính] sau khi dùng liếu duy nhắt sunitinib cho người tình nguyện
khóe mạnh.
Dùng sunitinib vởỉ cảc chắt gây cảm ứng mạnh nhóm cnzym CYP3A4 (ví dụ phenytoin,
dexamethason, carbamazepìn, rifampicin, phenobarbital hoặc HJpericum peiforarum còn gợi
lá cây St. John’ 5) sẽ có thế lảm giảm nông độ của sunitinib. Vì vậy, cãn trảnh phối hợp vởi
4.6
4.7
4.8
LPD date: Aug 19. 2014
Counllj~i l'femam
Re erence CDS: t~ersion 3 7. 0 Reference CDS dam; A ug H. 2014
các chất gây cảm ứin ,hoặc lả chọn phối hợp với một thuốc thay thế mà không có hoặc rất ít
có tiềm nãng gậy cảm ứng CYP3A4. Nều trường hợp bắt buộc phải phối hợp thuốc, có thế
cẳu phải tăng liều sunitinib (xem Mục 4. 2).
Ảnh hưởng đến khả năng sinh sản, phụ nữ có thai và thời kỳ cho con bú
Mang lhai
Chưa có những nghiên cứu về sử dụng sunitinib trong thai kỳ ở người.
Nghiên cửu trên động vặt cho thấy thuốc có độc tinh trên sự sinh sản, bao gổm gây quải thai
(xem Mục 5.3). Không dùng sunitinib trong thai kỳ hoặc cho phụ nữ không có biện phảp
ngừa thai hữu hỉệu trừ khi lợi ích cho mẹ vượt hắn nguy cơ tỉềm tảng với thai nhỉ. Nếu dùng
sunitinib khi có thai, hoặc nếu bệnh nhận trót có thai trong khi đang dùng sunitinib thì bệnh
nhân cần được cảnh báo về nguy cơ tiềm tảng với thai nhi Phụ nữ có khả năng mang thai
được khuyến nghị trảnh mang thai khi điểu trị bằng sunitinib
Liều sunitinib (0, a; 1 0; 3, 0 mglkg/ngảv) đã đuợc đánh giá trong cảc nghiên cứu trước và sau
khi sinh trên chuột cống đang mang thai. Với 1iếuă; 1 mg/kg/t1gây,sự tăng cân của chuột mẹ
giảm trong quá trình mang thai vả cho con bủ, nhưng không thấy có sự nhiễm độc thai sản
cho tởi tận liếu 3 mgfkg/ngảy (ước tính mức nhiễm độc ì 2,3 lần diện tích duới đường cong ở
bệnh nhân dùng liều khuyến cảo hảng ngảy). Ó 1iếu 3 mg/kgfngảy, quan sảt thẳy sụ giảm
trọng iượng cùa chuột con trong suốt thời kỳ còn bú mẹ vả sau cai sữ.a Không thấy có xuất
hiện nhiễm độc ở liều lmglkglngảy (ư ởc tính múc nhiễm độc > 0 ,9 lằn diện tích dưới đường
cong ở bệnh nhãn đùng Iiếu khuyến cảo hảng ngảy).
Khả năng sinh sản
Căn cứ vảo cảc kẻt quả tiên lâm sảng, khả năng sinh sản của cả nam và nữ có thế bị ảnh
hướng bới việc diêu trị hăng sunitinib (xem Mục 5.3).
T hờì kỷ cho con bú
Sunitinib vả [ hoặc cảc chất chuyển hóa của thuốc bâi tiết đuợc qua sủa cùa chuột cống mẹ
Chưa rõ sunitinib vả chắt chuyến hóa chính có hoạt tính của nó có bải tiếỹợ a 5 a người hay
không. Vì có nhiều thuốc thải trù được qua sữa mẹ vả vì có tiềm năng cá fflửèbén' úng có hại
nghiêm trọng cho trẻ bú mẹ nên người mẹ không nên cho con bú trongỉh òi kỳ mẹ dùng
sunitinib.
Anh hưởng trên khả nãng lải xe và vận hảnh mảy móc
Chưa tiên hảnh nghiên cứu về ảnh hưởng cùa sunitinib tới khả năng lải xe vả vận hảnh máy
móc. Bệnh nhân cân dược cảnh bảo là có thế bị chóng mặt trong khi dùng sunitinib.
Tảc dụng không mong muôn
Tản sô của cảc tác dụng khỏng mong muôn (ADR) trinh bảy trong mục nảy là tân sô của biên
có xảy ra ở những bệnh nhân điêu trị bãng sunitinib không phụ thuộc vảo kêt quả đảnh giả ,
quan hệ nhân quả.
LPD dale: Aug 19, 2014
Coumự: l’i'einam
Reference C DS: version 3 7.0 Reference CDS dale: A ag H. .?01 4
Những tảc dụng không mong muốn quan trọng nhắt ở bệnh nhản có khối u đặc ]ả tắc mạch
phổi, giảm tiểu cầu, chảy mảu khối u, gìảm bạch cẩu trung tính có sốt, tăng huyết' ap (xem Mục
4.4).
Nhũng tảc dụng không mong muốn thư ờng gặp nhắt ở mọi múc độ bao gồm: Mệt mói; rối loạn
tìêư hóa như tiêu chảy, buồn nôn, vỉêm miệng, khó tỉêu, nôn; đổi mảu da; phảt ban; vết ban đó
mất cảm giảc; viêm nỉêm mạc ở 1òng bản tay chân; khô da~ đối mảu tóc; suy nhược; rối loạn vị
giác; chản ãn vả tăng huyết ảp. Mệt mỏi, tăng huyết ảp và giảm bạch cầu trung tính là cảc tảc
dụng không mong muôn độ3 thường gặp nghiêm trọng nhât và tăng Iipase là tác dụng không
mong muốn độ 4 thường gặp nghỉêm trọng nhất ở bệnh nhân có khối u đặc.
Chảy máu cam lả tảc dụng không mong muốn về xuất huyết thường< gặp nhẩt đã đuợc bảo cảo
ở khoảng một nửa số bệnh nhân có khối u đặc* bị cảc biến có vẽ xuât huyết (xem Mục 4. 4).
Trong các nghiên cút: lảm sảng vởi sunitinib, có gặp cảc con co giật ở bệnh nhân có bằng chúng
X quang về di căn não. Ngoài ra, có một sổ bảo cảo (<1%) truờng hợp xuất hiện con co giật và
có chứng cứ X quang về hội chứng viêm não trắng phía sau có phục hổi, trong đó có trường họp
tử vong (xem Mục 4.4).
Các hìện tương rhuyẻn lắc huyết khối tĩnh mạch
Trong nghỉên cứu mù đỏi trên bệnh nhản có khối u mô đệm đường tiêu hỏa (GIST) 0 giai đoạn
điếu trị, 7 bệnh nhân (3%) dùng sunitinib và không có bệnh nhân dùng giả được nảo bị hìện
tượng thuyến tắc huyết khối tĩnh mạch; 5 trong số 7 nguời bị huyết khối tĩnh mạch sâu độ" J; còn
2 người thì ở độ 1 hoặc 2. Bốn trong số 7 bệnh nhân GIST nảy phải ngùng thuốc sau khi huyết
khối tĩnh mạch sâu được quan sảt lần dầu Có 13 bệnh nhân (3%) dùng sunitinib để chữa ung
thư biếu mô tế bảo thận tiên triến vả! hoặc di căn (MRCC) chưa dùng thuốc trước đó và 4 bệnh
nhân (2%) trong ca'c nghiên cúu MRCC khảng cytokin dã được bảo cảo gặp các hìện tượng
thuyên tắc huyết khối tĩnh mạch. Có 9 trong số các bệnh nhân đó bị tắc tĩnh mạch phối, [ người
ở độ 2 vả 8 người ở độ 4. Tám bệnh nhảm bị huyết khối tĩnh mạch sâu, trong đó 1 người ở độ 1,
2 người độ 2, 4 người ở độ 3 vả 1 người ở độ 4. Một bệnh nhân bị tắc mạch phổi tmng nghiên
cứu MRCC kháng cytokin phải ngừng dùng thuốc. Vởi bệnh nhân ung thư biểu mô tế bảo thận
vả/ hoặc di căn (MRCC) chưa dùng thuốc mả dùng lFN-ot, có gặp 6 (2° iẳn tư,ợng thuyên tắc
huyết khối tĩnh mạch; 1 bệnh nhản (< 1%) ở độ 3 của huyết khối tĩnh mỂếỄĨỀụ và 5 bệnh nhân
(1%) bị tắc mạch phối, tắt cả dến ở độ 4
Tắc mạch phổi được bảo cáo ở khoảng 2,2% số bệnh nhân có khối u đặc2 đã dùng sunitinib.
Không có hiện tượng nản khiến bệnh nhân phải ngừng dùng sunitinib, tuy nhiên có phải giảm
liếu hoặc tạm trì hoãn điểu trị trong vải trường họp Khỏng có xảy ra tiếp hiện tượng tắc mạch
phồi ở cảc bệnh nhân nảy sau khi tiếp tục đỉều trị trở lại.
Kêt quả từ cảc nghiên cứu lãm Sảng bạn đâu, chủ yêu bao gôm bệnh nhân u mô đệm đường
tỉêu hóa và ung thư bỉêu mõ tế bảo thận khảng cytokin.
') ấ ' ` ' - a ! » \ ì . Á 2 A A ›t s \
’ Ket qua tu cac nghien cưu lam sang ban đau, chu yeu bao gom bẹnh nhan u mo đẹm đương
tiêu hóa và ung thư biên mô tê bảo thận kháng cytokin.
LPD doíe: Ang H). 20I4
Coumry; l'íemom
Rẹference C DS: version 37.0 Reference CDS dare: Aug 14. 20I4
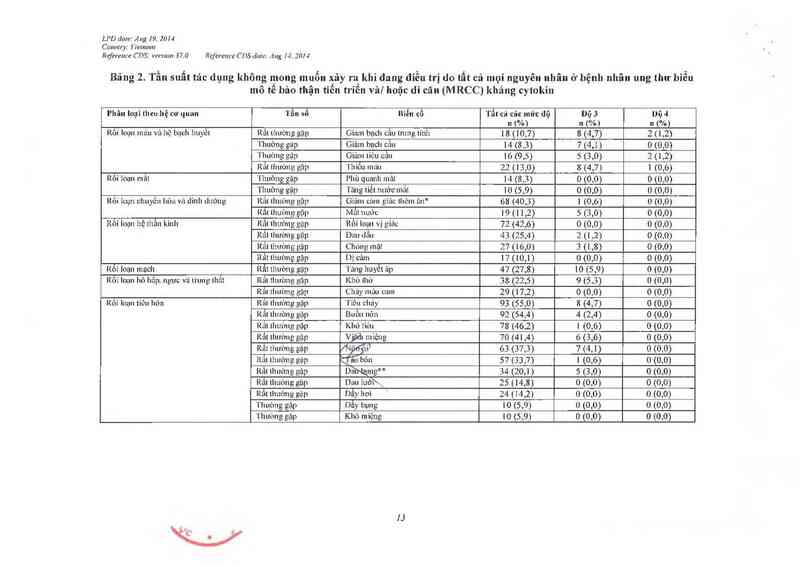
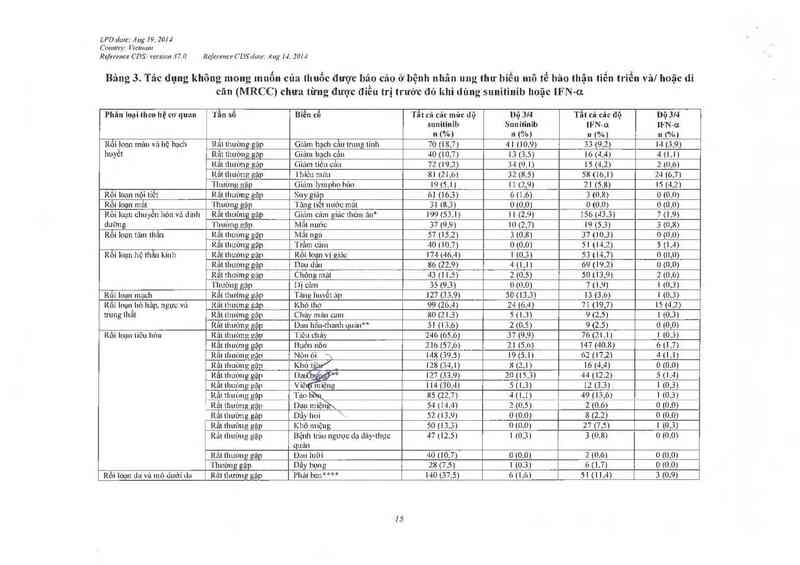
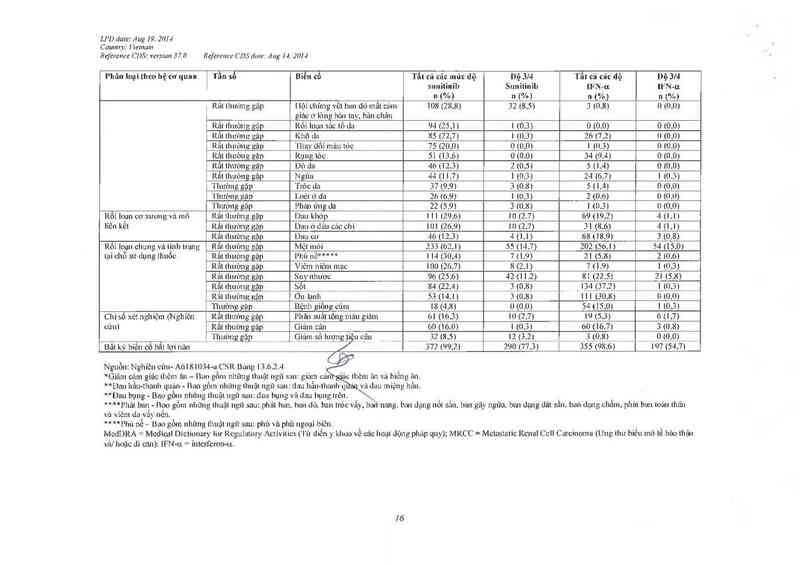
Tần số cùa cảc tác dụng không mong muốn xảy ra khi đang điều trị do tắt cả mọi nguyên nhân
được bảo cáo ở những bệnh nhân dùng sunitinib trong nghiên cứu đơn trị liệu trôn bệnh ung thư
tế bảo thận và u mô độm đưòng tiêu hóa giai đoạn tiến triển vả từ cảc bảo cản hậu mãi được liệt
kế bên dưới theo hệ thống/ cơ quan. tần sô vả độ nặng.
Tằn số dược quy định như sau: rẩt thường gặp (> 1110), thườngg >ỤífflKơi < 1/10) ít gặp
(> 1/1000 tới < ]J'IOO) hiếm gặp (> 1/10 000 tới <1/1000), em gap (< 1/10.000).
10
LPD dơle. Á ưg 19. 20! 4
C ouurry: Viemmn
Reference C DS: )~ersum 3 7.0 Rr.jỉercncơ CDS dme: Aug M. 201 4
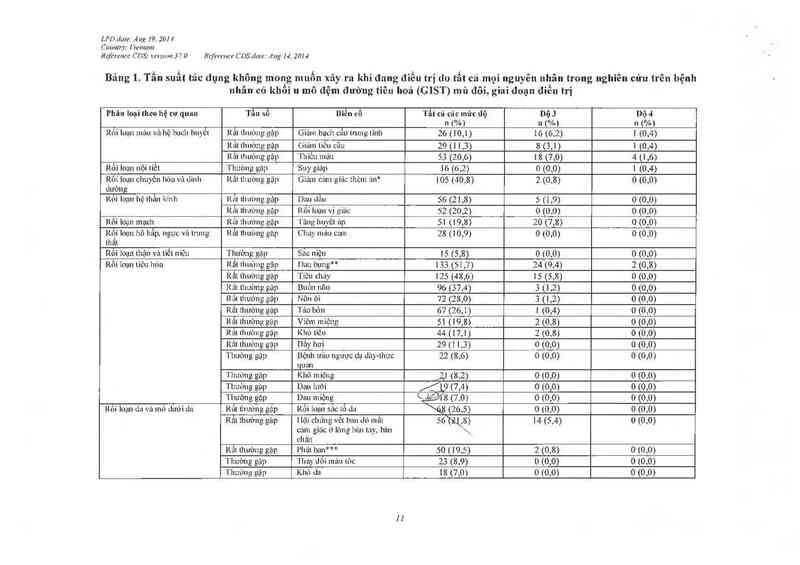
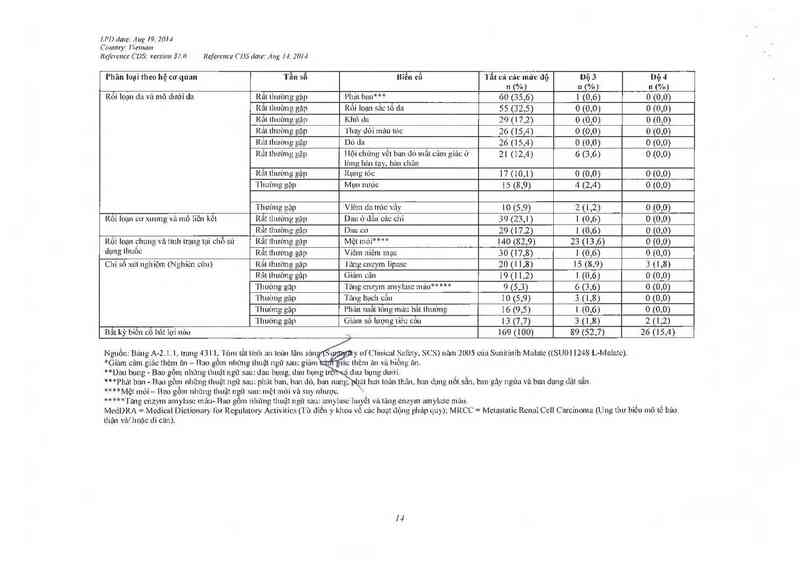
Bâng 1. Tẩu suất tác dụng không mong muốn xãy ra khi đang điều trị do tất cả mọi nguyên nhân trong nghỉên cứu trên bệnh
nhân có khôi u mô đệm đường tiêu hoá (GIST) mù đôi, gỉai đoạn đỉẽu trị
l’ltãn loại meo hệ cơ quan Tần số mé… cố Tắt cả các mức dộ Dộ s nạ 4
, , _ ` n (%) n (%) n (%)
Rỏi ioụn mảu vù hệ bạch huyêt Rât thường gặp Giám bạch câu trung tinh 26 (10,1) 16 (6,2) 1 (0,4)
Rắt thướng gặp (ìiỉun liêu cảu 29 ( 1 l ,3) 8 (3,1) 1 (0,4)
Rât lhuờng gặp Thiêu máu 53 (20,6) 18 (7,0) 4 (1 ,6)
Rối loạn nội tìết 'l`hưòng gập Suy giáp 16 (6,2) 0 (0,0) 1 (0,4)
Rối Ioạn chuyên hóa và đinh Rắt thường gặp Gíaim cz'un giác tliòln zìn* 105 (40,8) 2 (0,8) 0 (0,0)
dtròn
Rỏi Iẫạn hệ thẫn kinh Rait lhtrìmg gập Dau dân 56 (21,8) 5 (1,9) 0 (0,0)
Rât lhường gặp Rôi luạn vị gitic 52 (20,2) 0 (0.0) 0 (0,0)
Rối loạn mạch Rãt thường gặp 'I`z'mg huyết iip 51 (19,8) 20 (7,8) 0 (0,0)
Rộỉ ioạn hô hấp, ngực vả trung Rất thường gặp Cháy máu cam 28 (10,9) 0 (0,0) 0 (0,0)
thât
Rối loạn thận và tiết niệu 'l`hưimg gập Sítc niệu 15 (5,8) 0 (0,0) 0 (0,0)
Rối loạn tiêu hớa Rắt thường gặp Dau hụng“ 133 (51,7) 24 (9,4) 2 (0,8)
Rắt thướng gặp 'l`iêu chảy 125 (48,6) 15 (5,8) 0 (0,0)
Râi thuừng gập Buôn nôn 96 (37,4) 3 (1 ,2) 0 (0,0)
Rắt thưừng gập Nôn ỏi 72 (28,0) 3 (1,2) 0 (0,0)
Rắt thường gập Táo bón 67 (26,1) 1 (0,4) 0 (0,0)
Rẩt thường gặp Víêm miệng 51 (19,8) 2 (0,8) 0 [0,0)
Rất lhtrởng gập Khó tỉõu 44 (17,1 ) 2 (0,8) 0 (0,0)
Rât lhuòng gặp Dắy hơi 29 (1 1,3) 0 (0,0) 0 (0,0)
TlìUÒ11g gặp Bệnh trùn ngược dạ dảy-thưc 22 (8,6) 0 (0,0) 0 (0,0)
( mm
'l`huờng gặp _Il(hô miệng …2,1 (8,2) 0 (0,0) 0 (0,0)
Thut'mg gặp Dau lưỡi Ắ1_9 (7,4) 0 (0,0) 0 (0,0)
Thường gặp Dau miệng ỉ,_ềéầf 8 (7.0) 0 (0,0) 0 (0,0)
Rôi loạn da vả mõ dưới da Rãt thường gặp Rối loạn sảc tố da \48 (26,5) 0 (0,0) 0 (0,0)
Rât thường gặp ilội chửng vêt ban dó mất 56`(21\,8) 14 (5,4) 0 (0,0)
cám giác ở lòng bản tay, bản \…
chân
Kắt thường gặp Pliảt bali*** 50 (19,5) 2 (0,8) 0 (0,0)
'1`lnrt`mg gập Thay dôi mùn tỏc 23 (8,9) 0 (0,0) 0 (0,0)
'l`hường gặp Khó da 18 (7,0) 0 (0,0) 0 (0,0)
l]
!.l'l) dum: Aug 19. 20H
Commy: Í~'Í€IIIíIHI
Refireưce CDS: version 3 7. (! Reference CDSc/uie; A ng N. 20H
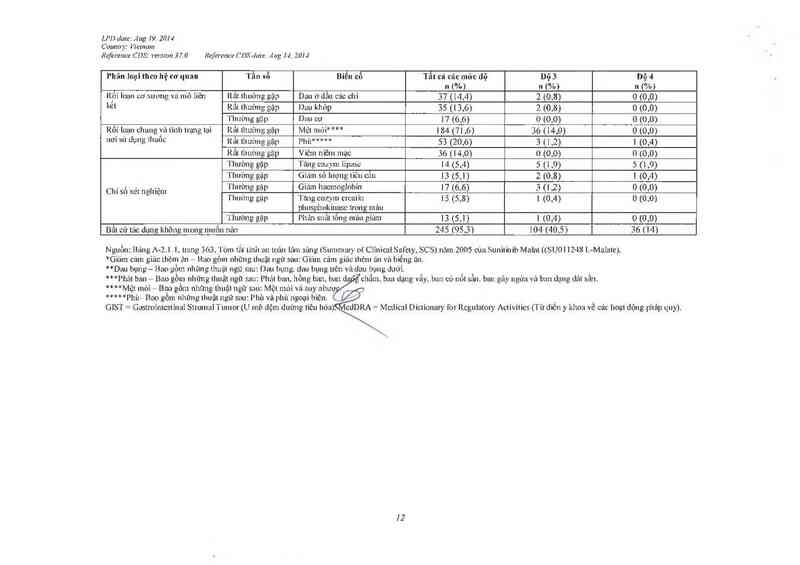
Phân loại theo hệ cơ quan Tần số Biển cố Tẩt cả các mức dộ bộ 3 bộ 4
Y n (%) n (%) n (%)
Rf›i loạn cơ xương vù mũ 1iẽn Rât lliuờng gặp Duu ở dân các chi 37 (14,4) 2 (0,8) 0 (0,0)
kỄl Rât thường gặp 1-Juu kliửp 35 (13,6) 2 (0,8) 0 (0,0)
'l'hưỉmg gặp Dau cơ 17 (6,6) 0 (0,0) _0 (0,0)
Rôỉ loạn chung và tình lrạng lại Rất lhường gặp Mệt mỏi* "* 1 84 (71,6) 36 (14,0) 0 (0,0)
Hơi sữ dụng Ilmôc Rắt lhưt'mg gặp Pliù'““ 53 (20,6) 3 (1,2) 1 (0,4)
Rất thưởng gặp Viêm niêm mạc 36 (14,0) 0 (0,0) 0 (0,0)
'l`htrờng gặp 'l`ĩulg cnzym 1ipnsc 14 (5,4) 5 (1 ,9) 5 (1,9)
'I`hưòng gập Gỉa'mi sô lượng tiêu cũn 13 (5,1) 2 (().8) 1 (0,4)
Chỉ số xét ngllỉệm ĩlịhường gập Ễiảm hacmogiobín 17 (6,6) 3 ( | ,2) 0 (0,0)
1 hướng gập lang cnz_vm creatin 15 (5,8) 1 (0,4) 0 (0,0)
phosphokinase tron g mẽ…
'I'hưòng gặp Phân suâl tông máu giai… 13 (5,1) | (0,4) 0 (0,0)
Bất cứ lác đụng không mong muốn nảo 245 (95,3) 104 (40,5) 36 (14)
Nguồn: Bíuig A—2.1.1. trạng 363,1`ỏm tắt tính an toi… Iâni sẽu1g(Sttnunatr_v ol`Clinical Safety, SCS) nãm 2005 của Sưnitinib Malal ((SU011248 L—MuIzne).
“Giảm cảm giảc thẻm z'm — Bao gồm những thuật ngữ sau: Gift… ctìin giác lhèm t'ui vả biếng ăn,
“Dau bụng — Bac gỏm nhỉmg thuật ngữ sau: Dau bụng… dau bụng trên vảdau bụng duớỉ.
“*Phíit ban — Bao gô… nhũng thuật ngữ sau: Phát bỉlll, hông ban, ban 65 còn có tăng huyết ảp, đái
thảo đuơn g vả có tìền sủ mắc bệnh thuyên tắc huyết khối.
Quá liều
Chưa có thuôo gỉải độc đặc hìệu khi quá Iiêu sunitinib và điêu trị quả lỉêu nên đựa vảo cảc
biện phảp hô trợ chung. Khi có chỉ định, cân thải lượng thuôo chưa hâp thu băng cảch gây nôn
]8
LPD daJe: Aug 19. 2014
C ounny: l'íemam
Reference CDS: version 37.0 Reference CDS dale: .411g14. 2014
hoặc rủa dạ dảy. Cảo trường hợp quá Iiều đã được báo cáo, một số trường hợp liên quan đến
cảc tác dụng không mong muôn phù hợp vởi đặc tính an toản đã được biết của sunitinib.
cAc ĐẶC TỈNH DƯỢC LÝ HỌC
Cảc đặc tỉnh dược lực học
Sunitinib ức chế nhiều thụ thể tyrosin kỉnase (RTKs) lỉên quan tới sự phảt triến cùa khối u, sự
tân tạo mạch mảu vả sụ tỉến trìến của ung thu. Sưnitinỉb úc chế được cảc thụ thể yểu tố tảng
truờng có nguồn gốc tiểu cầu (PDGFR ư vả PDGFR B) các thụ thế yếu tố tãng trưởng cùa nội
mô mạch mảu (VEGFRI VEGFR2 vả VEGFR3). thụ thế yếu lố thân tế bảo (KIT), tyrosìn
kỉnasc — 3 ơiống Fms (FLT 3), thụ thể loại I của yếu tố kích thich cụm tế bảo (CSF- ]R) vả
thụ lhế yếu tố đình đuỡng lhần kinh dẫn xuất từ đòng tế bảo sao (RET). Su úc chế cùa
sunitinib tới hoạt tính của các RTK đã được chúng minh bằng cảc thù nghiệm về tế bảo học
và hóa sinh học, còn sự ức chế về chức năng đã đuợc chúng minh trong cảc thử nghỉệm tăng
sỉnh tế bảo. Chắt chuyển hóa chỉnh cùa sunitinib cũng có hoạt tính luơng tự so vởì chắt mẹ
sunitinib trong các lhù' nghiệm về tế bảo học và hóa sinh học.
Sunitinib ức chế sụ phosphoryl hóa cùa cảc thụ lhể RTK (PDGFR B, VEGFR2, Kl I`) trong
cảc khối u cắy ghép bỉểu hiện RTK ín v1'vo vả đuợc chửng mỉnh có úc chế sự phảt trìên của
khối u hoặc lảm thoái trìến khối u vả/hoặc úc chế đuợc di căn trong một số mô hình thục
nghiệm về ung thư Sunitinib đuợc chúng mình có khả nănư úc chế sự phảt trìến cùa cảc tế
bảo 11 biếu lộ sự rối loạn đỉều hòa mục tíêu RI`K (PDGFR, RET hoặc KIT) fr1 w'íro vả ức chế
được sự tân tạo mạch khối u phụ thuộc PDGFR Bvả VEGFR 2 in vivo.
Các nghìên cứu Iâm sảng
Độ an toản vả hỉệu quả đỉều trị trên lâm sảng cùa sunitinib đã được nghỉên cúu trên bệnh nhăn
có khối u mô dệm dường tiêu hóa’ ac tính đã kháng với imatinib (tủc lả cảc bệnh nhân đã gặp
bệnh tìến triến trong và sau khi dùng imatinib) hoặc không dung nạp với imatinib (tủc lá các
bệnh nhân gặp độc tính rõ rảng trong khi dùng imatinib trước khi dùng thuốc khảc); và ở bệnh
nhân có unu lhư bỉếu mô tế bảo thận tỉến triển vả1hoặc di căn (MRCC)
Hỉệu quả cùa sunitinib căn cứ vảo thòi gìan tới khi khối u tỉến trìến (TTP - tỉmc to tumor
progrcssìon] và sư tảng` tỷ lệ sống sót trong trường hợp u mỏ đẽứl đuòng tiêu hóa (GIST).
Hiệu quả cùa sunitinib cũng dụa vảo thời gian sống\k -_nh tiến trỉến (PFS- progression-
free survival) vả vảo các tỷ lệ đảp ứng khảch quan Ìx _ - objective response rates), tương
úng lrong lruơng hợp ung lhu b1ểu mô tế bảo thận vảĩhoặc dì căn (MRCC) chua điều trị và
kháng cytokin.
U mó đệm đưòng liẻu 11óc1 (GIST)
Một nghiên cúu nhăn mở ban đầu có tăng dần liều đùng đã đụợc tỉến hảnh vói bệnh nhân bị u
mô đệm đuờnư tỉêu hóa sau khi thất bại với imatinib (]ỉều tối đa mỗi ngảy tính trung bỉnh là
800 mg) do để khảng hoặc không dung nạp. Có 97 bệnh nhân tham gia dùng cảc Iiều và thời
gian biểu khảc nhau: 55 bệnh nhản dùng 50 mg trong thời gian biểu điều trị khuyến cáo là 4
tuần dùng thuốc/ 2 tuần ngùng thuốc ( thời gian biếu 412 ). Trong nơhỉên cúu nảy, thời gỉan
tới khi khối u tiến triền và thời gỉan sống không bệnh tìến trỉến trung bình là 34 0 tuần lễ
(khoảng tĩn cậy ở múc 95% lá 22,0—46,0111ầ11).
19
LPD dare: Ảug 19. 201-(
Comiij: !"1'emam
Reference C DSJ version 3 7.0 Reference CDS date: Aug 1—1. 2014
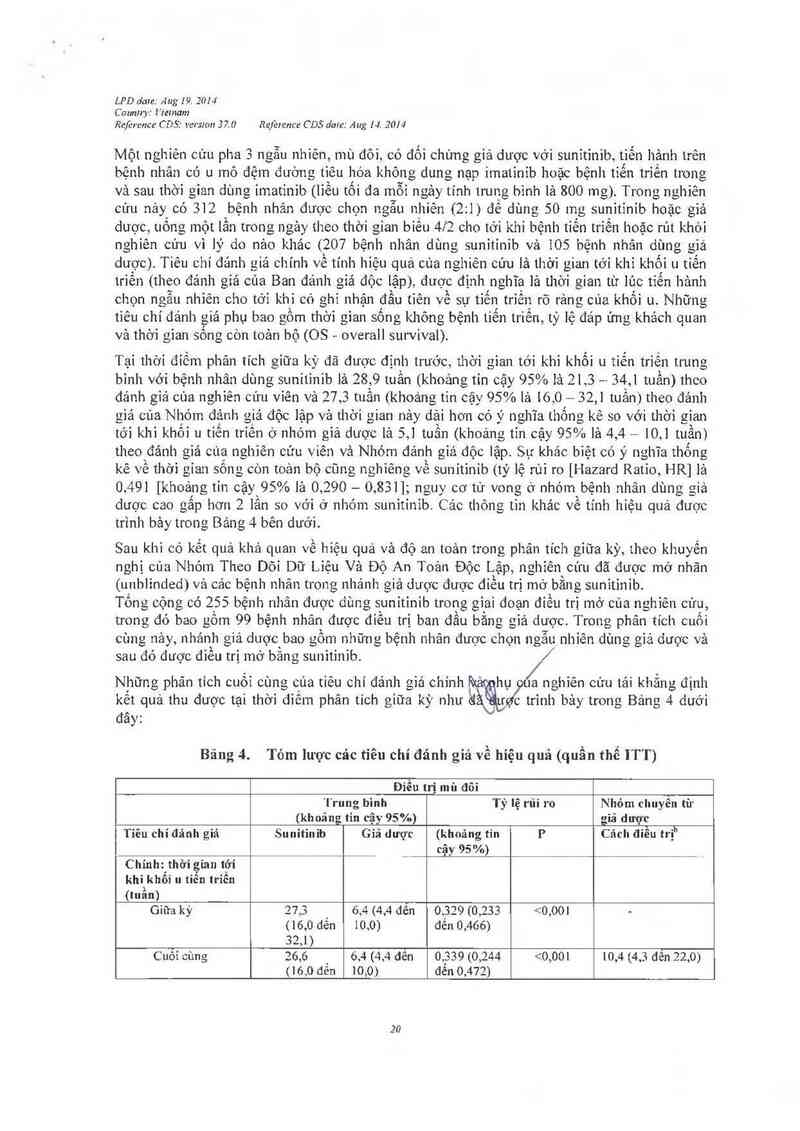
Một nghiên cứu pha 3 ngẫu nhiên, mù đôi, có đối chứng giả dược vởi sunitinib, tiển hảnh lrến
bệnh nhân có u mô đệm đườn g tỉêu hóa không dưng nạp imatinib hoặc bệnh tiến trỉến trong
và sau thời gian dùng imatinib (liều tối đa mỗi ngảy tinh lrung binh là 800 mg). Tronơ nuhiến
cứu nảy có 312 bệnh nhân đuợc chọn ngẫu nhiến (2:1 ) đê dùng 50 …0 sunitinib hoặc giả
duợc, uông một lần trong ngảy theo thời gian biền 412 cho tởi khi bệnh tiển trỉến hoặc rút khỏi
nghiên củu vì lý do nảo khác (207 bệnh nhân dùnƠ sunitinib vả 105 bệnh nhân dùng giả
duợc). Tiêu chí đảnh ưiá chính vê tính hiệu quả cùa nghiên cúu 1ả thời gian tới khi khối u tiến
triền (theo đảnh giả của Ban đánh giá dộc iập), được định nghĩa là thời gian từ lúc tiến hảnh
chọn ngân nhiên cho tới khi có ghi nhận đẩu tiên về sự tiến trỉến rõ rảng của khối u. Nhũng
tiêu chí đánh giá phụ bao gồm thời gian sống khỏng bệnh tiến triển, tỷ lệ đáp ứan khảch quan
và thời Ơizm sống còn toản bộ (OS- overall survival).
Tại thời điếm phản tích giữa kỳ đã được định trước, thời gian tới khi khối 11 tiểu triến trung
binh với bệnh nhân dùng sunitinib là 28, 9 tuần (khoảng tin cậy 95% là 21 3— 34,1 tuần) theo
đảnh gìá cùa nghiên củu viên và 27,3 tuần (khoảng tin cậy 95% lá 16,0- 32,1 tuần) theo đánh
giá cua Nhóm đảnh 0iá độc lập và thời gian nảy dải hon có ý nghĩa thống kê so với thời gỉan
tới khi khối u tiến trỉến ở nhóm giả duợc là 5,1 tuần (khoả1w tin cậy 95% là 4 ,4— 10, 1 tuần)
theo đánh giá cùạ nghiên cứu viên và Nhóm đảnh giả độc lập Sự khảo biệt có ý nơhĩa thống
kê về thời gian sốnn còn toản bộ cũng nghiêng về sunitinib (tỷ lệ rùi ro [Hazard Ratỉo, HR] lả
0.491 [khoảng tin cậy 95% lá 0, 290— 0,831]; nguy cơ tử vong ở nhóm bệnh nhân dùng giả
dược cao gâp hơn 2 lần so vởi ở nhóm sunitinib. Cảo thỏng tin khác về tinh hiệu quả đuợc
trình bảy trong Bảng 4 bên duới.
Sau khi có kết quả khả quan về hiệu quả vả độ an toản trong phân t1'ch giữa kỳ, theo khuyến
nghị của Nhóm Theo Dõi Dữ Liệu Vả Độ An Toản Độc Lập, nghiên cuu đã đuợc mở nhăn
(unblinded) và các bệnh nhân t10ng nhánh giả duọc đuợc diếu trị mở bằng sunitinib
Tổng cộng có 255 bệnh nhân đuợc đùng sunitinib trong giai đoạn điều trị mở của nghiên cúụ,
trong đó bao gồm 99 bệnh nhản được điếu trị ban đằu bằng giá duợc. Trong phân t1'ch cuối
cùng nảy, nhánh giả dược baor gồm nhũng bệnh nhãn được chọn ngẫu nhiên dùng gỉả dược và
sau đó đuợc điếu trị mở bằng sunitinib.
Nhũng phân tỉch cuối cùng của tiêu chí đảnh gỉá chínhủ hụ a /nghiến cứu tải khẳng định
kêt quả thu được tại thời diêm phân tich giũa kỳ nhưii ctrỉnh bảy trong Bảng 4 duởi
đây:
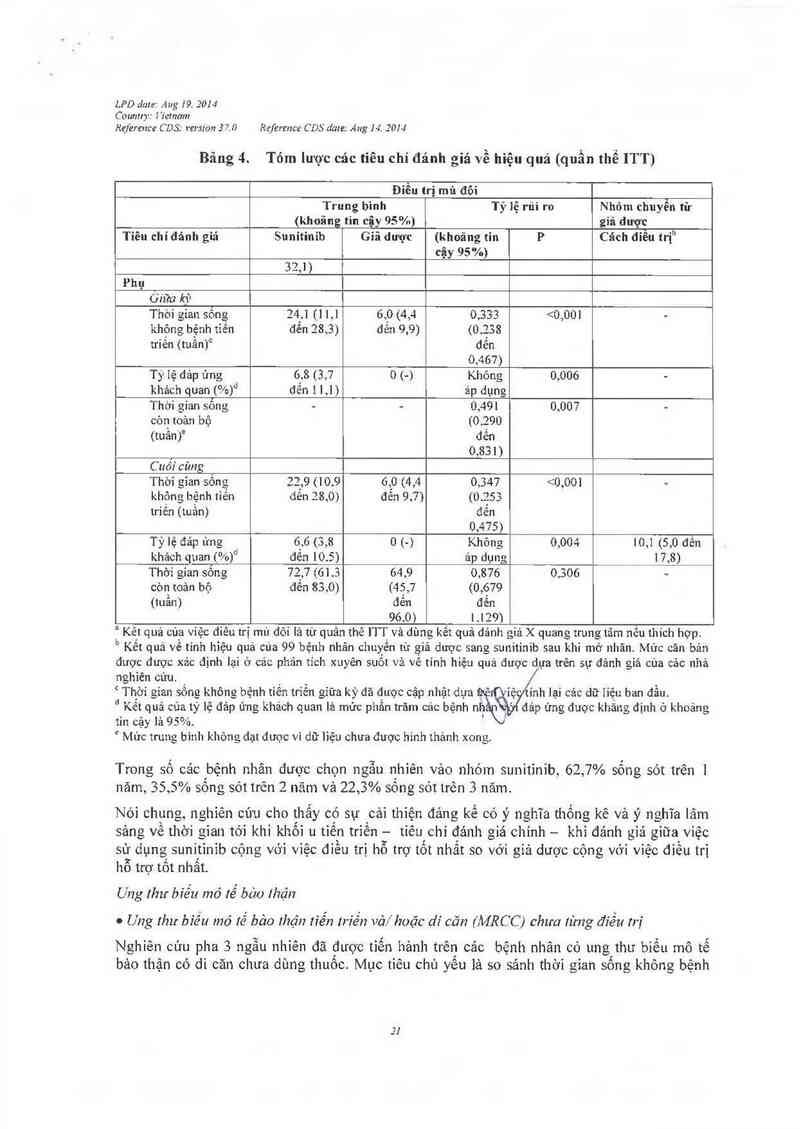
Bảng 4. Tóm lược các tiêu chí đánh giá về hiệu quả (quân thê ITT)
Điểu trị mù đôi
Trung bình Tỷ lệ rủi ro Nhỏm chuyên từ
(khoảng tin cậy 95%) giá dược
Tỉẽu chí đánh gỉá Sunitinib Giả dược (khoảng tin P Cảch điều trịb
cậy 95 %) _
Chỉnh: thời gian tới
khi khối u tiễn triển
(tuần)
Giữa kỳ 27.3 6,4 (4,4 đễn 0,329 (0,233 <0,00] —
(16,0 đến 10,0) đến 0,466)
32,1)
Cuối cùng 26,6 6,4 (4,4 đên 0 ,339 (0,244 <0,001 10,4 (4,3 đẽn 22,0)
(16,0 đển 10,0) đến 0 412)
LPD dam: Aug 1’9. 20.14
C'ounny: I'iemam
Reference (`DS: rersion 3 7. 0 Reference C`DS date: A ng 14, 2014
Băng 4. Tóm lược các tiêu chí đânh giả về hiệu quả (quần thể ITT)
Điều trị mù đôi
Trung bình Tỷ lệ rủi ro Nhỏm chuyển từ
(khoăng tìn cặy 95%) giã dmợc
Tiêu chíđảnh gỉá Sunitinib Giã duợc (khoăng tin P Cách 1ỉliễutrịb
cặy 95%)
32,1)
Phụ
Giữa ki`J
Thời gỉan sồng 24,1 (1 1,1 6,0 (4,4 0,333 <0,00] ~
không bệnh tiến đến 28,3) đến 9,9) (0.238
triền (tuần)0 đến
0,467)
Ty 1ẹ dảp ứng 6.8 (3,7 0 1-) Không 0,006 -
khảch quan 1%)“ đến 1 1,1) ảp dụng
Thời gian sổng - - 0,491 0,007 -
còn toân bộ (0,290
(tuần)° đến
0,831)
C uỏi cùng
Thời gìan sống 22,9 (10.9 6,0 (4,4 0,347 <0,001 -
khỏng bệnh tiên đến 28 ,0) đẻn 9,7) (0.253
triến (tuần) đến
0,475)
Tỷ lệ đáp ửng 6,6 (3,8 0 1-) Không 0,004 10,1 (5,0 đên
khảch quan (%)d đến 10.5) ảp dụng 17,8)
Thời gian sông 72,7 (61.3 64,9 0,876 0,306 ~
còn toản bộ đển 83,0) (45,7 (0,679
(tuần) đến đến
96. 0) 1129)
Kêt quả của việc điêu trị mù dõi là từ quân thê 11T vã dùng kêt quả dảnh giá X quang trung tãm nêu thích hợp.
b Kết qua về tinh hìệu quả cua 99 bệnh nhân chuyên từ giã dược sang sunitinib sau khi mở nhãn. Mức căn bản
được được xảo dịnh lại ở cảc phản tỉch xuyên suôt và về tính hiệu quả đuợc dựa trên sự đánh giá cùa cảc nhả
nghỉên cứu.
° d"I`hờỉ gian sống không bệnh tiến triển giưa kỳ đã đuợc cập nhặt dụa fíệ ính lại cảc dữ Iiệu ban đầu.
dKểt quả cùa tỷ lệ đảp ủng khách quan lả mức phằn trăm các bệnh nhẳỵ ’ đảp ứng được khắng định ở khoảng
tin cậy là 95%
Mức trung bình khỏng dạt được vì dữ lỉệu chưa đuợc hinh thảnh xong.
Trong số cảc bệnh nhân được chọn ngẫu nhiên vảo nhóm sunitinib, 62, 7% sống sót trên 1
năm, 35, 5% sống sót trẽn 2 năm và 22,3% sống sót trên 3 năm.
Nói chung, nghỉên củu cho thấy có sụ cải thiện đảng kể có ý nghĩa thống kê và ý nghĩa iâm
sảng vẻ thời gian tởì khi khối 11 tiến triến — tiêu. chí đảnh giả chính — khi đảnh giá giữa việc
sử dụng sunitinib cộng vởi việc diều trị hỗ trợ tổt nhất so với giả dược cộng với việc điếu trị
hỗ trợ tôt nhắt.
Ung Ihư biếu mó Iế bảo Il7ận
o Ung thư bíẽu mó rể bâo lhận Ifến triến vảx’ hoặc di cãn (MR CC ) chưa lừng đỉểu trị
Nghiên cứu pha 3 ngẫu nhìẽn đã đưọc tiển hảnh trên cảc bệnh nhân có ung thư biểu mô tế
bảo thận có di căn chưa dùng thuốc. Mục tiêu chủ yếu lả so sảnh thời gian sông không bệnh
LPD daIe: Aug 19. 201-J
Commy: Ỉ'iemam
Reference CDS: vera1'on 37. 0 Reference CDS dare: Aug 14, 2014
tiến triển ở bệnh 11hâ11 dùng sunitinib so với bệnh nhân dùng IFN- -01 Cảc tiêu chí đảnh giả
phụ bao 0ồm thời gian tới khi khối u tiến triến, tỷ lệ đảp' ung khảch quan, thời gian sống còn
toản bộ sự an toản, vả kết quả do bệnh nhân bảo các (PRO). Có tắt cả 750 bệnh nhân đuợc
chọn ngẫu nhiên (1:1) để dùng 50 mg sunitinib mỗi 11gảy một lần theo thời gian biểu 4/2 hoặc
tỉệm duởỉ da IFN-ơ mỗi lẩn 9 MIU, mỗi tuẫn 3 lẩn. Bệnh nhản được điều trị cho đến khi bệnh
tìến triến hoặc ngùng nghiên cứu vì lý do khác.
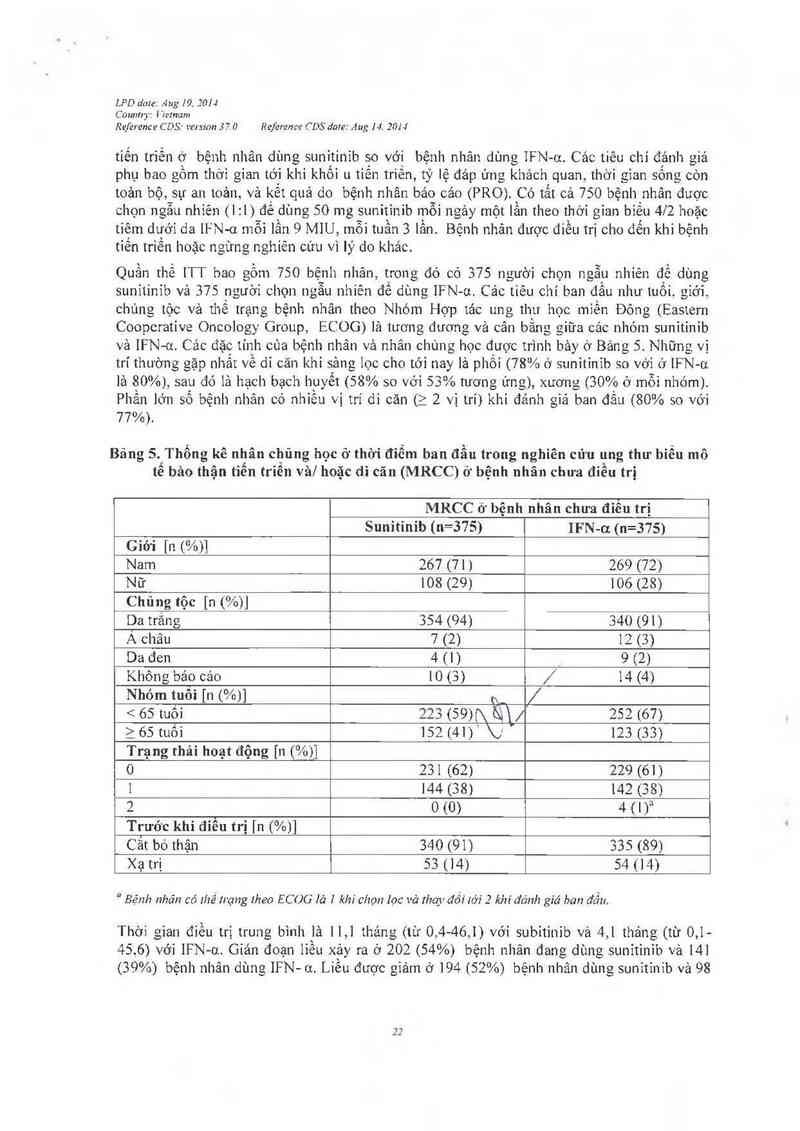
Quần thể 1TT bao gồm 750 bệnh nhân, trong đó có 375 người chọn ngẫu nhiên để dùng
sunitinib và 375 nơườỉ chợn 11 2 vị trí) khi đảnh gìả ban đẩu (80% so vói
77%).
Băng 5.IThống kê nhân chủng học ở thời đỉễm ban đầu trong nghiên cửu ụng thư biểu mô
tê bảo thận tiên triền vả! hoặc di cãn (MRCC) ở bệnh nhân chưa điêu trị
MRCC ở bệnh nhân chưa điều trị
Sunitinib (n=375) IFN-u (n=375)
Giới [n (%))
Nam 267 (71) 269 (72)
Nữ 108 (29) 106 (28)
Chủng tộc [n (%)]
Da trắng 354 (94) 340 (91)
A châu 7 (2) 12 (3)
Da đen 4(1) 9 (2)
Không bảo Cảo 10 (S) / 14 (4)
Nhóm tuôi [n (%)] h. /
< 65 …61 223 (59)(\ &) / 252 (67)
2 65 tuôì 152 (41) b ' 123 (33)
Trạng thái hoạt động [11 (%)]
0 231 (62) 229 (61)
1 144 (38) 142 (38)
2 0 (0) 4 (1)a
Trước khi điỂu trị 111 (%)]
Cắt bỏ thận 340 (91) 335 (89)
Xạtrị 53 (14) 54 (14)
“ Bệnh nhăn có thẻ 11~ạ11g theo ECOG lờ ] khi chọn lọc vả lhay đỏi tới 2 khi dánh giá ban đấu.
Thời gian điểu trị trung bình là 11,1 thảng (tù 0 ,,4-46 1) với subítinỉb và 4,1 tháng (từ 0,1-
45. 6) với IFN— —.01 Gián đoạn liều xảy ra ở 202 (54%) bệnh nhân đang dùng sunitinib vả 14]
(39%) bệnh nhân dùng IFN- 0. Liều được giảm ở 194 (52%) bệnh 11hâ11 dùng Sunỉtỉnib và 98
lu
NA
LPD dale: Aug 19. 2014
Country“ Í'Jetnam
Reference C DS: remmn 37.0 Reference C DS date. Aug 14. 20l4
(27%) bệnh nhân dùng IFN— O.. Tỷ 1ệ 111, S gìởi hạn tối đa của mức bình thuòng (ULN) so với <1,5 ULN), trạng thải hoạt
động ECOG (0 so với 1), vả việc cẳt bò thận trưởc đó (có so với không), tỷ số nguy cơ
nghỉẽng về sunitinib hơn là IFN-ơ. Việc đảnh giá chính bằng X quang đuợc ngưng sau khi
tiêu chí đảnh giả chinh đạt được . Tỷ lệ đáp ứng khảch quan được đảnh gìả bởi người nghiên
cửu lả 46% (khoảng tin cậy 95%: 41, 51) cho nhóm sunitinib vả 12% (khoảng tìn cậy 95%: 9,
16) cho nhóm IFN—0t [p<0,001] (xem Bảng 6).
Cảo kểt quả là tương đương trong các phân tich hỗ trợ và kểt quả chứng minh rắt mạnh mẽ khi
kỉềm soát về 11hân chùng học (tuồỉ, giới tinh, chùng tộc và trạng thải hoạt động) và các yếu tố
nguy cơ đã biết. Vờỉ 262ưong số 750 bệnh nhân (35%) không có cảc yếu tố MSKCC, thi thời
gỉan sông không bệnh tiêu trỉên trung binh lả 64,1 tuân trong, 11hóm sunitinib và là 34. ] luân ở
nhóm 1FN-u (tỷ số nguy cơ 0 ,,447 khoảng tin cặy 95% [0, 313 - 0 ,640]); vởi 424 bệnh nhân
(56%) có 1 hoặc 2 yêu tô nguy cơ, thì thời gian sông khônư bệnh tiên triên trung bình là 46,6
tuần ở nhóm sunitinib vả 16,1 tuần ờ 1111óm IFN—u (tỷ số nguy cơ 0,547, khoảng tin cậy 95%
[0.² 423 — 0,;7071 vả với 47 bệnh 1111â11 (6%) có > ) yếu tố nguy cơ, thì thời gỉan sống không
tiến triền trung bỉnh là 12,] tuần ở nhóm sunitinib và 5 7 tuần ở nhóm 1FN- -01 (tv sô nguy cơ
0 ,;679 khoảng tin cậy 95%[0,330-1,398D /
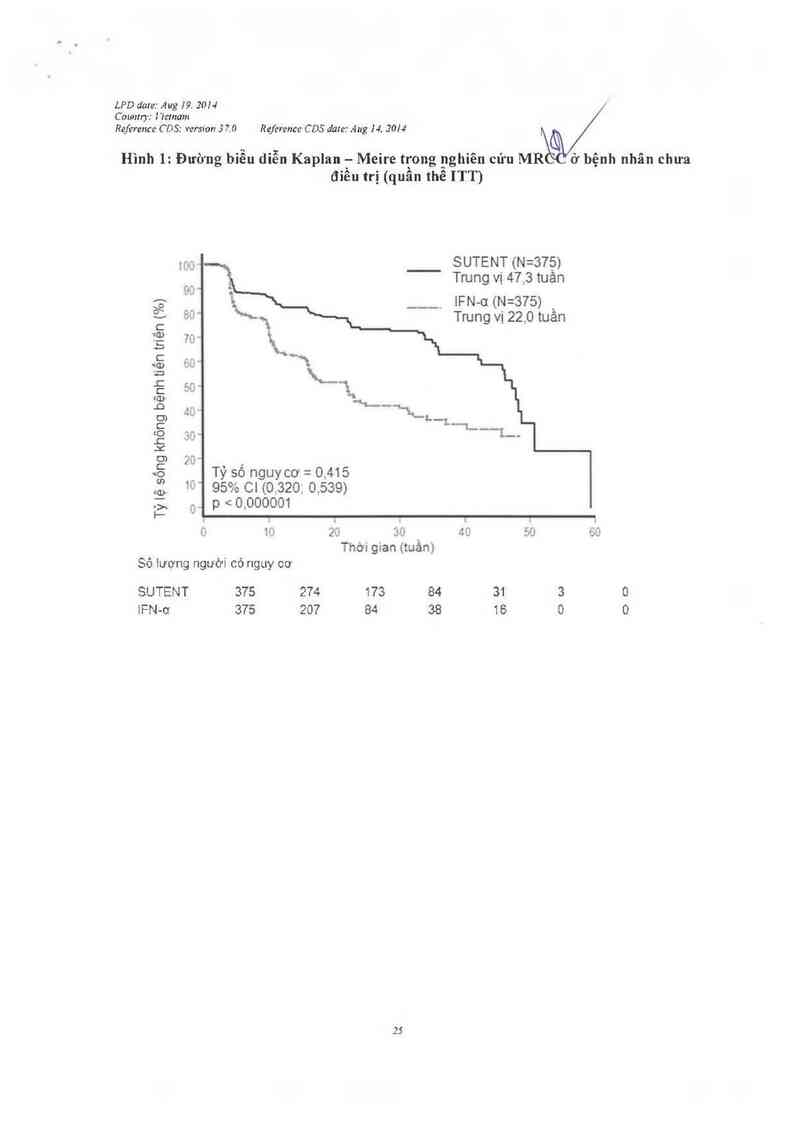
Như trình bảy trong Hmh 2, việc điếu trị bằng sunitinib Iiẽn quan tởj/Việ0 sống sót lâu hơn so
vởì IFN- -01 Thời gian sống còn toản bộ trung binh lả 114. ân o o 11hóm sunitinib (khoảng
tin cậy 95%:100,1- 142 ,9) và 94, 9 tuần cho nhóm 1FN-(X (ki5 ẵtin cậy 95%: 77,7-1 17,0) ]tỷ
số nguy cơ 0 821, khoảng tỉn cậy 95%: 0,673-1,;001 p= 0,0 ẵầng thử nghiệm log-rank, p=
0,013 bằng thủ nưhiệm Wilcoxon]. Trong 0phân tích phân tằng (LDH > so vói <1,5 x giói hạn
tối đa cùa mủc binh thường (ULN), trạng thải hoạt động theo phân Ioại ECOG là 0 so với >l,
và có hay khỏng cắt bỏ thận trước đó), tỷ số nguy cơ là 0 818 (khoảng tin cậy 95%: 0, 669-
0,999; p= 0,049 theo kiềm định Iog- -rank). Thời gian sống còn toản bộ t1ung bình tinh cho
1111óm IFN- 0 tính cho cả 25 bệnh nhân đã ngung điểu trị bằng IFN 01 vì bệnh tiển tríến
chuyển qua điều trị bằng sunitinib. Sau khi rút khòi nghiên cứu, 213 hệnh nhân trong 11hó
1FN- -u đuợc tiếp tục đìều trị ung thu, trong đó 32% bệnh nhân dùng sunitinib; 182 bệnh n n
trong’ nhóm sunitinib đuợc tiếp tục điều trị ung thư sau nghiên cúu, trong đó 11% dung
sunitinib. Trong cảc phân tich dựa theo dữ liệu kiếm tra cảc bệnh nhân đã chuyển tù điểu trị
bằng IFN-ờ sang điểu trị bằng sunitinib, thời gian Sống còn toản bộ lrunƯ bình tại thời điềm
chuyến đỉều trị là 1 14,6 so với 86,7 tuần (tỷ sô nguy cơ không phân tầng: 0,808; p= —0,0361
LPD dale: Aug 19. 2014
Counuy; 1'iemam
Reference CDS: versron 37.0 Refemnce CDS dam: .411g 14. 2014
theo kiểm định ìog-rank. p= 0,008] theo kiếm định Wilcoxon). Khi loại trừ cảc bệnh nhân đã
điều trị ung thư sau nghiên cứu, tỷ lệ sống còn toản bộ t1ung bình 1ả 121,9 so với 61,3 tuần
trên sunitinib so vởi lFN-ơ (tỷ số nguy cơ: 0,647; khoảng tin cậy 95%: 0,482- 0,867; p=
0,0033 bằngthừ nghiệm Iog-rank; p=0,0013 bằng thử nghiệm Wììcoxon).
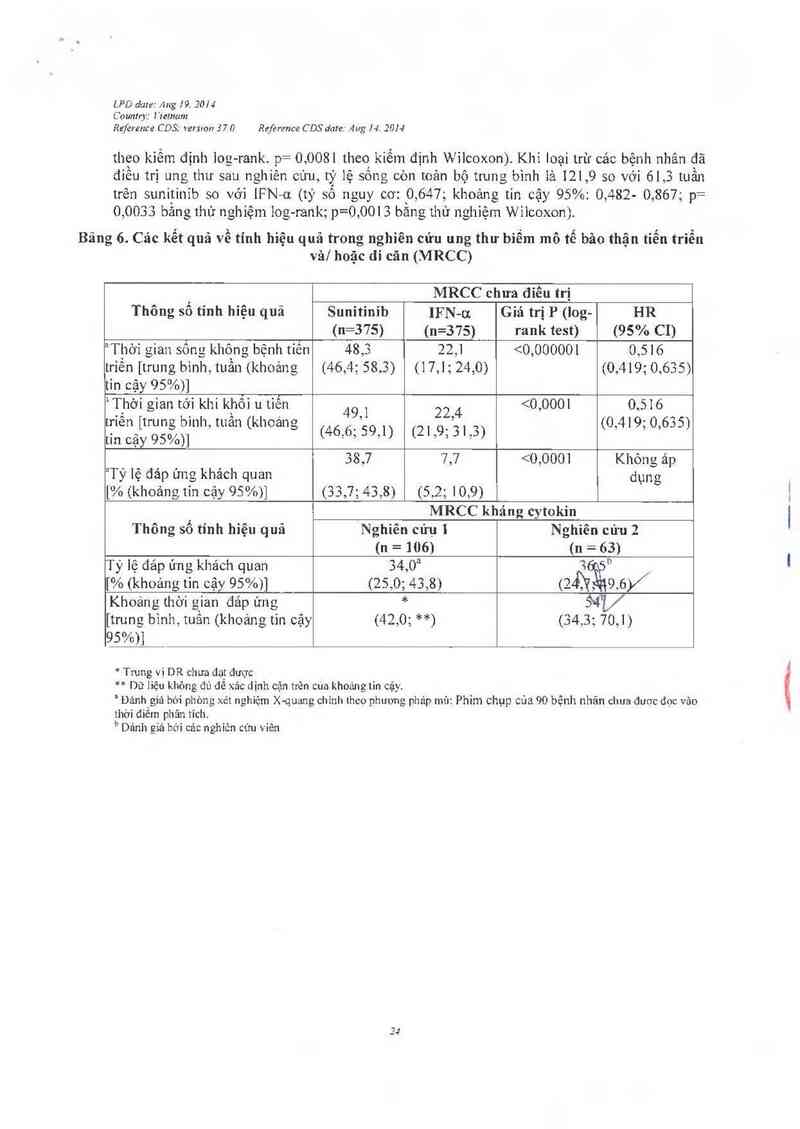
Bảng 6. Các kết quả về tính hiệu quả trong nghiên cứu ung 11…- bỉểm mô tế bâo thặn tiến triễn
vâ/ hoặc di cãn (MRCC)
MRCC chưa điều trị
Thông số tỉnh hiệu quả Sunitinib IFN-u Giá trị P (log— HR
(n=375) (n=375) rank test) (95% CI)
aThởì gian sông không bệnh tiến 48,3 22,1 <0,000001 0,516
triến [trung bỉnh, tuần (khoảng (46,4; 58.3) (17,1;24,0) (0,419; 0,635)
tin cậy 95%)]
²11101 gian t01 khi 10161 u tiến 49 , 22 4 <0,0001 0,516
0 7 › _ «
Ề1ỉ~x1legậ[jt1'(tỷJgÚg/Ọẵ›fnh,tuan(khoan,= (46,6; 5931) (21,9; 31,3) (0,419, 0,655)
38,7 7,7 <0,0001 Khỏng áp
3Tỷ lệ đảp ứng khách quan đụng
[% (khoảng tin cặy 95%)] (33,7; 43,8) (5,2; 10,9)
MRCC kháng cytokin
Thông số tính hiệu quả Nghiên cứụ 1 Nghiên cứu 2
(n = 106) (11 = 63)
Tỷ lệ đảp ứng khảch quan 34,0a `) "
[% (khoảng tin cậy 95%)] (25,0; 43,8) (24Ì7ẵ96/
Khoảng thời gian đảp ứng * DẺ'L/
[trung binh, tuân (khoảng tin cậy (42,0; **) (34,3; 70,1)
95%)]
* Trung vị DR chưa đạt được
** Dữ lỉệu khõng đủ để xảc dịnh cận trên cua khoáng tin cậy.
’ Đảnh giá bời phòng xét nghiệm X-quang chính theo phương pháp mù: Phim chụp cùa 90 bệnh nhãn chưa duợc đọc vảo
11101 điếm phân tích.
b Dảnh giả bời cả:: nghiên ct'm viên
LPD date: Aug ]9. 2014
C ounrơ: I'iemam
Reference C`DS: version 3 7.0
Reference CDS dare: A ug ] 4. .?014
Hình 1: Đường biễu diễn Kaplan ." Meire tqong gghiên cứu MR ở bệnh nhãn chưa
đỉêu trị (quân thê ITT)
103
bệnh tiên triền (%)
không
..:
'ĨJ
n
ẹ sông
Tỷl
.,
Tỷ số nguycơ = 0,415
' 95% Cl (0,320; 0.539)
, p < o.oooom
SUTENT (N=37_5)
Trung vị 47.3 tuân
lFN-ơ(N=S7S)`
Trung vị 22,0 tuân
1 Ủ
Sô fượng người có nguy cơ
SUTENT
lFN-ơ
375
375
274
20?
o
2`›
30
Thời gian (tuần)
173
84
84
38
n
(.
I: '
o
1_
31 3 0
16 0 0
LPD dale: Aug M 2014
C ommy; l'iemam
Reference C DS: version 3 7. O Reference CD.S` dule; Aug I—I. 2014
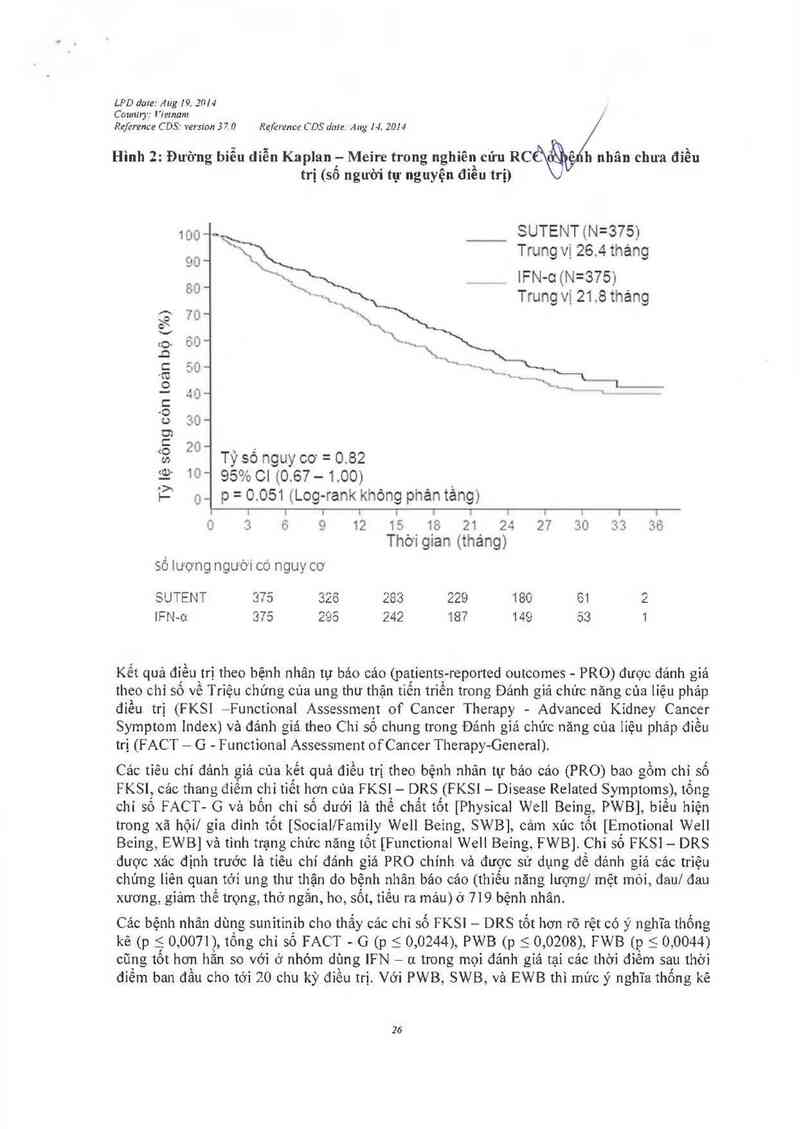
Hình 2: Đuông biễu diễn Kaplan— Meire trong nghiên cứu RC ' ^ h nhân chưa điều
trị (số nguời tụ nguyện điều trị)
100 __ SUTENT (N=375)
\ Trung vị 26.4 tháng
lFN-c (N=375)
Trung vị 21 .8 tháng
Tỷ số nguy co— = 0 82
10“ 95% C! (0.67-1.00)
n… p= 0051 (_Log- rank không phántảng)
o 3 €» ế 1ỉ2 1= 10 21 21: 2ỉ7 311 313 3ỄJ
Thờigian( (tháng)
Tỷ lệ sông còn loán bộ (%)
SUTENT 375 326 283 229 180 61 2
IFN-o: 375 295 242 187 149 53 1
Kết quả đỉều trị theo bệnh nhân tự bảo cảo (patỉents- reported outcomes - PRO) được đánh giá
theo chỉ số về Triệu chứng cùa ung thu thặn tiến trỉên trong Đảnh gỉả chức năng của lỉệu phảp
điểu trị (FKSI -Functỉonal Assessment of Cancer Therapy - Advanced Kỉdney Cancer
Symptom Index) vả đánh giá theo Chỉ số chung trong Đánh gỉá chúc năng của Iỉệu pháp điều
trị (FACT— G- Functional Assessment ofCancer Therapy-General).
Các tiêu chí đảnh gỉả của kết quả đỉều trị theo bệnh nhân tụ bảo cáo (PRO) bao gồm chỉ số
FKSI các thang điếm chi tìết hơn cùa FKSI— DRS (FKSI— Disease Related Symptoms), tống
chỉ số FACT- G và bốn chỉ số duớỉ là thể chất tốt [Physical Well Beỉng, PWB], bỉểu hỉện
trong xã hội/ gỉa dình tốt [SociallFamily Well Being, SWB], cảm xúc tốt [Emotional Well
Beỉng, EWB] và tình trạng chức năng tõt [Functional Well Being, FWB]. Chi sỏ FKSI — DRS
đuợc xảc định trưởc là tiêu chí đánh gỉả PRO chính vả được sử dụng để đảnh giả cảc trìệu
chủng liên quan tởỉ ung thu thận do bệnh nhân báo cảo (thiểu năng lượng/ mệt mỏi, đau/ đau
xuơng, gìảm thể trọng, thở ngắn, ho, sốt, tiếu ra mảu) ở 719 bệnh nhân.
Cảc bệnh nhân dùng sunitinib cho thắy các chí số FKSI — DRS tốt hơn rõ rệt có ý nghĩa thống
kê (p 5. 0.0071), tống chỉ số FACT — G (p s 0,0244), PWB (p 5 0,0208), FWB (p s 0,0044)
cũng tốt hơn hẳn so với ở nhóm dùng IFN - n trong mọi đánh gỉá tại cảc thời điếm sau thời
điểm ban đầu cho tới 20 chu kỳ đìều trị. Với PWB, SWB, vả EWB thì mức ý nghĩa thống kê
26
LPD dale' Aug 19. 2014
C ọmer ỉ'iemam
Rejèrence CDS.’ vơrsiun 37.0 Reference CDs dale. Aug 14. 201-J f"
tăng lên trên mửc 0,05 sau chu kỳ 13, chu kỳ 15 vả chu kỳ 10 tương ' n.g Q›ố/sảnh vói sự ichảc
biệt tối thiều có ý nghĩa lâm sảng đã xảc dịnh trước cùa cảc tiêuDs, đánh Ưỉả chính thì sự
khác biệt về điều trị giũa hai liệu phảp về các triệu chứng liên quan 14 thận (FKSI ở tất cả
các thời dỉếm sau thời diềm ban đầu và FKSI— DRS sau chu kỳ J, ngảy !) vả chất Iuợng cuộc
sống nói c11u11<.1(FACT——G ở tất cả cảc thời đìểm sau thời điềm ban đầu) đuợc đảnh giá lá có ý
nghĩa trên lâm sảng.
O Ung Ihư biểu mô Iế bảo lhận vả/hoặc di căn (MRC C J kháng cytokin
Nghiên cứu pha 2 về sunitinib được tiến hảnh trên bệnh nhân đã kháng với liệu phảp cytokin
cùng interleukỉn — 2 hoặc INF-a trước đó CÓ sảu muơỉ ba (63) bệnh nhân dùng liều khởi đằu
50 mg Sunitinib, mỗi ngảy một lẩn theo thời gian bỉều 4/2 (N=63). Tỉẽu chí đảnh giá chĩnh về
hiệu quả điều trị là tỷ lệ đảp úng khách quan (ORR) dựa vảo tiêu chuẩn đánh giá vé đảp ùlng
trong ca'c khối u đặc (RECIST) Cảc tiêu chí đảnh Ưiá phụ bao szồm sự đảnh giá vé thời gian
tới khi khối 0 tiến lriến (TTP), thòi gỉan sống không bệnh lỉến trĩền, độ bền của đảp úng (DR
—— duration ofresponse) và thời gian sống còn toản bộ.
Trong nghiên cứu nảy, tỷ lệ'đáp t'tng khảch quan là 36,5% (khoảng tin cặy 05% = 24,7% -
49,6%), thời gỉan tới khi khôi u tiên triên /thời gian sông không bệnh tiên triên trung bình là
37,7 tuân lê (khoảng tỉn cậy 95% = 24,0 — 46,4 tuân).
Một nghiên cứu đa trung tâm, đơn nhảnh, nhãn mở để đảnh giả hìệu quả vả độ an toản của
sunitinib duợc tìến hảnh trên bệnh nhân ung thu biếu mô tế bảo thặn vả/ hoặc di cãn (MRCC)
dã khảng với ]ỉệu pháp cytokin truớc đó. Có 106 bệnh nhân uống ít nhắt một lỉều 50 mg
sunitinib theo thời gỉan bìêu 4/2. Tỉêu chí đánh giá chính về hiệu quả trong nghiên cứu nảy lả
ORR. Còn các tỉêu chí đánh giá phụ bao gồm thòi gian tởi sự khi khối u tiến triển, thời gỉan
sống không bệnh tiến triến, độ bền của dáp ứng và thời gian sống còn toản bộ.
Trong nghiên cứu nảy, tỷ 1ệ đáp ứng khách quan lả 34,0% (đô tỉn cặy 95% = 25,0% - 43,8%).
Cảc gìá trị trung bình của thời gìan tới khi khôi u tiên triên, thời gỉan sõng khỏng bệnh tìên
trỉên, độ bên cùa đáp ứng vả tỷ lệ sông còn toản bộ chưa xảo định dược.
Các đặc tính dược động học
Dược động học cùa sunitinib vả của sunitinib malat được đảnh giả trên 135 người tình nguyện
vả 226 bệnh nhân có khôi u đặc.
Hấp (hu
Nồng độ tối đa trong huyết tuơng (Cmax) thưòng đạt duợc trong vòng 6 - 12 giờ (Tmax) sau
khi uốnn Thức ãn không có ảnh hưởng tới sinh khả dụng cùa sunitinib.
Phán bố
In virro, sunitinib gắn 95% và chất chuyển hóa có hoạt tính cùa chắt nảy gắn 90% vảo protein
huyết luơng và không phu thuộc vảo nồng độ trong khoảng 100— 4000 nanogamlml. Thể
tích phân bố biểu kỉến (leF) cùa sunitinib lởn (2230 lit) chủng tỏ có phân bố vảo Cảo mô.
Trong khoảng liều 25 — 100 mg, diện tích dưới đường cong biếu diễn nồng độ - thời gìan
(AUC) vả Cmax tảng tỳ 1ệ thuận vởỉ liều dùng.
LPD date: Aug 19. 2014
Conmry; i 'remam
Reference C DS' rerJ'ion 3 7 0 Rẹference C DS dale; Ang l 4. 201-đ
Chuyển hóa /
Giá trị Ki in vifro theo tính toản cho mọi dạng CYP đã nghiên (ỦYPiA2, CYP2A6,
CYP2BÓ, CYP2CS, CYP2C9, CYP2CI9, CYP2D6, CYPZEI , CYP3 l AND CYP4A9ÍÌ 1)
cho thẳy sunitinib vả chất chuyền hóa chủ yếu có hoạt tính nhiều khả năng không có cảc
tương tác thuốc — thuốc có ý nghĩa lâm sảng với các thuốc có thể được chuyền hóa bởi cảc
enzym CYP nêu trên.
Nghiên cứu in vilro cho thắy sunitinib không gây cảm ứng và cũng không ức chế cảc enzym
CYP chinh. bao gôm CYP3A4 (xem Mục 4.5).
Sunitinib chuyển hóa chủ Vếu qua enzym Cytochrome P450, CYP3A4 để tạo nên chất chuyến
hóa chủ yêu còn hoạt tính, sau đó chuyên hóa tỉểp tục cũng qua CYP3A4. Chất chuyến hóa có
hoạt tính chủ yếu chiếm 23 — 37% của tống lượng thuốc trong tuần hoản.
Thái !rù'
1hải trừ chú yểu qua phân (61%); qua thận chi có 16% của liều dùng cho sunitinib và các chẳt
chuyến hóa. Sunitinib vả chắt chuyền hóa chính còn hoạt tính là những sản phẳm chinh liên
quan tới thuốc đuợc xảc định trong huyết tương, nước tìều và phân, chiếm tuong ủng là
91,5%; 86, 4% và 73,8% chắt đánh dấu phóng xạ trong cảc mẫu đuọc kiếm dịnh Các chắt
chuyển hỏa thú yếu được xác định tmnU nuót: tiếu và phân, nhưnư thường không tìm thấy
trong huyết tuơng. Tông độ thanh thải theo duờng uống (CII'F) là khoảng 34— 62 iitlgiờ vởi sự
dao động giữa các bệnh nhân là 40%.
Sau khi những nguời tỉnh nguyện khỏe mạnh nhận một iiều thuốc uống, thòi gỉan bản thải
cuôi cùng (tenninal half life) cùa sunitinib vả chât chuyên hoá chính desethyl tương ửng iả
khoảng 40-60 giờ vả 80—1 10 giờ.
… -› r ' X . … . ;.
Dược đọng học ơ cac nhom đot tượng đạc bzẹt
Suy gan
Sunitinib và chất chuyến hóa chủ yếu chuyến hóa chinh qua Oan Nồng độ thuốc tmng hệ
thống sau khi dùng liểu đơn sunitinib 1ả tuơng đương khi so sảnh gỉữa bệnh nhân suy gan nhẹ
(Child— Pugh Ioạì A) hoặc trung bình (Chiid— Pugh loại B) vởỉ người có chức năng gan bình
thường. Chưa có nghỉên cứu vởỉ sunitinib ở bệnh nhân suy gan nặng (Chỉld — Pugh loại C).
Suy thận
Chưa tiến hảnh nghiên cứu lâm sảng ở bệnh nhân suy chức năng thận. Phân tích dược động
học cho thắy được động học của Sunitinib không thay đối ở bệnh nhân có độ thanh thải
creatinin là 42 — 347 mL/phút. Nồng độ toản thân sau một liều sunitinib là tương tự giữa các
bệnh nhân suy chức năng thận nặng (CLcr < 30 mL/phủt) và các bệnh nhân Với chức năng thận
binh thuờng (CLƯ> 80 mL/ phút). Mặc dù sunitinib vả chầt chuyến hóa chính không đảo thải
bằng thẩm tách mảu trong cảc bệnh nhân ESRD (bệnh thậm giai đoạn cuối), tống nồng độ toản
thân giảm đến 47% với sunitinib vả 31% cho chất chuyến hóa chinh so vởi cảc bệnh nhân với
chức năng thận bình thường.
Đíện tâm đồ
Đã có đảnh giá sụ kéo dải đoạn QT ở nghiên cứu pha 1 với 24 bệnh nhân (tuồi 20— 87) có
khối u ảo tính tỉến triền. Vởi các nỏng độ điều trị trong huyết tuơng thì sự thay đổi trung binh
cùa QTcF tối đa so vói thời điểm ban đầu là 9,6 miligiây (khoảng tỉn cậy 90% vời cận trên lá
LPD dme: Aug 19. 20/4
Counny: 1'i'emom
Reference C DS: version 37_0 Reference C DS dare: Aug 14. 20H
15,1 mi]igiây). Nếu tăng khoảng gấp 2 lần cảc nồng độ điều trị, thì sự thay đổi trung bình của
QTcF tối đa so Với mức cơ bản sẽ là 15,4 mỉiỉgỉây (khoảng tin cặy 90% C] vởi cận trên là
22 ,4 miligiây). Moxifloxaxin (400 mg) dùng lảm đối chúng cho thắy có thay đối trung bình về
QTcF tối đa lả 5, 6 miligiây so với múc ban đầu. Không có bệnh nhân nảo gặp phản úng liện
quan đến QTc lớn hơn độ2 theo tiêu chuẩn về thuật ngũ về các tảo dụng không mong muốn
v3,0. Không có bệnh nhân nảo có ioạn nhịp tim (xem Mục 4.4).
Dược động học trong huyết tương
Sau khi dùng lĩều đơn ở người tinh nguyện khóe mạnh, thời gian bán thải của sunitinib là
khoảng 40 60 giờ và của chất chuyền hóa chủ yếu có hoạt tính là 80 — 110 giờ. Nếu tiếp tục
liều hảng ngảy, thì thẳy sunitinib tích iũy gấp 3 — 4 lần, còn chắt chuyến hóa chủ yếu có hoạt
tính tích lũy 7 — 10 lằn. Cảc nồng dộ trong trạng thải ổn định của sunitinib vả của chẩt chuyển
hòa sẽ đạt được trong 10 — 14 ngảy. Sang Ngảy ]4, tống nồng độ trong huyết tuơng của
sunitinib vả cùa chắt chuyển hóa có hoạt tính là 62.9 — 101 nanogamlmL, tức là đạt nồng độ
đích dự đoán từ cảc dữ liệu tiền lâm sảng đủ để ức chế thụ thể phosphoryl hóa … vitro vả đạt
được sự ổn định / gỉảm sự phảt triến của khối u in vivo. Không có thay đối có ý nghĩa về dược
động học cùa sunitinib hoặc cùa chất chuyến hóa chủ yểu có hoạt tính khi dùng lìên tiếp cảc
liều hảng ngảy hoặc vởi cảc chu kỳ nhắc lại trong các chế dộ iiều thử nghiệm.
Dược dộng học lả tương đươn g trong mọi quần thể bệnh nhản có khối 0 đặc đã nghiên cứu và
ở người tinh nguyện khóe mạnh.
Dược động học ở lừng quẩn rhé
Phân tich cảc dữ Iìệu nhân chủng học về dược động học cho thấy không có ảnh hưởng rõ rệt
vê lâm sảng của tuôỉ, thê trạng, dộ thanh thải creatinin, gỉới tính, chùng tộc, chỉ sô ECOG tởỉ
dược động học cùa sunitinib hoặc của chât chuyên hóa chủ yêu có hoạt tính.
Trọng Ìượng, !rạng rhái hoạt động
Phân tích cảc dữ liệu nhân chửng học về duợc động học cho thắy kh `n /điều chỉnh trong
liều ban đầu theo trọng lượng hay trạng thải hoạt động theo phân loại E
Giới íính
Cảo dữ iiệu sẵn có cho thắy nữ giởi có thế có độ thanh thải (CL/F) thắp hơn nam gỉởi khoảng
30%; tuy nhiên sự khác biệt nảy không yêu câu đỉẽu chỉnh iiêu ban đâu.
Cảc dữ liệu an toản tiên lâm sảng
Trên chuột cống và khi nghiên cứu độc tính với cảc iiều nhắc lại cho tới 9 thảng sử dụng,
thắy cảc tảc động chủ yếu trên cơ quan dích đuợc xác định là ở đuờng tỉêu hóa (nôn vả tỉẽu
chảy ở khỉ), tuyến thuợng thận (tụ mảu vả/ hoặc xuất huyết vỏ thượng thận ở chuột và khi.
còn ở chuột là hoại tử sau đỏ là xơ hóa), hệ máu — bạch huyết (giảm tân sinh tế bảo ở tủy
xưong vả tỉêu mô bạch huyết ở tuyến úc, lách vả hạch bạch huyết), tụy ngoại tỉết (mắt hạt tế
bảo nang tụy kèm theo hoại tử tế bảo), tuyến nước bọt (phì đại nang), khởp xuơng (tăng bề
dảy cảc đĩa tảng trườnƠ `=,), tù cung (teo) vả buổng trúng (giảm phát triến nang buồng trứng).
Cảc hỉện tượng trên xảy ra ở múc nông độ cùa sunitinib trong huyết tuơng có ý nghĩa lâm
sảng. Cảc tảo dụng bổ sung gặp ở những nghiên cứu khác bao gõm kẻo dải đoạn QTc, giảm
phân suất tống mảu thắt trải vả teo ông tinh hoản, tảng chất trung mỏ ở gian mạch thận, xuất
huyết ở ồng tiếu hóa và niêm mạc miệng, phì đại cảc tế bảo tuyến yên. Nhũng sự thay đổi ở từ
29
LPD date: A ng JP. 20I4
Country; l'iemam
Refirence C DS: version 3 7. 0 Reference CDS dale: Aug 14. 20H
cung (teo nội mạc tử cung) vả ở sự lớn lên cùa đĩa xương (loạn sản sụn) có thế liến quan tới
tác dụng dược lý của sunitinib. Nhiêu Ioại trong cảc tác dụng phụ nêu trên iả có phục hôi sau
2 — 6 tưân ngừng diêu trị.
Dộc lính với gen
Tiềm nănƯ độc tinh với gen cùa sunitinib đã được đánh giá in vilzo vả in vivo. Sunitinib không
có độc tính gây đột biến trên vi khuẳn sữ dụng sự hoạt hóa chuyền hóa ở gan chuột cống.
Sunitinib không gây sai lạc cẳu trúc nhiễm sắc thế in vilro ở tế bảo lympho bảo mảu nưoại
biên nguời. Tinh đa bội (sai lạc số nhìễm sắc thề) đuợc quan sát in vífro ở tế bảo lympho máu
ngoại biên nguời, ở cả trường hợp có hoặc không có hoạt hoả chuyến hoả. Sunitinib không
]ảm phá vỡ nhiễm sắc thể ở tùy xuơng chuột công in vivo. Chua có sụ đảnh gỉả với Chẳt
chuyền hóa chủ yếu có hoạt tính về tiềm năng gảy độc trong di truyền.
Độc tính gáy ung thư
Trong một nghiên cúu 1 thảng, dùng thuốc qua ống thông đường uống, đánh giá các khoảng
liều dùng hảng ngảy liên tục (0, 10, 25,75 hoặc 200 mgỉkg/ngảy) ở chuột nhắt nhận gen
rasH2, dã gặp u bìểu mõ vả tăng sản tuyến Brunner ở tả trảng khi dùng lìều cao nhất (200
mglkg/ngảy).
Một nơhỉên cúu về độc tính gây ung thư kéo dải 6 thảng, dùng thuốc qua ống thông đuờng
uống, dùng liếu hảng ngảy (0, 8, 25,11ay 75 [giảm xuông 50] mg/kgfngảỵ) đuợc tiến hảnh với
chuột nhắt nhận gen rasH2 Các khối u ảc tính ở dạ dảy- -ruột, tãng tv lệ u mảu ác tinh vả! hoặc
sự tăng trưởng bất thuờng của các tế bảo tiết niêm mạc dạ dây đã đuợc quan sát ở liều >25
mg/kg/ngảy sau thời gian 1 hoặc 6 thảng (>7, 3 lần diện tích dưới đuờng cong ở các bệnh nhân
được nhận liếu khuyến nghị hảng ngảy).
Trong một nghiên cứu về độc tính gây ung thư kéo dải 2 năm trên chuột cống (0; 0,33; 1 hay
3 mg/kg/ngảy) dùng sunitinib trong chu kỳ 28 ngảy sau đó nghỉ 7 ngảy, cho thắy có hìện
tuọnƯ phảt trỉến u và tãng sản bẩt thuờng trong tủy thượng thận của chuột cống đục nhận liều
3 mglkglngảy sau >] năm dùng thuốc (>7 8 lằn dìện tich dưới đưòng cong ở cảc bệnh nhân
được nhặn liếu khuyến nghị hảng ngảy). Ung thư tuyến Brunner xảy ngtỆẩ/ó trăng ỏ lỉều >
] mglkg/ngảy ở chuột cải vả 3 mg/kgf ngảy ở chuột đực, và việc tăng sa t 1UỜI'W tế bảo
tiết nhầy rõ rệt ở dạ dảy với liều" J mgku/ ngảy ở chuột đực, tương ứng với_ > 0, 9; 7, 8 vả 7, 8
lẩn diện tích dưới đường cong 6 cảc bệnh nhân duợc nhận liếu khuyến nghị hảng ngảy. Chưa
rõ mối liên hệ cùa cảc kết quả về độc tính gây ung thu quan sảt được ở chuột (nhận gen
rasH2) vả chuột cống với việc điều trị bằng suitinib trên người.
Đỏc lính Irẻn sựxinh sản vả phả! (riển
Không thắy ảnh huởng trên sụ sinh sản của chuột cống đực, dùng thuốc 58 ngảy truớc khi
giao hợp với chuột cải chưa dùng thuốc. Cũng không thắy ảnh hưởng trên sư sinh sản khi cho
chuột công cái uống thuốc 14 ngảy trước khi giao hợp với chuột công đục không dùng thuốc,
ở ]ỉểu có thể đạt nông độ phơi nhiễm toản thân gảp khoảng 5 lẩn ở người. T uy nhỉên, nghỉên
cứu về độc tính khi dùng Iiều lặp lại được tiến hảnh trên chuột cống và khi, có ảnh hưởng tới
sự sinh sản động vật cải dưới dạng thoải triển nang noãn, thoải hóa hoảng thề thai nghén, thay
đổi nội mạc tử cung, giảm cân nặan cùa tử cung và buồng trúng với mủc nồng độ toản thân có
ý nưhĩa iâm sảnư. Hơn nữa, nưhiên cúu độc tính với cảc iiều nhẳc lại trên chuột cống, thấy
ảnh hưởng trên sự sỉnh sản chuột đục biểu hỉện dưới dạng teo tinh hoản, giảm tinh trùng ở
mảo tinh hoản vả tiêu dạng keo ở tuyến tiễn liệt và túi tinh khi nồng độ phơi nhiễm trong
30
6.2
6.3
6.6
LPD dam: Aug ỉ9. 20H
C oxmny: l'i'elnam
Rglìzrence CDS: version 3 7,0 Reference C`DS dale: Aug 14. zou
huyết tương cao gấp 25 lần nồng dộ phơi nhiễm toận thân ở nguời. Khỏng phải mọi tảc dụng
gặp ở chuột đực đã đuợc phục hổi vảo giai đoạn Cuối cùa thời kỳ bình phục (6 tuần).
Đối với chuột cống, tỷ lệ tử vong phôi thai liên quan tới thuốc dã cho thắy có giảm rõ rệt về
số lượng thai sông sót tăng số thai bị tỉêu (tiêu sớm và tổng sồ), tu~ong ứng vói tảng sảy thai
sau khi trúng đă lảm tố và tồng cộng số lượng mắt lứa đẻ là 8728 chuột cải có thai khi nông độ
thuốc trong huyết tưong cao gấp 5 ,5 lần Iiều phơi nhiễm toản thân ở nguời. Trên thỏ, có sụ
giảm trọnơ Iuợng tử cung cùa thò có thai và giảm số lượng thai còn sống do tăng số Iuợng thai
bị tiêu (tiếu sớm và tống số), tãng sảy thai sau khi trúng đã ]ảm tố và mất lứa đè 6 4/6 thỏ cái
có thai với nổng dộ trong huyết tuơn0 cao gấp 3 lằn nồng độ phơi nhiễm toản thân ở người
Dùng sunitinib trên chuột cống cái trong giai đoạn hinh thảnh cơ quan của thai có gây ra tảc
động trên sự phảt trỉền cùa thai vói Iiều mỏi ngảy_ > S mglkg bao gõm tăng tỷ lệ dị dạng khung
xương cùa thai, chủ yếu biếu hiện ở sụ cốt hóa chậm ở đốt sống thẳt lưng vả đốt sống ngục.
Tảc động trên sự phải triền cúa chuột cống được phảt hiện ở 1ỉều trong huyết tương cao gắp 6
lần nồng độ phơi nhiễm toản thânở ơngưòi. Trên thỏ, tảo dụng trên sự phát triến biếu hiện ở
sụ tảng tỷ lệ sứt môi khi phơi nhiễm thuốc ở nồng độ tương đương với nồng độ dùng trên
lâm sảng, còn sút môi vả nút khe vòm miệng khi nổng độ huyết tưong gâp 2,7 lần nồng độ
phơi nhỉễm toản thân ở người.
Chưa tiến hảnh nghiên cứu dẩy đủ về dột: tính trên sự phảt triến phôi thai cùa thò vì những tác
động trên phôi thai đă được chứng minh rõ rảng trên chuột công và trong cảc nghiên cứu sơ
bộ trên thò.
CẢC ĐẶC TỈNH DƯỢC HỌC
Danh mục tả dược
Mannitol, Croscarmellose natri, Povidon, Magnesi Stearat, nước tinh khỉết (nếu cộ).
Vỏ nang (Sutent 12,5 mg) chửa oxid sắt đò, titan dìoxid, gelatin. , I
Vỏ nang (Sutent 25 mg) chứa oxid sắt đen, oxid sẳt đỏ, oxid sắt vảng, tiềễẵềhểỉd, gelatin.
Vỏ nang (Sutent 50 mg) chứa oxid săt đcn, oxid sãt đỏ, oxid sắt vảng, titan dioxid, geiatin.
Tương kỵ
Không.
Thời hạn sử dụng
36 thảng kể từ ngảy sản xuất.
Thận trt_mg đặc biệt khi bảo quãn
Bảo quản dưới 30°C.
Tính chẩt và dung lượng cũa bao bì đóng gói
Sutent 12,5 mg; 25 mg; 50 mg
Hộp 1 lọ HDPE chứa 28 viên nang.
Lưu ý dặc biệt về tiêu huỷ
Không có yêu câu đặc biệt.
3/
LPD dam: Aug !9. 2014
Cowmjl: l'1'emam
Reference C DS: version 37. 0 Reference C DS date: AUg M 2014
Tiêu chuẩn: Nhà sản xuât.
Nhã sản xuât:
Pfizer Italia S.r.i., '
Localita Marino del Tronto, 63100 li iceno, Y.
®Nhăn hiệu đã dăng ký
LPD date: Aug 19, 2014
Reference CDS date: Aug 14, 2014
TUQ. CỤC TRUỞNG
P.TRưỞNG PHÒNG
<Ả/ỷaẩếfi e.7fễlẫl e7fâgy
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng