














U
BỘ)
CẸCQLẢN
ĐÃPHÊ
Lân dảuzẮẨ.`
…ẹ zcw
@… AbLYJLv mm …
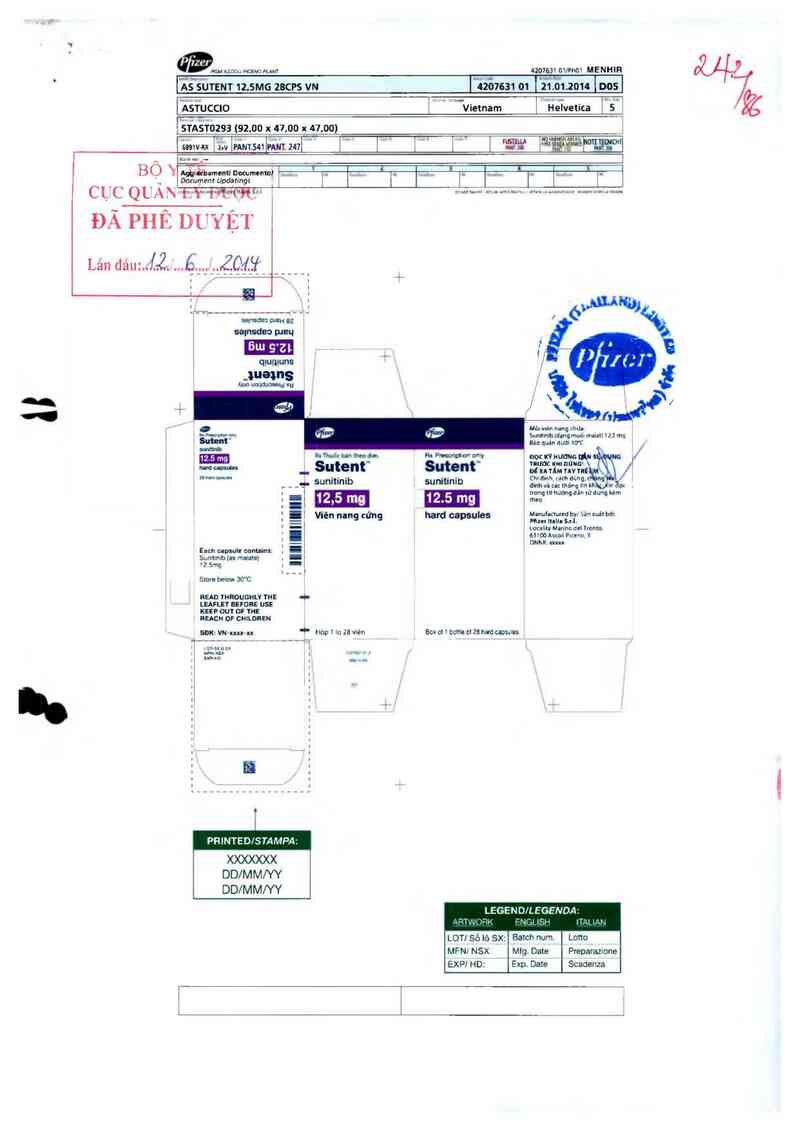
lẤểéùTENT 12.5M6 zacvs vu
Ỉ`4231631 … FẫỄ1.zou Ỉnos |
420763101l9mt MENHIR
Ắsfuccto
è…vu l`i.v lum.sn lum. ml
num._…
'sz'sTozsa tsz.oo x a_7_.oo x u.oo)
] |
Ý ` u wVietnam
i iWhÊỆỆỦẺỆ
%
] viieivetica ] 5 _
. . . . _ ]
DotuhuemUfflĩings LĨỀ ' ì` I I* 1 I__ Ll… ’ 1. ]
f+fWWỉi
DUYỆT
ss)nadươ MH ga
samsdeo pueq
qỊUiìiuns
.…lllĐlnS
Am xme …
…W…
SM“
iMffl
…clpulee
a…unm
Esch upsuln nonMíns:
Sunnmib (as mama)
12 5mg
Store below 30"C
READ TNROUGNLV TNE
LEAFLET BEFORE USE
KEEP OUT OF TNE
i REACH OF CNILDREN
SĐK: VN-uu-u
xonuns:
ưhunst
nơ…u
-._.T
*
PRINTED/STAMPA:
XXXXXXX
DD/MM/YY
DD/MM/YY
Ru M um mm ao.
Sutent
sunìtỉnib
Viên nlng cứng
4- Hỏpi in za vỉén
...... h
,J..tM
Iu ….
Rx Prnscriplaon oncy
Sutent`
sunitinib
hard capsules
Ecz ot \ bom: oi 26 hard unsues
LEGEND/LEGENDA:
LOTJ_S_ô ió sx:
MFNJ NSX
EXP] HDÊ
ma. …… nang d….
Sunmnih idanq muủv maiall 11,5 mq
BA» quln dưới ìưC
' "
nọc Kỉ Hưówc W s ng ›/
TIƯÓC KNI ũÍING' \
ocnrA…nvne \ /
c… đ…h, rảẫỉ…
m4> mc...qu Ế.mẵũ »on
WỀ Ê.… Ê~N ỄH nin… Êm… Ễu… ÊH nin,
U….mmsm … Eẳ. …s ..›3. %… Ẻ…Ẻ ảũr…ửẵ
…ỉi -- J
>nuốẵẵmẵ. UoÊẵoẵầ ỉẵl Ễ … J
Doẫnầ Sỉmuữbu
nẵ~ẫăỄ Ể:u mã... .ẳẵĩẫ
g.…%ẹ
5 81.8 oẵẫ
Ềẳ ỉ ỄỈI …».mẵn
…
ảa.m
A
Boi 865 86 | W
ỉễẽã . mẵoẵ …
Ink ỄI ma...S . Ể:ầz…ư …… W
>Se. vẫ. Ể
o … M
Ế w … ……Ề
:nì ãoiou | N D D
N i
ầoẵfflẺ .… wo Inì onuocĩo … W
……
rmO mZD ….mom. ẹDz
rO...… Un…inz ẫ. roỂ
an… .ễ Dnỉ ẩỄẵo
me .mỗ. Onỉ moẫỄ
…. u
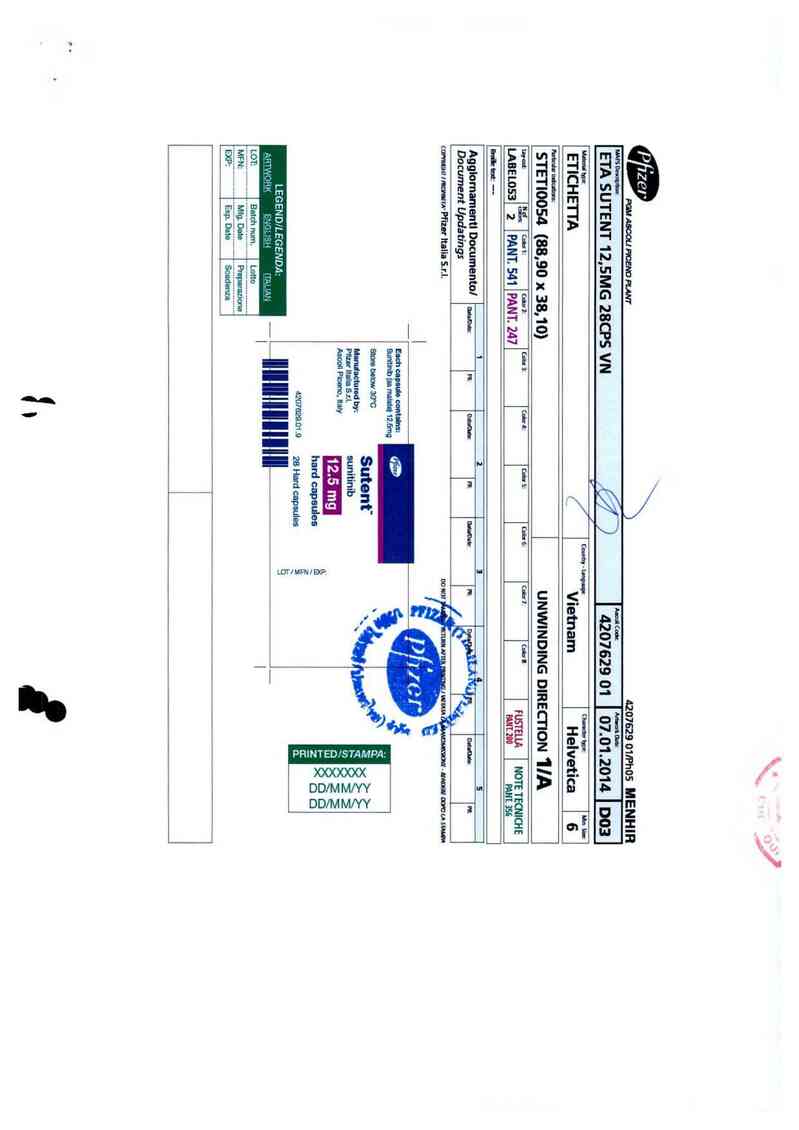
Ll’D Ĩllle .Ỹumlnuh malule
(`oumry i'm…am LPD dam II lJec 3012
Reference t"DS 33 0 Reference t`DS dale 05 Dec 2111]
Rx
SUTENTTM
CẨNH BÁO ĐẶC BIỆT:
Chí sư dụng thuôc nảy theo đơn.
Khỏng dùng quá liều đã dược chỉ định.
Đọc kỹ hưởng dẫn sử dụng trước khi dùng.
Hãy tham khảo ý kiển bảc sỹ để có thêm thông tin.
Hãy thỏng bảo cho bác sỹ nếu xáv ra bất kỳ tác dụng ngoại ý nảo.
Không sư dụng thuốc đã quá hạn dùng
Đê thuốc ngoải tầm vởi cụa trẻ em.
4.2.
TÊN SẢN PHÀM
SUTENT
TtJÀNH PHÀN ĐỊNH LƯỢNG VÀ ĐỊNH TÍNH _
Môi vỉên nang chứa l2.5 mg; 25 mg hoặc 50 mg sunitinib (dưới dạng muỏi malat)
DẠNG BÀO CHẾ
Vỉên nang củng
ĐẶC TÍNH LÂM SÀNG
. Chỉ định điểu trị
Sunitinỉb được chỉ định điều trị khối u mỏ dệm duờng tìêu hóa (GIST- gaBừqầỀẹ ịẦịẵỡf/lal stromai
tumor) sau khi thắt bại đỉếu trị bằng imatìnib mcs_vlat do bị đề khảng hoặc khỏn unơ nạp (xem
mục 5 l).
Sunitỉnib còn dùng điều trị ung thư biều mỏ tế bảo thận tiến triến và .J’ hoặc di căn (MRCC -
metastatỉc renal cell carcinoma) ở những bệnh nhân chưa được dùng thuỏc (xem mục 5. | ).
Sunitìnìb còn dùng diều trị ung thu biếu mô tế bảo thận tỉến triền vả hoặc di căn (MRCC) sau
khi thât bại về điêu trị dựa vảo cytokin (xem mục 5.1 ).
Liều dùng và phương pháp sử dụng
Liều khuyến cảo cúa sunitinib lả uỏng một lần dụy nhất 50mg mỗi ngảy, dùng trong 4 tuần
lìến tiẽp theo iả thời gian nghỉ 2 tuần (thòi gian biều 4/2) đề gôm chu kỳ trọn vẹn là 6 tuần.
Có thể uống sunitinỉb cùng hoặc không cùng thức ăn.
Khi quẻn không uống một Iiều, bệnh nhân không được uống lìều bổ sung. Bệnh nhân cần
dùng liêu thông thường đã được chỉ định vảo ngảy hôm sau.
Thav đỗi Iỉễu
Độ un Joản vả dung nạp: thay đối liều từng nấc 12 5mg được áp dụng căn cứ vảo độ an toản
vả sự dung nạp cùa từng cá thế để dùng tởi 7Smg hoặc xuống 25mg.
Dừng lỉều có thế được yêu cầu dựa trên độ an toản và sự dung nạp cùa từng cá thế.
Page I of25
h
!!
Ổ`
LPD 7’11/e Simllntlh malale
(`omnrt l'lelnom LPD dale Il Dec 201 2
Reference ('05 3." 0 Reference CDS dale~ 05 Dec 2013
4.3.
4.4.
Ếcchẽ gảt cum ứng C )P3A-I
Phối hợp sunitinib với các chắt gãy cám ứng mạnh CYP3A4 như rifampicin thì cần trảnh
(xem mục 4.5). Nếu không thế trảnh phối hợp thì liều sunitinib cân tảng theo từng nắc
125_mg cho tởi liều tối đa lả 87 5mg môi ngảy, dựa vảo theo dõi cân thận về sự dung nạp
thuôc.
Phối hợp sunitinib với các chắt ứcchế mạnh CYP3A4 như ketoconazol thì cần trảnh (xem
mục ái.5). Nêu _không thê tránh phỏi hợp. thì cân giám Iiẻu sunitinib theo từng nâc cho đên
iiêu tôi thiêu mòi ngảy lả 37.5mg.
Khuyến cảo nẻn chọn thuốc thay thế mà không có hoặc có rắt ít tiềm nảng gây cảm ứng hoặc
ức chê CYP3A4 đê phôi hợp với sunitinib.
Với trẻ em:
Chưa xác định được độ an toản vả hiệu iực cùa sunitinib ở bệnh nhi.
Với nơười cao tuồi:
Khỏng đòi hoi chính Iiếu ở bệnh nhân cao tuối. Có khoảng 34% số ngưởi trong cảc nghiên
cứu lâm sảng về sunitinib iả > 65 tuối. Khỏng có khảc biệt có ý nghĩa vê sự an toản hoặc hiệu
lực thuốc giữa bệnh nhân trẻ tuõi vởi cao tuỏi.
Suv gan:
Không cần điều chinh liếu khi dùng sunitinib cho bệnh nhân suy gan nhẹ (ChiId-Pugh loại A)
hoặc trung bình (ChiId-Pugh ioại B). Chưa có nghiên cứu sử dụng sunitinib ở bệnh nhân suy
gan nặng (Child-Pugh Ioại C) (xem mục 5.2).
Suv thân: \
Không cẳn điều chinh iiều khởi đầu khi dùng sunitinib cho bệnh nhân suy thậixt nặng)
hoặc cho bệnh nhản bị bệnh thận giai đoạn cuối đang phải thẩm tảch mảu. Việc`đ1cu chinh
Iiều dùng tiếp theo nên dựa vảo độ an toản và khả năng dung nạp của mỗi bệnh nhân.
Chống chỉ định _ _ ` '
Cânt dùng sunitinib cho bệnh nhân quả mân cảm vởi sunitinib vả bât kỳ thảnh phân nảo cùa chẻ
phâm.
Cảnh báo đặc biệt và thặn trọng khi sử dụng
Da vò mỏ
Đối mảu da. có thế do mảu (vảng) cùa hoạt chẩt là hiện tượng có hại chung liên quan tới thuốc
và gặp ở khoảng 30% số bệnh nhân. Bệnh cần dược cảnh bảo là sự mắt sắc tố da hoặc tóc có thể
gặp khi dùng sunitinib. Những tảc dụng khảc trẻn da có thể gặp lá khô, dảy vả gảy da. vết phòng
hoặc có khi phảt ban ở gan bản tay, chân.
Những hiện tượng trên đây không tich lũy, có thể hồi phục và thường không cẳn ngừng điều trị.
Hiện lượng cháy máu vả chay máu khối 14
Các hiện tượng chảy máu được bảo cảo hậu mãi bao gôm tử vong, bao gôm cả xuât huyêt tiêu
hóa hô hắp, khối u, đường tiết niệu vả não. Trong cảc thử nghiệm iân sảng ,chảy mảu khối u
Iiên quan tởi điều trị gặp ở khoáng 2% số bệnh nhân GiST nhũng hiện tượng nảy có thể gặp đột
Page 2 o/25
ìẻ
l.I’D Tillc ,Summub nmlnlc
( ounlrv i mmum LPD dulc Il Dẻ’C .`013
Rc/eremc ( `|tS :; II Rơferenư ( `DS dale 05 Du 30l3
ngột vả trong trưòng hợp cảc khối u ở phôi, có thẻ biếu hiện bằng ho ra máu hoặc xuất huyết
phôi nghiêm trọng vả đe dọa tinh mạng.
Các trường hợp xuất huyết phôi. một vải trưởng họp dẫn đển tư vong. dược quan sát trong cảc
thư nghiệm lâm sảng vả được báo cảo hậu mãi ở những bệnh nhân sư dụng sunitinib đê điều trị
MRCC. GIST vả ung thư phôi tế bảo khỏng nhớ có di căn (NSCLC — mctastatic non-small cell
iung cancer). Sunitỉnib khỏng dược chấp nhận để dùng cho bệnh nhân với NSCLC.
Cảc hiện tưọng xuất huyết gặp 0 18% số bệnh nhân dùng sunitinib ờ pha diều trị mù đỏi cua
nghiên cứu GIST so vởi 17% o bệnh nhân dùng placcbo. Với bệnh nhân dùng sunitinib để chữa
MRCC mà chưa dùng thuốc, thắy có 39% số người có cảc hiện tượng cháy mảu so với 1 1% số
bệnh nhân đùng interferon alpha (IFN — ơ). Có 11 bệnh nhân (3.1%) dùng sunitinib so với 1
bệnh nhân (0.3%) dùng IFN — u có gặp cảc hiện tượng cháy máu iiẻn quan đến thuốc và ớ mức
độ 2 3… 'I`rong số bệnh nhản dùng sunitinib đê điều trị MRCC khảng cytokin. có 26% số người
xuất huyết. Dánh giá thưòng quy hiện tượng nảy cần bao gồm đềm máu toản thẻ và khảm thực
thê.
( )ng liẻu hóa
Hiêm gặp cảc biến chứng tiêu hóa nghiêm trọng có khi gãy tư vong. bao gôm thung ỏng tiêu
hóa 0 bệnh nhãn bị u ác tỉnh trong bụng mà dùngb sunitinib.
( 'a'c hiện lượng tiêu hóa
Buồn nôn. tiêu cháy. viêm miệng. khó tiêu vả nõn lả cảc hiện tượng tiêu hóa Iiên quan tới thuốc
thường gập nhắt. Đỉều trị hỗ trợ các hiện tượng có hại ở đưòng tiêu hóa có thế bao gồm thuốc
chống nôn hoặc chống tiêu cháy.
Viêm Iu_i
Có gặp tảng iipase vả amylase — huyết thanh ở bệnh nhân có khối u rắn mả dùngfsưnitinib Sự
tãng hảm lượng Iipase là nhất thời và thưòng không kèm theo dấu hiệu hoặc rrỉệ ( g viêm
tụy tạng ơ những ngưởi có cảc khối u rắn khảc nhau. Viêm tụy gặp ở 0 4% số bệnh n có khối
u răn. Nếu gặp các triệu chứng viêm tụy hoặc bệnh gan bệnh nhản cằn ngừng dùng sunitinib và
có biện pháp sản sóc hỗ trợ thích họp.
Độc Jinh gun
Độc tính gan đã được quan sảt thấy ở những bệnh nhân điểu trị bằng sunitinib. Cảc trường hợp
suy gan. một vải dẫn đến tử vong. dược quan sát thắy (1 < 1% bệnh nhân có khối u rắn điều trị
bằng sunitinib l`heo dõi các xét nghiệm chức năng gan (nồng độ alanin transaminase [ALT]
aspartat transaminase [AST]. bilirubin) truớc khi bắt đầu điểu trị trong mỗi chu kì điểu trị. vả
khi dược Chi định Iâm sảng Cần ngừng sunitinib khi gập cảc tảc dụng không mong muốn về
gan ở độ J vả độ 4 và khỏng tiếp tục nếu không có giải phảp.
Huyết học
Giảm iượng tuyệt đối bạch cầu trung tính với độ nghiêm trọng mức 3 và 4 có gập ớ 13,1% và
0.9% tương ứng. Giảm lượng tiếu cầu độ 3 gặp ở 4% và độ 4 gặp ở 0.5% số bệnh nhân. Các hiện
tượng trên không tích lũy. có hồi phục và khỏng cần phải ngừng thuốc. Ngoài ra. có những
trường hợp xuất huyết tử vong có liên quan đến giám bạch cằu đã được báo cáo hậu mãi.
l²ugơ 5 tư 25
IPỈ) Tlllé’ Sun…mb mala/e
(`…mlljr Í'wmam LPD dule II Dec 201."
R(ffi’l'ữnfí' (“DS' 32 0 Reference (`DS dulc IJJ' Dec 2012
Cần tiến hảnh đếm mảu toản mé vảo lúc khới đằu mỗi chu kỳ điếu trị cho bệnh nhân dùng
sunitinib.
T im mạch
Đã có cảc báo cảo hậu mãi về cảc biến cố tim mạch, bao gồm suy tim. bệnh cơ tim. rối loạn cơ
tim. trong đó một vải trường hợp từ vong. Trong cảc thử nghiệm lâm sảng. giảm phân xuất tống
máu ở tâm thắt trái (LVEF - left ventricular cjcction fraction) ớ ì 20% vả dưới ranh giới thấp
của bình thường gặp ớ khoảng 2% bệnh nhân GIST dùng sunitinib, ở 4% bệnh nhân MRCC
khảng với cytokin vả ở 2% bệnh nhân dùng placebo. Sự giám sút LVEF nảy khỏng có vé tiền
triến vả thưòng được cải thiện khi tiếp tục điều trị.
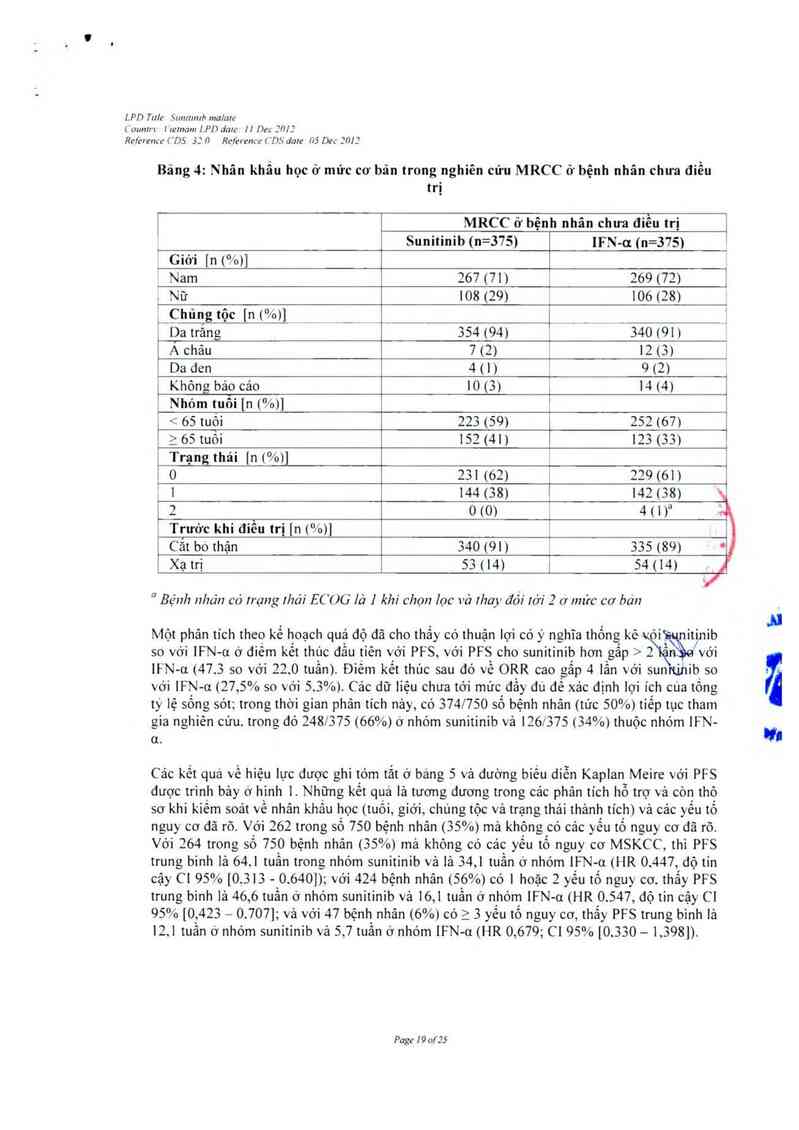
Nghiên cứu MRCC o- bệnh nhân chưa điều trị thấy có 27% số ngưới dùng sunitinib vả 15% số
người đùng IFN — u đã có giá trị LVEF dưới mức LLN. Có hai bệnh nhân (<1 %) dùng sunitinib
được chân đoán lá có bệnh tim xung huyết (CHF — congestive hcart failure).
Các hiện tượng có hại liên quan tới điếu trị về bệnh tim", ' bệnh tim xung huyết" hoặc "bệnh
tâm thẳt trái` đã gặp ớ 0.7% sô bệnh nhân có khối u rắn và ở 1% số bệnh nhân dùng placcbo.
Những bệnh nhân sau đây bị Ioại khói các nghiến cứu lâm sảng về sunitinib:
Người có cảc hỉện tượng tim trong vòng 12 tháng trước khi dùng sunitinib. như nhồi mảu cơ tim
(bao gồm đau thắt ngục nghiêm trọngkhỏng a… định) đã bị bắc cầu động mạch ngoại biên ~
vảnh tim CHF triệu chưng, tai biển mạch não cơn thiếu máu cục bộ thoáng qua hoặc tăc mạch
phôi. Chua rõ bệnh nhân trong các điếu kiện phối họp có thế có nguy cơ hơn vê phảt triến sự rối
Ioạn chức nãng tâm thắt trái do thuốc. Thầy thuốc cân được dặn dò cản nhắc giữa nguy cơ vởi
tiềm nảng lợi ích cùa thuốc. Cảc bệnh nhân nảy cần được theo dõi chu đáo về cảc dấu hiệu vả
triệu chừng lâm sảng cúa CHF mỗi khi dùng sunitinib. Cũng nên cân nhắc đảnh giả định kỳ và
mức cơ bản cưa LVEF mỗi khi bệnh nhân dùng sunitinib. Với bệnh nhân không có cảc yếu tố
nguy cơ về tim, nên cản nhắc đánh giá mức cơ bản cúa phân xuất tống mảu.
Khi có mặt cảc biền hiện lâm sảng cùa CHF, khuxến cáo cần ngừng dùng sunitinib. Liều lượng
của sunitinib cần ngừng vả hoặc giảm ở bệnh nhản tuy khỏng có bằng chứng lảm sảng cùa
CHF nhưng lại có phân xuất tống mảu < 50% vả > 20% dưới mức cơ bản.
Kéo dải đoạn QT Cễ/
Với nồng độ gâp khoảng 2 lần nồng độ điều trị, thì có thẳy sunitinib kéo dải đoạn QT (hiệu
chinh Fridericia) (xem mục 5.2). Không có bệnh nhân có tiêu chuẩn về thuật ngữ lón hơn dộ- 7
về các hiện tuợng có hại v3.0 (CTCAE- Common Tcrminology Critcria for Advcrsc Events)
vế kéo dải đoạn QTJQTc. Sự kéo dải đoạn QT có thể dẫn tới lảm tăng nguy cơ loạn nhịp tâm
thắt bao gồm xoắn dinh Xoắn đinh có gặp ở < 0,1% số bệnh nhân phơi nhiễm với sunitinib. Cẩn
dùng sunitinib thận trọng cho bệnh nhân đã có tiền sủ kéo dải đoạn QT, bệnh nhân dang dùng
thuốc chống loạn nhịp tim hoặc bệnh nhân truớc dãy đã có bệnh tim. nhịp tim chậm hoặc có rối
Ioạn điện giáỉ. Phối hợp với các thuốc úc chế CYP3A4 có thế ]ảm tãng nỏng độ sunitinib trong
huyểt tượng. cũng phải thận trọng và cần giảm Iiều sunitinib (xem cảc mục 4.2 vả 4.5)
T ăng lnl_i ết ảp
Tảng huyết ảp do thuốc sunitinib gặp ở khoáng 16% số bệnh nhân có khối u rắn Cần giảm
sunitinib hoặc tạm ngừng thuốc ở khoáng 2 7% số bệnh nhân Không có bệnh nhân nảo phái”
ngừng diều trị Tăng huvết áp nghiêm trọng (> 200 mmHg tâm thu hoặc 1 10 mmHg tâm trương
gặp ở 4 7% số bệnh nhân. Tăng huyết ảp liên quan tởi thuốc gặp ở 30% sô bệnh nhân dùng
sunitinib dễ điều trị MRCC ở người chưa dùng thuốc so với 6% sô bệnh nhân dùng iFN—o Tăng
huyết ap nghiêm trọng gặp ở 12% bệnh nhân dùng sunitinib mà trước chua dùng thuốc và ở 1%
Poge 4 QÍJJ'
LPD Tnle` .Sunnnnh malalu
fUIIIIIIT' Ỉ`lelnum LPD dale Il Dec 20l3
Reference (`IJS 33 0 Reference (`I`LS' dam 05 Dec 2012
bệnh nhân dùng iFN— a Bệnh nhân cần được điếu tra ioại trừ bệnh tãng huyết áp và phái được
kiếm tra thích đảng Khuyến cáo tạm ngừng điếu trị nếu gặp tăng huyết ảp nghiếm trọng mả
chưa kiếm soát được qua chăm sóc y tê. Có thể tiếp tục đỉêu trị một khi tăng huyết áp đã được
khống chế thích đáng
Rối loạn chức năng giáp !rạng
Khuyến cảo xét nghiệm Iabô về mức cơ bản cụa chức năng gỉảp trạng vả những bệnh nhân nảo
bị suy hoặc tăng chức năng tuyến giảp cần được điều trị theo thực hảnh y tế chuẩn trước khi khới
đầu dùng sunitinib Mọi bệnh nhân cân được giám sảt chặt chẽ về cảc dắu hỉệu và triệu chứng rối
Ioạn chức năng tuyến giảp khi đỉếu trị bằng sunitinib Bệnh nhân nảo có dẳu hiệu vả hoặc triệu
chứng chủ quan về rôi ioạn chức năng tuyên giảp cần được theo dõi về labô và chức nảng tuyến
giảp vả được điều trị theo thực hảnh y tế chuẩn.
Suy chức năng giảp trạng mắc phái do điếu trị cấp cứu có gặp ớ 4% số bệnh nhân GIST dùng
sunitinib so với 1% ở nhóm placebo Suy chức nãng giảp trạng coi như hiện tượng có hại ớ 16%
số bệnh nhân dùng sunitinib trong nghiên cứu MRCC chưa dùng thuốc và cóa bệnh nhân (<
1%) ớ nhóm dùng lFN — u vả 4% sỏ bệnh nhản qua hai nghiên cứu MRCC khảng với cytokin
Nói chung, có 7% số bệnh nhân MRCC khảng với cytokin có bằng chứng hoặc trong lâm sảng
hoặc trong Iabô về suy giảp trạng cắp cứu do thuốc
H iếm gặp các trường hợp tăng nảng tuyến giảp. một số kéo theo giám nảng tuyến giảp trong cảc
thư nghiệm lâm sảng vả qua kinh nghiệm hậu mại.
Co giậl
Trong các nghiên cứu lâm sảng với sunitinib. có gặp co giật ở bệnh nhân có bằng chứng di căn
não qua xét nghiệm X quang Hơn nữa cũng hiếm gặp (< 1%) cảc báo cáo về bệnh nhả bi co
giật và có bằng chứng X quang về hội chứng viêm não trắng phía sau có phục ho ủ
reversible posterior lcukoencephalopathy syndrome). Bệnh nhản bị co giật vả có dấu\hìệu /
triệu chứng chắc chấn vê RPLS, như tăng huyết ảp, nhức đẩu, kém nhanh nhẹn hư hại chức
nãng tâm thần. mắt khá nảng thị giảc, bao gôm mù do vô não, cần được kiêm tra theo dõi y học,
bao gồm theo dõi huyết ảp khuyến cáo tạm ngứng sunitinib Sau khi qua khới, có thể tiếp tục
dùng thuốc dưới sự theo dõi cùa bác sỹ điều trị.
Phẫu ll1uậl Jheo I_ich Ir ình
Đã có những bảo cáo về suy giám khả năng Iảnh vết thương trong khi điếu trị bằng sunitinib.
Khuyến cảo tạm ngừng điều trị sunitinib vì lý do thặn trọng ớ nhũng bệnh nhân trải qua phẫu
thuật lớn theo lịch trinh Có rất it kinh nghiệm Iâm sảng về thời gian sử dụng lại sau khi can
thiệp phẫu thuật lớn. Do đó. quyết định tiêp tục điều trị bằng sunitinib sau can thiệp phẫu thuật
iớn cán được dựa trẻn đánh giá phục hồi lãm sảng sau phẫu thuật.
Hoại lư xương hảm (O VJ)
ON] được quan sảt thẩy không thường xuyến trong cảc thử nghiệm lâm sảng vả cảc báo cảo hậu
mải ớ bệnh nhân điếu trị bằng sunitinib Phần lớn với các trường hợp bệnh nhân đã sử dụng
tnrớc đớ hoặc đổng thời biphosphonates tiêm tĩnh mạch ( | V) thì ON] lả một nguy cơ xác định.
Do đó cằn thận trọng khi sử dụng sunitinib vả biphosphonates tiêm tĩnh mạch đồng thời hay tuần
tư.
Giái phẫu nha khoa củng iả một yếu tố nguy cơ gây ONJ. Trước khi điếu trị bằng sunitinib nên
cân nhắc khảm vả có biện phảp phòng ngừa nha khoa thích hợp. Ô nhũng bệnh nhân được điều
Poge 5 uf25
" f’x
LPD TIIIE Sumlmlh malale
(`…mln l'1emam !PD dale II Dec .’ÚIJ
Rẹference t"DS 33 0 Reference ("DS dale 05 Du 2012
4.6.
trị bằng sunitinib mả trước đó đã sử dụng hoặc đang sử dụng biphosphonates tiêm tĩnh mạch
nên tránh giái phẫu nha khoa nếu có thế.
Hội chúng ly giai khối u ( TLS;
Cảc trường hợp TLS. một số trường hợp từ vong, được quan sảt thấy với tằn suất hiếm trong cảc
thư nghiệm lâm sảng và báo cáo hậu mãi ớ những bệnh nhân điếu trị bằng sunitinib. Bệnh nhân
thường có nguy cơ TLS lả nhũng bệnh nhân có khối u lón trước khi phẫu thuật. Những bệnh
nhản nảy nên được theo dõi chặt chẽ và điếu trị dựa trên cảc triệu chứng lâm sảng.
. Tương tác với câc thuốc khác và câc dạng tương tảo khác
Các thuốc có thề Iảm tãng nồng đô sunitinib trong huvêt tương:
Phối hợp sunitinib với chẳt ức chế mạnh CYP3A4, ketoconazol sẽ lảm tãng 49% Cmax vả
tăng 51% cảc giá trị AUC… cùa phức hợp [sunitinib + chắt chuyến hóa chủ yếu có hoạt tinh]
sau khi dùng iiểu duy nhất sunitinib cho người tình nguyện khoe mạnh.
Dùng sunitinib cùng chắt ức chế mạnh họ CYP3A4 (ví dụ ritonavir. itraconazoi.
erythromycin, clarỉthromycin. nước bưới ép) có thế lảm tảng các nồng độ cúa sunitinib. Cần
trảnh khỏng dùng sunitinib cùng cảc chẩt ức chế CYP3A4 hoặc iựa chọn phối hợp với một
thuốc mả khỏng có hoặc có rất ít tiếm năng ức chế CYP3A4. Nếu lại khỏng có khá năng như
vậy thì cần giám liếu sunitinib (xem mục 4.2).
Cảc thuốc có thề lảm giám nồng đô sunitinib trong huvết tương:
Phối họp sunitinib với chẳt gảy cám ứng CYP3A4, rifampicin, sẽ lảm giảm 2`% Cmax vả
gia… 46% AUC… cùa phức hợp [sunitinib + chắt chuyến hóa chủ yếu có hoạt tính] sau khi
dùng liều duy nhất sunitinib cho người tinh nguyện khóe mạnh.
Dùng sunitinib với các chắt gây cám ứng mạnh họ CYP3A4 (ví dụ phenytoin. dexafmethason.
carbamazepin. rifampicin, phenobarbital hoặc Hyperỉcum perforatum còn gọi John“ s
Won) sẽ có thế lảm giám các nông độ cùa sunitinib Vi vậỵ, cân trảnh phối họpv chẳt
gâv cám ủng, hoặc là chọn phối hợp với một thuốc thay thế mả không có hoặc rẩt ít có tiềm
nãng gảy cám ủng CYP3A4. Nếu lại không có khả năng như vậy thì có thế phái tăng liếu
sunitinib (xem mục 4.2).
Sử dụng cho phụ nữ có thai và thời kỳ cho con bú
Mang thai `
Chưa có những nghiên cứu vệ sự dụng sunitinib trong thai kỳ ờ người.
Nghiên cứu trên mô động vặt cho thắy thuốc nảy có độc tính trên sự sinh sản bao gồm gây
quải thai (xem mục 5.3). Không dùng sunitinib trong thai kỳ hoặc cho phụ nữ khỏng có biện
pháp ngừa thai hữu hiệu trừ khi lợi ích cho mẹ vượt hắn tiếm nãng nguy cơ cho thai. Nếu
dùng thuốc nảy khi có thai, hoặc nếu bệnh nhân trót có thai trong khi đang dùng thuốc thì
bệnh nhân cân được cánh bảo về tiềm năng gây rùi ro cho thai
Liều sunitinib (0, 3; 1 ,0; 3, O mg/kg/ngảy) đã được đánh giá trong cảc nghiên cứu trước vả sau
khi sinh trên chuột cống đang mang thai. Với liếu> lmg/kg/ngảy, sự tảng cãn cùa chuột mẹ
giảm trong quá trình mang thai vả cho con bú nhưng không thắy có sự nhiễm độc thai sản cho
tới tận liều 3mg/kg/ngảy (ước tinh mức phơi nhiễm >2, 3 lần AUC ớ bệnh nhân dùng Iiếu
khuyến cảo hảng ngảy). Ớ liều 3mg/kg/ngảy, quan sát thắy sự giảm trọng lượng cùa chuột
con trong suỏt thời kỳ còn bú mẹ vả sau cai sữa. Không thẳy cò xuât hiện nhiễm dộc ớ iiều
Page 6 of25
LPD Tillc \`unlllmh nmlale
('uunm lielnam LPD dale Il Der .’0lJ
Rofereme (`DS 3311 Reference ( “I)S dale 05 Dec 2/1/J
4.7
4.8
img/kg/ngảy (ước tính mức phơi nhiễm ì 0,9 lần AUC ớ bệnh nhân dùng liếu khuyến cảo
hảng ngảy)
Sinh đe
Căn cứ vảo các kết quả phi lâm sảng, kha nảng sinh sán ctia cả nam và nữ có thế bị anh
hương bới sư dụng sunitinib (xem mục 5.3).
Thời ki cho con bủ:
Sunitinib vả ' hoặc các chẳt chuyến hóa cúa thuốc bải tiết được qua sữa cúa chuột cống mẹ
Chưa rõ sự bải tiết cùa sunitinib vả cùa chẳt chuyến hóa có hoạt tính chủ yếu qua sữa người
mẹ Vì rằng có nhiếu thuốc thái được qua sữa người mẹ vả vi có tiếm nảng cảc phán ủng có
hại nghiêm trọng cho trẻ bú mẹ nên người mẹ khỏng nén cho con bú trong thời kỳ mẹ dùng
sunitinib.
Ẩnh hưởng trên khả nãng lải xe và vận hảnh máy móc
Chua tiên hảnh nghiên cứu về anh hướng cùa sunitinib tới khả nảng lái xe và vận hảnh mảy
móc. Bệnh nhân cân được cánh bảo lá có thế bị chóng mặt trong khi dùng sunitinib.
Tảc dụng không mong muốn
Nhũng hiện tượng có hại liên quan tới thuốc sunitinib mà quan trọng nhất ở bệnh nhản có khối u
lả tắc mạch phối (1%). giám tiếu cầu (1%). chảy mảu khối u (0,9%), giảm bạch cầu trung tính có
sốt (0,4%), tảng huyết ảp (0.4%) (xem ở mục 4.4).
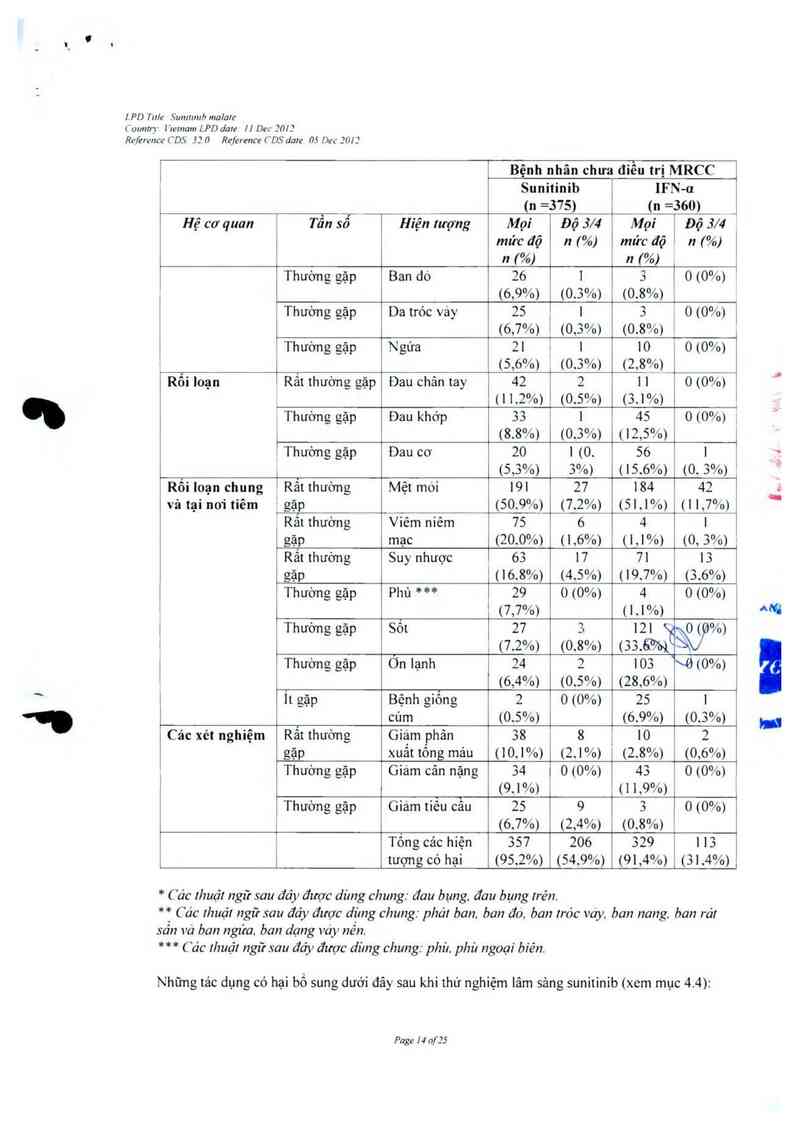
Nhưng hỉện tượng có hại liên quan đến thuốc thường gập (gặp ở > 20% số bệnh nhãn) với mọi
mức độ bao gồm: mệt mòi rỏi loạn tiếu hóa, như tiêu cháy, buồn nỏn viêm miệng. khó tiếu.
nỏn. đối mảu da, phát ban vết ban đo mắt cám giác. viêm niêm mạc ở lòng bản tay chân. khô da.
đôi mảu tóc, suy nhược, rối loạn vị giảc chản ãn vả tăng huyết ảp Mệt mòì, tãng htư<ết áp vả
giam bạch cẳu trung tính là những phản ứng bắt lợi độ` .) thường gặp nghiẽm trọng nhặỄp tảng
Iipase iả phán ủng bắt iợi độ 4 thường gặp nhất ở bệnh nhân có khỗi u rắn
Chảy mảu cam do thuốc lá hiện tượng có hại về chảy mảu thường gặp nhất đã xay ra ớ 8% số
bệnh nhân có khối u rắn. Cháy mảu cam gặp ở gân một nứa sỏ bệnh nhân có khối u rắn mả gặp
các hiện tượng chảy mảu (xem mục 4.4).
Trong các nghiến cứu lâm sảng với sunitinib, có gặp cảc cơn co giật ớ bệnh nhân có bẳng chứng
X quang về di căn não. Ngoải ra, có một số hiếm các báo cáo (<1%) trường hợp xuất hiện cơn
co gíật vả có chứng cứ X quang về hội chứng viếm não trắng phía sau có phục hồi (RPLS), trong
đó có trường hợp tư vong (xem mục 4.4).
(`ác hiện lượng huyếl khối lẳc lĩnh mạch
Có 7 bệnh nhân (3%) trong pha điếu trị mủ đôi cùạ nghiến cứu GIST dùng sunitinib hoặc khỏng
ờ nhớm placebo có gặp các hiện tượng huyêt khôi tăc tĩnh mạch; 5 trong sỏ 7 người bị huyêt
khối tĩnh mạch sâu (DVT- deep vein thrombosis) độ 3; còn 2 người thì ở độ 1 hoặc 2. Bốn trong
số 7 bệnh nhân GIST nảy phái ngừng thuốc sau khi gặp lần đâu DVT Có 13 bệnh nhân (3%)
dùng sunitinib để chữa MRCC (trước chua dùng thuốc nảo), còn có 4 bệnh nhân (2%) trong các
nghiên cứu MRCC khảng với cytokin đã gặp cảc hiện tượng huyết khối tắc tĩnh mạch. Có 9
trong số cảc bệnh nhân đó bị tắc tĩnh mạch phối. 1 người ớ độ 2 và 8 người ớ độ 4. 8 bệnh nhân
bị DVT, trong đỏ 1 người ở độ 1, 2 người độ 2, 4 người ở độ 3 vả ! người ở độ 4 Ngững dùng
thuốc ở 1 truờng hợp. Với bệnh nhân MRCC chưa dùng thuốc mả dùng IFN-u, có gặp 6 (2%)
Page 7 of25
%
LPD TIIỈP Sumllmh maluư
(`ummp- 1`Jemam LPD dale !] Dec 20l3
Reference (`DS 33 0 Reference (`DS dale (15 Dec 2013
hiện tượng huyết khối tắc tĩnh mạch; 1 bệnh nhân (< 1%) ở dộ .) cùa DVT và 5 bệnh nhân (1%)
bị tắc mạch phôi tất cả đến độ 4.
Tắc mạch phối liên quan tới thuốc gặp ở khoáng 1,1% số bệnh nhân có khối u rắn đã dùng
sunitinib. Không có hiện tượng nảo khiến bệnh nhân phải ngừng dùng thuốc sunitinib tuy nhiện
có phái giảm liếu hoặc tạm trì hoãn điếu trị trong vải trường hợp Không có xảy ra tiếp về tắc
mạch phỏi ớ cảc bệnh nhân nảy sau khi tiếp tục điều trị trờ 1ại.
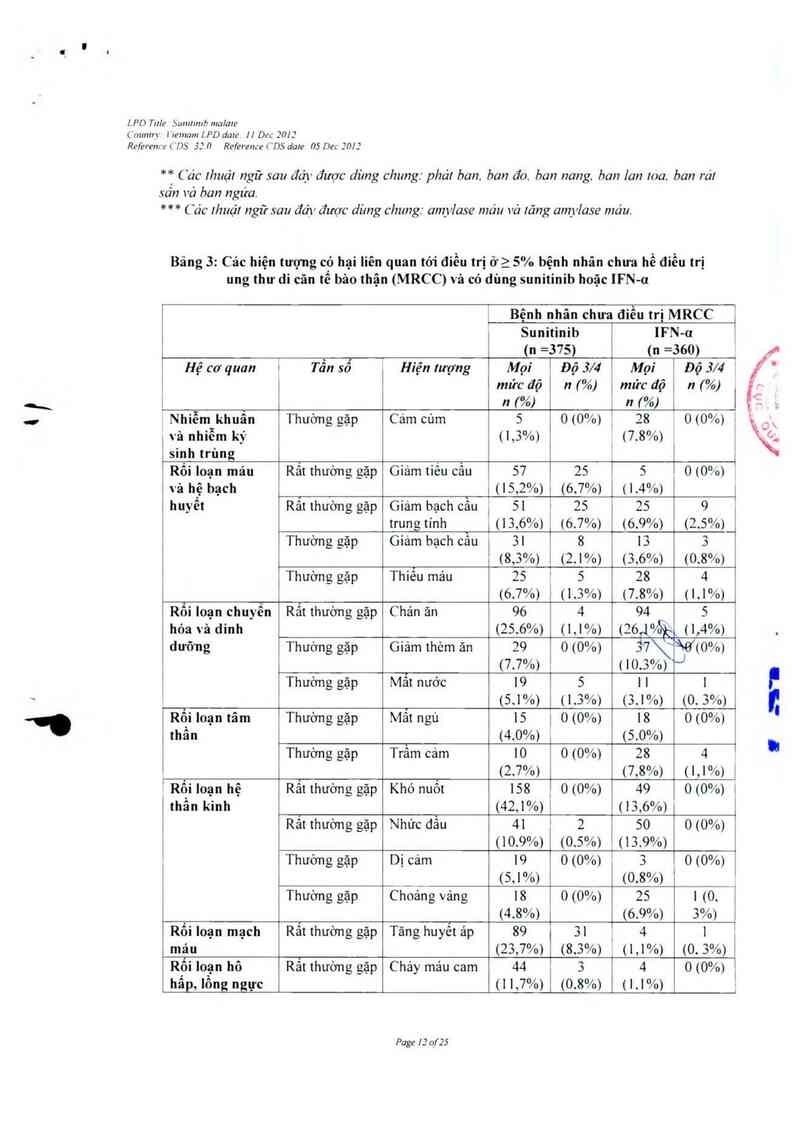
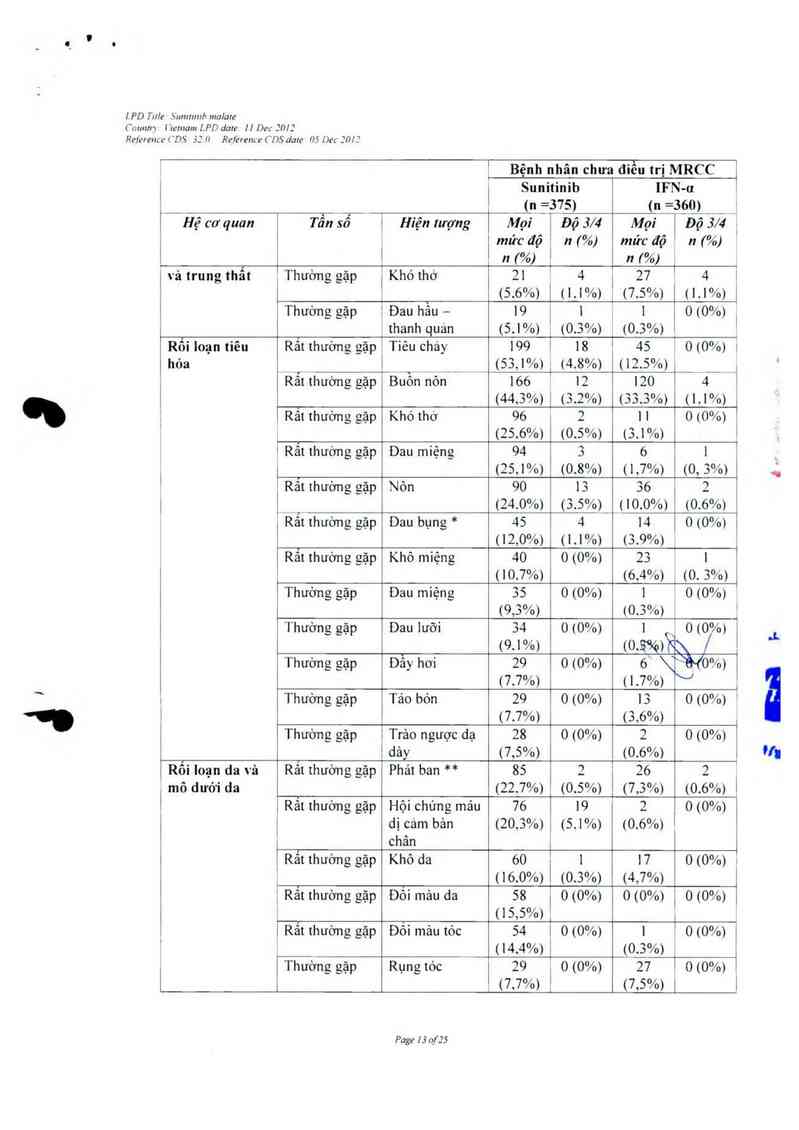
Nhũng hiện tượng có hại liến quan tởi thuốc gập ớ > 5% bệnh nhân có khối u rắn mã đã dùng
sunitinib trong cảc nghiên cứu lãm sảng sẽ được liệt kê dưới đây theo hệ cơ quan, tần sổ và mức
độ nghiêm trọng Trong từng nhóm tân số, cảc tác dụng khỏng mong muốn được sẳp xếp thứ tự
độ nghiêm trọng giám dần.
Tẫn số được quy định như sau: rắt thường gặp (2 1/10), thường gặp (ì 1/100 tới < 1/10). ít gặp
e 171 000161 < 1/100), hiếm (ì 1710 000 tới < 171 000), rắt hiếm (< 17… 000).
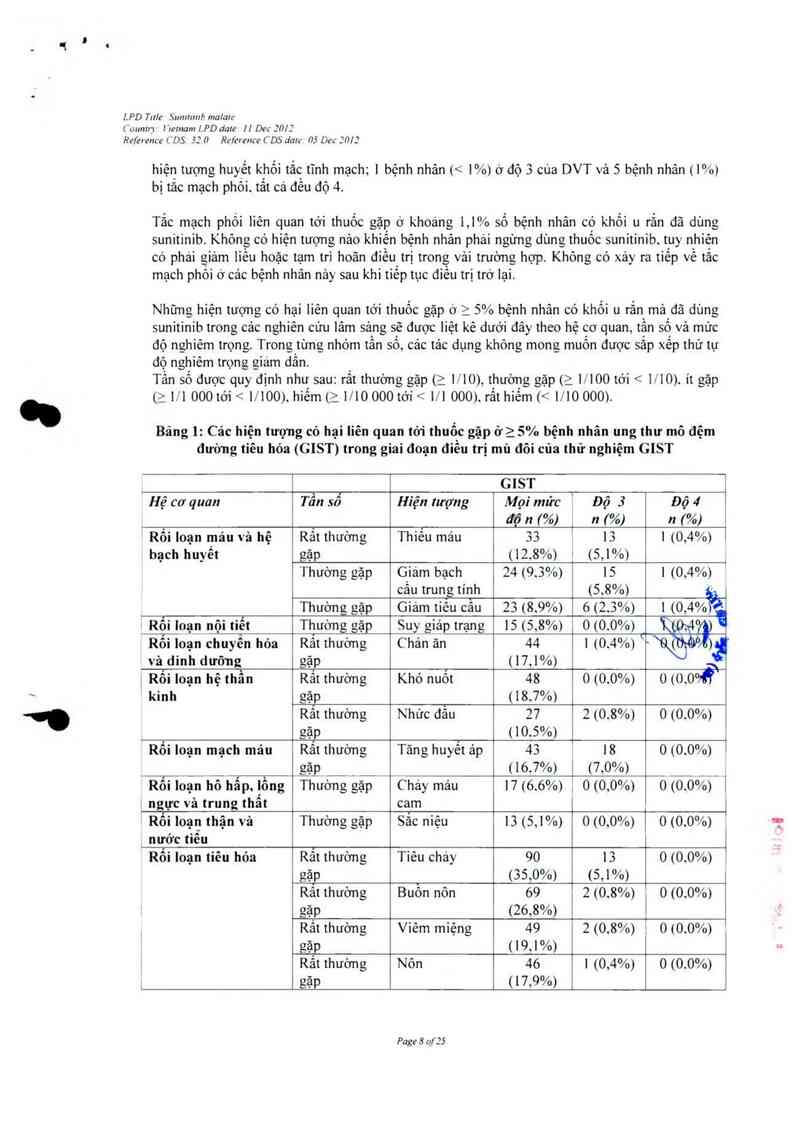
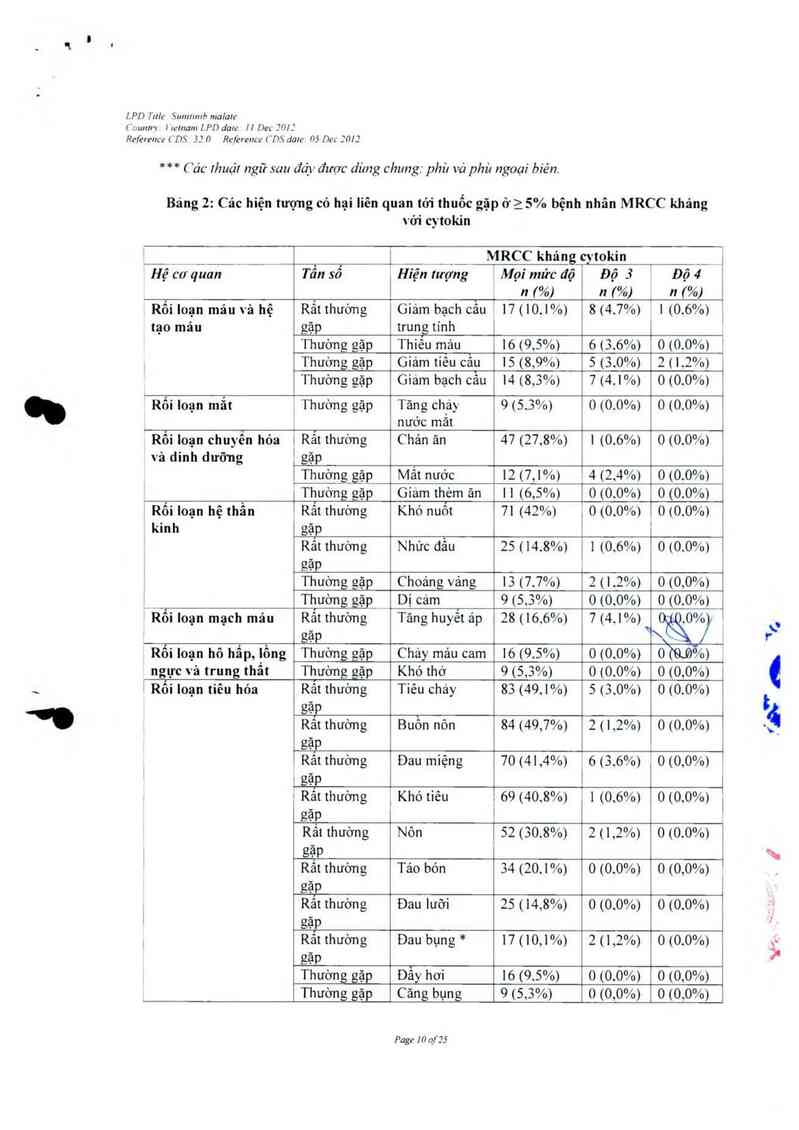
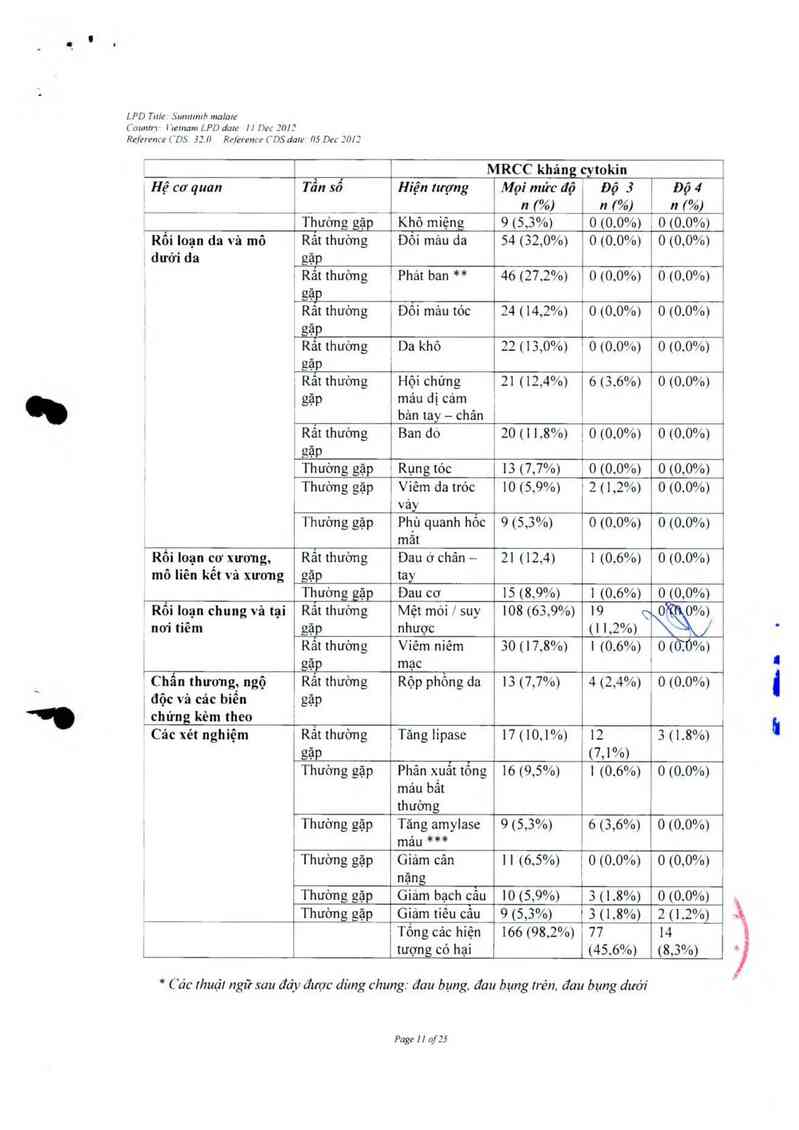
Bảng !: Cảc hiện tượng có hại liên quan tó1' thuốc gặp ớ25% bệnh nhân ung thư mô đệm
đưòng tiêu hỏa (GIST) trong giai đoạn điêu trị mủ đôi của thử nghiệm GIST
GIST
Hệ cơ quan Tẩu sổ Hỉện lượng Mọi mửc Độ 3 Độ 4
độ n 1%) i n 7%) n 7%›
Rối loạn máu và hệ Rắt thường Thỉếu máu 33 1 13 1 l
bạch huyết gặp (12.8%) 1 . 1
Rảt thường Viêm miệng 49 ’ 2 (0.8%) 1 0 10.0%)
gặp (19,1%)
Rắt thường Nôn 46 1 (0,4%) 0 <0.0%)
gặp (17,9%)
Page 8 0125
A
LPD T llle Sumumh malale
(`otmlrv l'ielnam LPD dmt` Il Dec JOIJ
Refcrence (`DS 33 0 Reference t`D.S dale 05 Dec 2(1I2
1
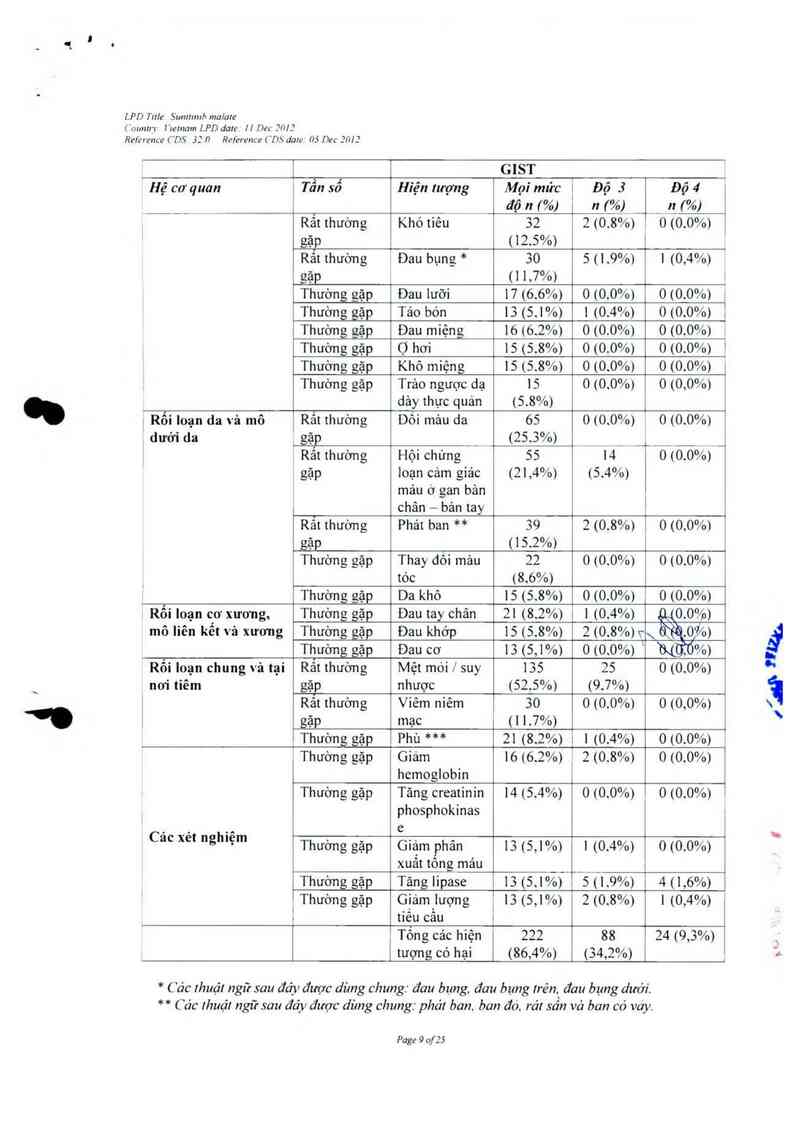
_ GIST
Hệ cơ quan 1 Tẩu sổ Hiện lượng Mọi mức 1 Độ 3 Độ 4
___ ' độn(°/o) '_n(_%j _ __ qi%i
Rẵt thường Khó tiếu 32 2 (0.8%) . 0 (0.0%)
gặp <12.5%) `
Rất thường 1 Đau bụng * 30 5 <1.9%) 1 (0,4%)
gặp ( 1 1,7%) 1
Thường gặp Đau lưỡi 17 (6.6%) 0 <0.0%) o <0.0%) )
Thường gặp Táo bón 15 (5.1%) 1 <0.4%) o <0.0%) 1
Thường gặp Đau miệng 16 (6.2%) 0 (0.0%) 0 (0.0%)
Thường gặp Ọ hơi 15 (5.8%) 0 10.0%) 010.0%> ›
Thường gặp Khô miệng 15 (5.8%) 0 (0.0%) 0 (0.0%) 1
Thường gặp Trảo ngược dạ 15 0 (0.0%) 0 <0,0%) '
dảy thực quản (5.8%) ,
Rối Ioạn da vả mô Rắt thường Dôi mảu da 65 010,0%) , 0 (0.0%) '
dưới da gặp (25.3%) _ _ ___ _
( Rắt thường Hội chứng 55 14 o <0.0%)
gặp ioạn cảm giác (21,4%) (5.4%)
mảu ở gan bản _
chân — bản tay 1 1
Rắt thường Phát ban ** 59 2 (0.8%) 1 o o <0.0%F
IÓC (8.60/0)
Thường gặp Da khô 15 (5.8%) 010.0%1 0 (0.0%)
Rối loạn cơ xương, Thường gặp Đau tay chân 21 (8.2%) 1 (0.4%) `ỌỀ(O.O%)
mô Iiên kết và xương Thường gặp Đau khớp 15 (5.8%) 2 (0.8%) \\ &Ììt.o,%›
Thường gặp Đau cơ 15 (5,1%) 010.0%) ` Ntíó%› ,
Rối Ioạn chung và tại Rẳt thường Mệt mòi / suy 155 25 010.0%) '
noi tiêm gặp nhược (52.5%) (9,7%) |
Rât thuờng Viêm niêm so 0 <0.0%) 010,0%) '
gặp mạc (1 1.7%)
Thường gặp Phù *** 21 (8.2%) : 1 (0.4%) 0(0.0%1
Thường gặp Giảm 16 (6.2%) _ 2 với
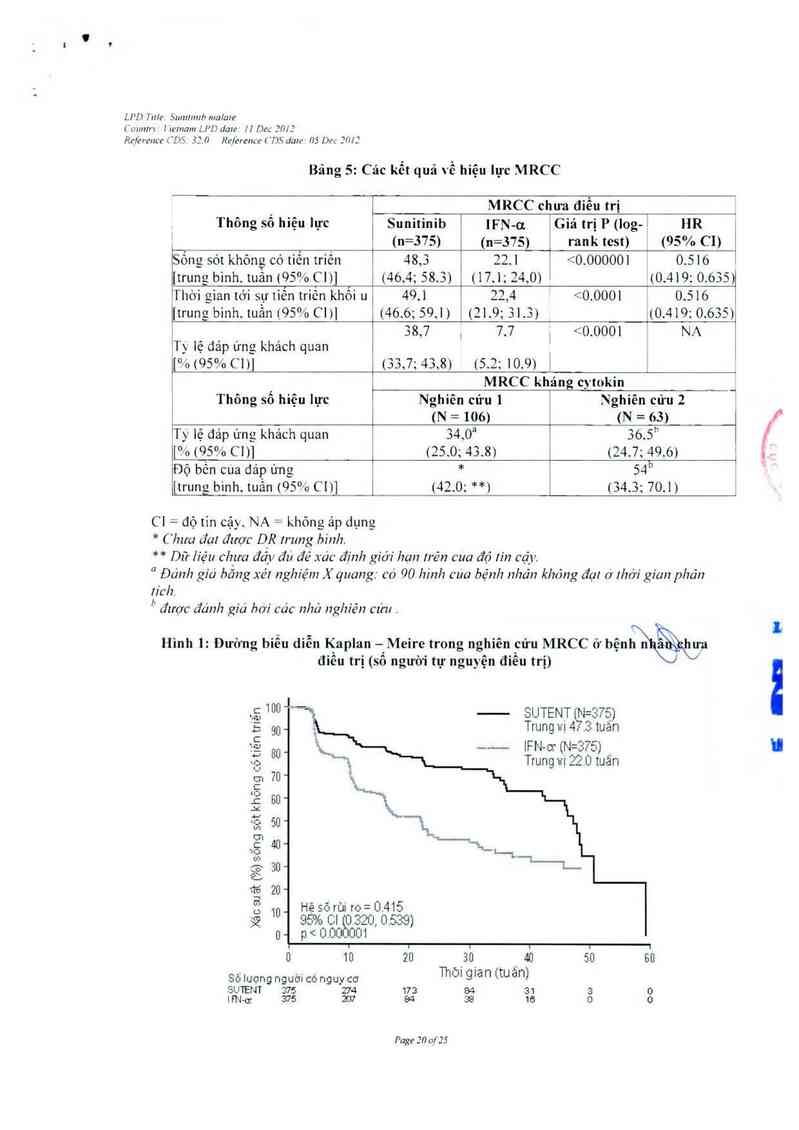
1FN- ơ. (47,` 3 so với 22 0 tuần). Điềm kết thủc sau đó về ORR cao gấp 4 lẳn vớ1 sun ib so
với IFN-u (27,5% so với 5. 3%). Cảc dữ liệu chưa tới mức đầy dù đề xảc dịnh lợi ích của tồng
tỷ lệ sống sót; trong thời gian phân tích nả), có 3747750 số bệnh nhân (tức 50%) tỉếp tục tham
gia nghiến cứu. trong đó 2481375 (66%) ờ nhớm sunitinib vả 126/375 (34%) thuộc nhóm 1FN-
01.
Một phân tích theo kế hoạch quá độ đã cho thấy có thuận lợi có ý nghĩa thống kê «aẫềIịt/inib
2
Cảc kết quả về hiệu lực được ghi tóm tắt ờ bảng 5 vả đường biều diễn Kaplan Meire với PFS
được trình bả) ớ hình 1 Những kết qưả lả tương đương trong các phân tích hỗ trợ vả còn thế
so khi kiếm soát vế nhãn khắu học (tuổi, giới, chùng tộc và trạng thải thảnh tích) vả các yếu tố
nguy cơ đã rõ. Với 262 trong số 750 bệnh nhân (35%) mả khộng cỏ cảc )ếư tố nguy cơ dã rõ.
Vòi 264 trong số 750 bệnh nhân (35%) mã khỏng có cảc yểu tố nguy cơ MSKCC, thi PFS
trung binh lả 64.1 tuần trong nhóm sunitinib vả lả 34,1 tuần ở nhóm lFN-a (HR 0 447 độ tin
cậ) C] 95% [O. 313- 0 6401); với 424 bệnh nhân (56%) có 1 hoặc 2 yếu tố nguy cơ. thắ) PFS
trung binh là 46, 6 tuần ở nhỏm sunitinib và 16,1 tuần ớ nhỏm 1FN-ơ (HR 0 547, độ tin cậy CI
95% [0,423 — 0.707]; vả với 47 bệnh nhân (6%) có_ > 3 yểu tố nguy cơ, thẩ) PFS trung bình là
12 1 tuần ở nhóm sunitinib và 5, 7 tuần ở nhóm 1FN-ư (HR 0,679; CI 95% [0.3 30 - 1 ,3981)
Pơge 19 0125
Ẹ .
&"!
LFD 'I'ule Sumumh malale
t`ounm 1 mua… LPD dme
11 Dec 3013
Rẹfèrencc CDS. 32.0 Refèrence ('DS dau" (15 Dec ."1113
C]
Bảng 5: Các kết quả về hiệu lực MRCC
MRCC chưa điều trị
Thông số 111ệ11 lực Sunitinib lFN-ơ. Giá trị P 7iog… HR
(n=375) (n=375) rank test) (95% CI)
Sống sót không có tiến triền 48,3 22.1 <0.000001 0.516
[trung bình, tuẫn (95% Cl)] (46.4; 58.3) (17,1; 24,0) (0,419; 0.635)
Thới gian tới sự tiễn triên khối u 49,1 22,4 <0.0001 0.516
[trung bình. tuần (95% C] )] (46.6; 59,1) (21.9; 31.3) _170.419: 0.635)
38,7 , 7.7 | <0.0001 NA
T) lệ đáp úng khách quan
[ 11 795% 6 11) 755,7; 45,8) 75.2; 10.9) (
MRCC kháng cytokin
Thông số hiệu lực
Nghiên cửu ]
Nghiên cửu 2
(N =106) (N = 63) |
T) lệ đáp ứng khảch quan 54,0a 56.5“ |
[0f0(95070C1)] (25.0; 43,8) (24.7; 49.6) '
Độ bến cưa đáp ứng * 54b '
{trung bình,tuần (95%C1)1 7420; **) 754,5; 70.1)
= độ tin cậy. NA = không ảp dụng
* Chưa đạt được DR Irung binh.
* * Dữ liệu chưa đẩy đu đẻ xảc định gíới hạn !rên cua độ rín cặy.
“ Đánh giá bằng xét nghiệm X quang: có 90 hinh cưa bệnh nl7án khóng đạt 6 ll7ởi gian phán
!ich.
h được đánh gíá bơi các nhả nghiên cửu .
Hình 1: Đường biễu diễn Kạplan —’Meire trong nghiên cứu MRCC ở bện
điêu trị (sô ngưòi tự nguyện điêu trị)
Xác su âÌ (%) sỗng sót khõng cótiến triển
SUTENT N=375)
Trung 111 4 .3 tuân
1FN o1711=5761
Trung ưị 22,0 tuân
966
40 ..
311“
20 ~
10 Hệ sõrủi ro= 0.415
95% C1 ỄìJÒÙ1 .320 0 539)
n- p< 0.000
010 20 _50_ , 411 50 611
Số lượng người có nguy cơ ThOl glỡf') lỉtuarỦ
SUTENT 376 274 175 154 51 5 15
m… 575 2157 64 @ 16 o 0
Page .’00f25
LPD Tưle Sunnth malule
(`ounlr_v l'1elnam LPD dulc' 11 Dec 3012
Relềrence CDS' 32 0 Re_fèrenre (`DS dale 05 Dec 2012
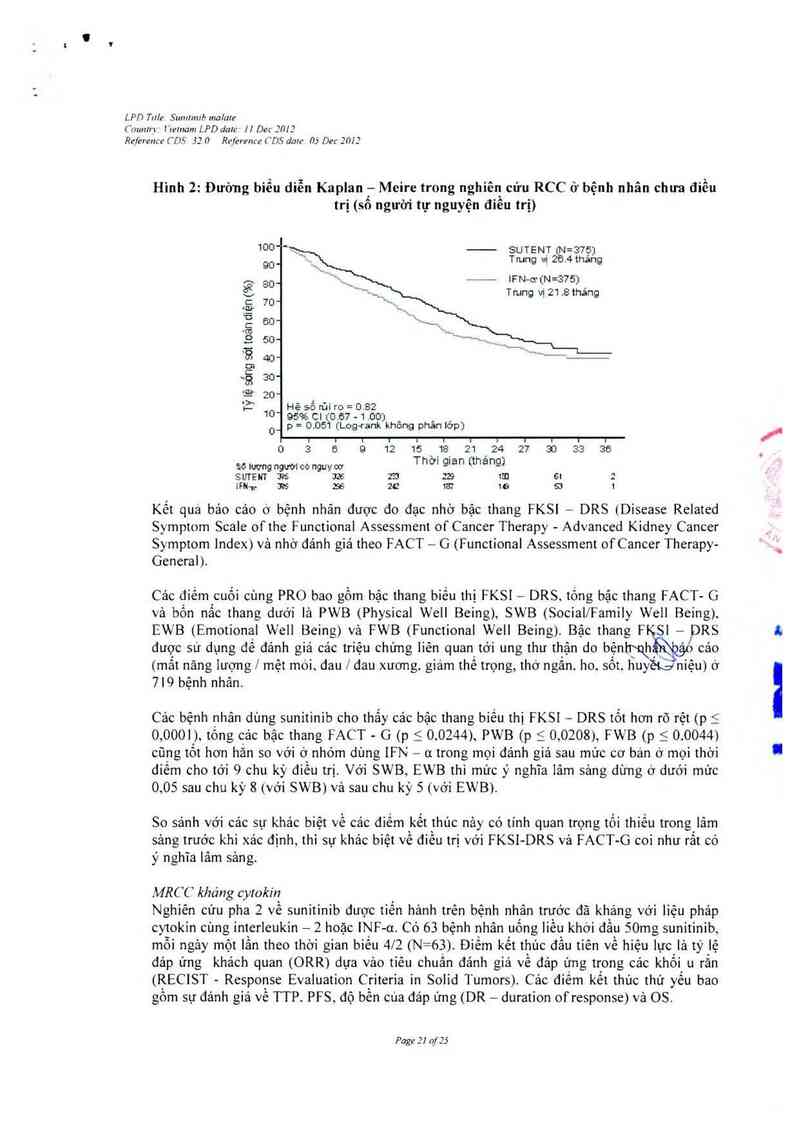
Hình 2: Đường biễu diễn Kaplan — Meire trong nghiên cứu RCC ở bệnh nhân chưa điều
trị (số người tự nguyện điểu trị)
10° ° SUTENT 7Ẻ1= 3.75)
90-1 Tmng vị 2 4’thảng
— 1FN-61714=375)
801
.701
Tmng vị 21 .8 thảng
561 toản diện {%)
CD
D
15 sống
U
0
l
Tỷl
_ Hệ số rủi ro = 0.82
10 95% c1 O.õĩ-1.00J _ , ,
_ p = 0.051 (Lcưg—rank khong phan lơp)
] r t 1 I I l 1 I I I t
0 5 B 0 12 15\_115_ ²1,²4 27 50 55 36
501an ngưMco nguycơ Thơ) glâl't (thang)
SƯTENT 315 JÌ- 23 23 151 61 2
lFH-p 3% 35 2G 137 1é Sì 1
Kết quả báo cảo 6 bệnh nhân được đo đạc nhờ bậc thạng FKSI — DRS (Disease Related
S)fmptơm Scala ofthe Functionai Assessment of Cancer Therapy - Advanced Kidney Cancer
Symptom lndex) và nhờ đánh giá theo FACT — G (Functional Assessment ofCancer Therapy-
General).
Cảc điềm cuối cùng PRO bao gổm bậc thang biếu thị FKSI — DRS, tống bặc thang FACT- G
vả bốn nấc thang dưới lá PWB (Physical W'ell Being), SW'B (Social/Family W'ell Being),
EW'B (Emotionạl W'eII Being) vả FW'B (Functional Well Being). Bậc thang F
được sư dụng để đánh gỉá các triệu chúng liên quan tới ung thu thận do bện hưẵfèQạoms cáo
(mat nang lương/met m01 đauf đau xương, g1am the trong, thơ ngấn. ho sốt. hU)ếkầniệu)ở
719 bệnh nhân
Cảc bệnh nhãn dùng sunitinib cho thấy cảc bậc thang biếu thị FKSI — DRS tốt hơn rõ rệt (p 5
0,0001), tông cảc bậc thang FACT - G (p 5 0.0244), PWB (p 5 0,0208), FW’B (p 5 0.0044)
cũng tốt hơn hăn so với ở nhóm dùng IFN — 11 trong mọi đảnh giả sau mức cơ bản ớ mọi thời
điếm cho tới 9 chu kỳ điếu trị. Với SWB, EW'B thì mức ) nghĩa lâm sảng dùng ở dưới mức
0,05 sau chu kỳ 8 (với SW’B) vả sau chu kỳ 5 (với EWB).
So sánh với các sự khác biệt về cảc điếm kết thúc nả) có tính quan trọng tối thiếu trong lảm
sảng trước khi xảc định, thì sự khảc bỉệt về điếu trị với FKSI- DRS vả FACT- G coi như rất có
ý nghĩa Iâm sảng.
MRCC kháng cytokin
Nghiên cứu pha 2 về sunitinib được tiến hảnh trên bệnh nhân trước đã khảng với liệu phảp
cytokin cùng interleukin— 2 hoặc INF- 01. Có 63 bệnh nhân uống liếu khới đầu 50mg sunitinib,
môi ngảy một lằn theo thời gian biếu 4/2 (N= 63). Điếm kểt thùc đầu tiên về hiệu lực là tỷ lệ
đảp ứng khảch quan (ORR) dựa vảo tiêu chuẩn đánh giả về đảp ứng trong các khối u rắn
(RECIST- Response Evaluation Criteria in Solid Tumors). Các điếm kết thúc thứ yếu bao
gôm sự đảnh giá vế TTP PFS, độ bến cúa đáp ứng (DR— duration ofresponse) vả OS.
Poge 31 of25
LPD Tille Summuk molaw
[ `omm-r I 1emmn LPD dale Il Det 2012
Reference (`DS 32 !) Reference ("DS dale 05 Det 2012
5.2
Trong nghiên cứu nả). thắ) ORR lả 36,5% (95% Cl = 24,7% - 496%), TTP trung bình vả
PFS là 37,7 tuần lễ (95% C1= 24 0- 46,4 tuấn).
Một nghiên cứu đa trung tảm, một nhóm. mớ đế đảnh giá hiệu lực vả độ an toản cùa sunitinib
được tiến hảnh trẻn bệnh nhân MRCC đã kháng với liệu phảp cytokin từ trước. Có 106 bệnh
nhân uống 11 nhắt một liếu 50mg sunitinib theo thời gian biếu 4.12 (N=106). Dìếm ké1 11161: đầu
tiên về hiệu lực trong nghiên cứu nảy lả ORR. Còn cảc điếm kết thủc 1111'1 )ếư bao gổm TTP.
PFS. DR và 05.
Trong nghiên cứu nả), thắ) ORR lả 34.0% (95% C1 = 25,0% - 43,8%). Các giá trị trung binh
của TTP. PFS, DR vả OS chưa xác định được.
Cảc đặc tính dược động học
Dược động học cùa sunitinib vả cưa sunitinib malat được đánh giá trên 135 người tình nguyện
vả 226 bệnh nhân có khỏi u răn.
Hấp thu: , '
Cảc n_ông độ tòi da trong hU)êt tượng (Cmax) thường gặp trong vòng 6 — 12 giờ (Tmax) sau
khi uỏng. Thức ăn không có anh hương tới sinh khả dụng cùa sunitinib.
Phân bô:
ln 1~itro, sunitinib gắn 95% và chất chuyến hỏa có hoạt tính thì gắn 90% vảo protein huyết
tương vả không phụ thuộc vảo nồng độ trong khoảng 100 — 4000 nanogamme. Thế t1'ch phân
bố (Vđ/F) cũa sunitinib lớn (2230 lít) chứng tỏ có phân bố vảo cảc mỏ. Trong khoáng lỉều 25
— 100mg. thắ) diện tích dưới đường biếu diễn nồng độ - thời gian (AUC) vả Cmax tăng t) lệ
thuận với liều dùng.
Chuvến hóa:
Sunitinib chuyến hóa chủ )ếư qua enzym Cytochrome P450, CYP3A4 để tạo nềhềfẵẦc1iuyến
hóa chủ )êư còn hoạt tính, sau đó chuyến hóa tiêp tục cũng qua CYP 3A4 Chât chưỵện hóa có
hoạt tính chủ )ếư chiếm 23 — 37% cùa tông sự phơi nhiễm.
Nghiên cứu in vivp cho thắ) sưnitinib không gả) cảm ứng vả cũng không ức chế cảc enZ)m
CYP chính, bao gôm CYP3A4 (xem mục 4.5).
Giá trị Ki in vin~o theo tinh toản cho mọi dưới — lớp CYP (các CYPIA2, CYP2A6, CYP2Bó,
CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E], CYP3A4/S AND CYP4A9/l 1) cho thắ)
sunitinib vả chắt chuyến hóa chủ yếu còn hoạt tính không chắc có tương tảc thuốc — thuốc có
ý nghĩa lâm sảng với cảc thuốc có thế được chuyến hóa qua xúc tác cũa các enzym CYP nếu
trên.
Đảo thải:
Đảo thải chủ yếu qua phân (61%); qua thận chi còn 16% cùa liều dùng cho chính sunitinib vả
cảc chất chuyến hóa. Sunitinib vả chất chuyến hòa chính còn hoạt tính lả nhủng sán phầm
chính liến quan tới thuốc được xác định trong huyết tương, nước tiều vả phân, chiếm tương
ứng lả 91,5%; 86 4% vả 73. 8% chất đảnh dắu Các chắt chuyến hóa thứ )êư được xảc định
trong nước tiêu và phân, nhưng thường không tìm thắy trong huyết tương Tổng độ thanh lọc
Page 22 o_l'25
LPD Til/e Sunmmh malale
(`ounnị) liemamLPDdale 11 Dec 2012
Reference (`DS 33 0 Reference ( 'DS date (15 Dec 2012
theo đường uống (CIJ’F) lá trong khoáng 34 — 62 litJ’giờ với sự dao dộng giữa cảc bệnh nhân là
40%.
Dươc đóng hoc ơ cảc nhóm đồi lương đăc biẻl
Người sưv gạn
Sunitinib vả chất chuyến hóa chủ yếu chuyến hớa chính qua gan. Những sự phơi nhiễm hệ
thống sau khi dùng liếu đon sunitinib là tương đương khi so sảnh người suy gan nhẹ (Child —
Pugh Ioại A) hoặc trung bình (Child — Pugh loại B) so với người có chửc năng gan binh
thường. Chưa có nghiên cứu sunitinib ở người suy gan nghiêm trọng (Child — Pugh 1oại C).
Suv thân
Chưa tiến hảnh nghiến cứu lâm sảng ở bệnh nhân suy chức nảng thận. Có nghiên cứu. nhưng
loại trừ các bệnh nhân có creatinin — huyết thanh > 2.0 lần ULN. Phân tích dược động hỌC cho
thắ) dược động học của sưnitinib không thay đôi ớ bệnh nhân có tốc độ thanh iọc creatinin
theo tính toản lả ớ trong vòng 42 — 347 lephút.
Điên sinh l)'~ tim
Dảnh giá sự kéo dải đoạn QT ở thử nghiệm pha 1 với 24 bệnh nhân (tuối: 20 — 87) có khối u
ảc tính tiến triền. Với cảc nổng độ điêu trị trong huyết tương thì sự thay đỏi trung bình cưa
QTcF 161 đa với mức cơ bán lả 9,6 miligiây 790% C] - 15,1 miligiây). Nếu tăng khoáng gấp 2
Iẳn cảc nồng độ điếu trị. thì sự thay đồi trung bình cùa QTcF tối đa so với mức cơ bán sẽ lả
15,4 miiigiây (90% C1 — 22.4 miligiảỵ). Moxifloxaxin (400mg) dùng lảm chứng dương cho
thây có thay đôi trung binh vê QTcF tôi da là 5.6 miligiây so vởi mửc cơ bản. Không có bệnh
nhân nảo có gập tảc dụng trên đoạn QTc lớn h 5mgfkg, biếu hiện bằng sự tăng t) lệ dị dạng bộ xương cứa thai.
chú )ếư biếu hiện 0 sự còi hóạ chậm ớ đốt sống thắt lưng và sụn lồng ngục. Tảc dụng phụ
trên sự phải triến cưa chuột cống gặp khi chuột bị phơi nhiễm )ới hả… 1ượng thuốc trong
huyết tương cao gấp 6 lấn hơn ở phơi nhiễm trong lâm sảng.
Trên thơ, tác dụng phụ trẻn sự phảt triến biếu hiện ớ sự tăng t) lệ sủt mỏi khi phơi nhiễm
thuốc với hảm luợng ngang khi dùng trong lâm sảng. còn sứt môi )ả nút khe vòm miệng khi
phơi nhiễm trong hưyết tương với nồng độ gấp 2 ,7 lấn cao hơn khi dùng trong lâm sảng.
Chưa tiến hảnh nghiến cứu quán triệt về độc tính trên sự phảt triến phôi thai cùat
tảc dụng trên phôi thai đã được chứng minh rõ rảng trến chuột cống vả coi như lá ng
sơ bộ trên tho.
CÁC ĐẶC TỈNH nược nọc
Danh mục tá dược
Mannitol, C`roscarmeliose natri. Povidon, Magnesi Stearat.
Tương kỵ
Không.
2.7-
1,,31_d’
Thời hạn s_ửdụng
36 thảng kê từ ngả) sản xuât.
lũ m ""
Thận trọng đặc biệt khi bảo quản
Báo quán dưới 3ODC .
Tính chất và dung iượng của bao bì đóng gói
Sutent 12,5mg; 25mg; 50mg: -
Hộp 1 lọ HDPE chứa 28 viên nang. ` ….
` TRUỞNG
Lưu ) đặc biệt về tiêu huỷ PHÓ CỤC
Khỏng có đòi h61 đặc biệt. ji’ỷa7tjẫn 'Ĩ/ãn ẫÍẩanẫ
Tiêu chuẩn thuốc thảnh phẫm: Theo tiêu chuẩn nhà sân 1…ẩ1.
Nhà sản xuất:
Pfizer Italia S.r.l., _
Localita Marino dcl Tronto, 63100 Ascoli Piceno, Y
Page 25 qJ'JJ'
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng