












ồỀm ỂỄ
ãầỉ›3 mo…Sò
Ế mEãf ỏỉm
Ế ả ì ỀcỄẵ
Ệzỗềê
.…ẳẵaẫ Ễ88 …ỵzzo
xxrẵiz> …sz
iễEoỄ
n…Ễ ẵẫẵ
mE 9… mỡ.…fflầ ……
LL …
cT @
DW nJu…
. 1EJJ
-. TD.D 4…
YN.E I.
..Ả
fflU…n N…… w
Q.1. ..…
C.... ..
.Enỉgum
…ỄxnỉS
…eẫă …g ÊỄ
_ ĐỂ ẵ uzẵỉỉẵễ |
ẳũỄcw~ồỗm l
Í
II
9:31
aẵẵể
ỄÊ eễ.ễ
.……E 0% Em Ễ>Ẹffl
…
ẫẵEẽnNồã
Ế
…ẵsẵẵễ
aE ov mmi.mòzm
. ẫắ%
.oãẫo Ea
ễ… Ẻẵ Ễẽ ỄB !… g
.ẫE EÊ ịa S
Ế :. &…ỉ Iẵ…ề !… c… Eẵ
.…. e… ẳu Eẵ Ễ 8
..!EỄ
Êẵẵẫeẵsãẹạ
.ẵẫồặ
E…Ề s is… ẾEa .ễÊs
.…m: 888 tcẵ ăBỂ. … £ .Ễz
.ẵoẵ uũlưìẳoũầấ
ỈÊ.Ễ
…ẵsễẵ
@ E ct fflỬcm>. ..m
l”! «1 lll
EW'E
.cnỡẵỉunơẵu …mewo>ẳãềoồov onNNHdu ỄỂ
,. . , ....ỂQỄẺỄẫmẨễ
Bayer (South East Asia) Pte Ltd
.8ẳ 8: mã: .Ễ
âì s ..! 28 68 .ỄẺ ẵã .Ễ …ổ
Ế 5 3… ..ẵ Ể Ế 5›
.ẵ ẵ % ẵ Ễ …mã Ể SẺ :ễỄ B
9% ỄỂỂ…ẻằ ..ẵẵẵ
.ẵ .ẵ ỉ si u…… €ỂỄẺ
.Ể. ;: Sa. .ễ ….a ẵ Ểẽ e. ẵ
.ẵỄ 18 E @. Ể.Ễ aẵE :Ễ: %…
...eẵÊSỄỄÊỄỄẾ
:OSQNR—ẵ
i:uÌ.ẫt
…ẵsẵẫ
mE 9… …Ởcm>zm
ẵSỂỂ
…
... ... ... : Ễ<Ễẫầễpủẵễ
63 Ghulia Street
OCBC Centre East, 14th F1oor
Singapore 049514
OSLLL
~.
… W . anIJV.I|—ểf` … lWIFIIUHM
WMWMLPJW—
@ mưmcm ÍWWIIẾBẸ~
Ễ
:ffl Ênuu.nẵ u:ẵoẵ
….ỄỂ .ẵ ……Ễẽ .…ẵẳẫeẵ ã…ẵS %:
… .. . ..ĩ Ễlễ<Ễẳẵỏwủẫễ
Bayer (South East Asia) Pte Ltd
63 Chulia Street
ocec Centre East. 14… Floor
Singapore 049514
……de LSoum East Asia) Pte Ltd
%? fìhutia Streetth
JLZBL; Centre East, 14 Floor
Singapore 049514
R. Thuốc bán Jheo đơn
' ®
Stwarga
Viên nén bao phim
Bayer Pharma AG
Thânh phẫn
Hoạt chẩt:
Mỗi viên nén bao phim chứa 40 mg regorafenib.
Các tả dược:
Lõi viên không bao: Cellulose vi tinh thể, Croscarmellose natri, Magnesi stearat. Povidon, Silica
colloidal khan
Mảng bao phim: Oxyd sắt đò, Oxyd sẳt vảng, Lecithin (xuất nguồn từ đậu nảnh). Macrogol. cồn
Polyvinyl thủy phân một phân. bột Tale, Titan dioxyd
Mô tả
Viên nén bao phim.
Viên nén bao phim mảu hồng nhạt. hình bầu dục vởi chiều dải 16 mm và chiều rộng 7 mm với chữ
'BAYER' được dập nôi ở một bên và '40' ở phía bên kia.
Chỉ định
Stivarga dược chi dịnh để điều trị cho những bệnh nhân ung thư đại trực trảng (colorectal cancer - C RC )
di căn trước đó đã được điều trị bằng. hoặc không được coi lả ứng cử vỉên để sử dụng phảc đổ hóa trị có
dẫn xuất fiuoropyrimidin. liệu phảp kháng VEGF, và một liệu phảp khảng EGFR nếu bệnh nhân có tuýp
KRAS hoang dã.
Liều dùng và cách dùng
Stixạrga phai được kẻ đớn hới hác si cớ kinh nghiệm sử dụng hớa trị liệu diếu trị ưng thư.
Cách dùng
Dùng đường uống
cnế độ Iiểu
Liều khuyến cảo lả 160 mg regorafenib (4 viến Stivarga. mỗi vỉẻn chứa 40 mg regorafenib). uống một
lân môi ngảy trong 3 tuân diếu tri, sau dó nghi diều trị 1 tuần để tạo thânh một chu kỳ 4 tuần.
Stivarga nên được uống cùng thời điếm mỗi ngảy. Cảc viên thuốc phải dược nuốt nguyên viên với nước
sau một bữa ăn nhẹ. Nêu quên một liêu Stivarga. sau đó nên uỏng lại trong cùng một ngảy ngay sau khi
bệnh nhân nhớ ra. Bệnh nhân không nên dùng hai liêu trong cùng một ngảy đê bù đắp cho lỉểu dã quên.
Nên tiếp tục đỉều trị khi vẫn thấy có lợi ích hoặc cho đền khi xảy ra độc tính không thế chấp nhận được
(xem phần 'Cảnh bảo đặc biệt vả thận trọng'). /ịb
StLvargalC C DSS/OSl 1 12/P1 VNO4 1
f-Javi
)(
Bénh nha`… có tình trạng toi… thán LPS) bằng 2 hoảc cuo hon được loụi … khoi nghiến cứu lâm sảng. Co
L'Ẻil LL điL~ Iiệu trên bệnh nhân có Ciìl sớ 1’8"»2.
Hiệu chỉnh liều
Có thế cần ngừng vả | hoặc giảm liếu dựa trên an toản vả khả năng dung nạp cúa từng cá thể. Hiệu chinh
1iếu được ảp dụng theo từng bậc 40 mg (một viên). Liều khuyến cảo hảng ngảy thẩp nhất lả 80 mg. Liều
dùng hảng ngảy tối đa là 160 mg.
Đề khuyến cáo hiệu chinh liếu vả cảc biện phảp ảp dụng trong trường hợp có phản ứng da lòng bản tay-
chân (Hand Foot Skin Reaction- HFSR / - Hội chứng tay — chân / hội chửng loạn cảm đó lòng bản tay-
bản chân). xem Bảng 1.
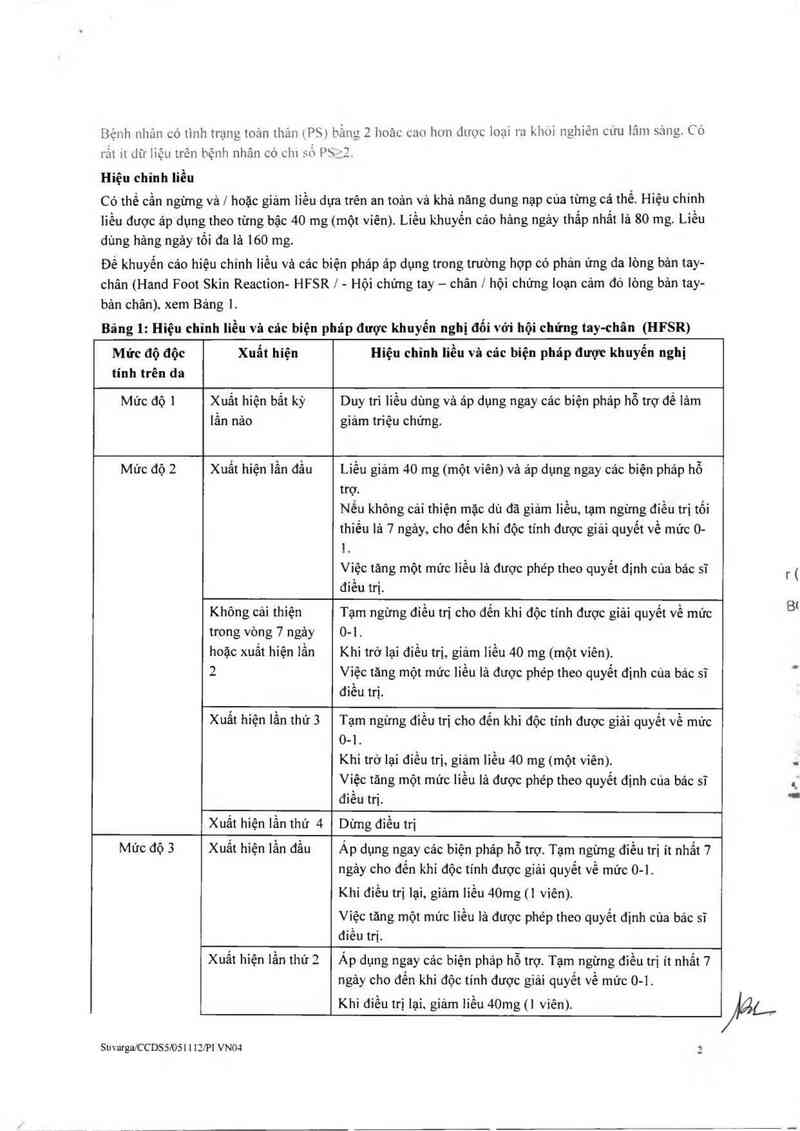
Bảng 1: Hiệu chỉnh liều vả cảc biện phảp được khuyến nghị đổi với hội chứng tay-chân (HFSR)
Mức độ độc
tính trên da
Xuất hiện
Hiệu chỉnh liều vã cảc biện pháp được khuyến nghị
Mức độ 1 Xuất hiện bất kỳ Duy trì liều dùng và ảp dụng ngay các biện phảp hỗ trợ để lâm
lẩn nảo giảm triệu chứng.
Mức độ 2 Xuất hiện lần đầu Liều giảm 40 mg (một viên) và ảp dụng ngay cảc biện phảp hỗ
trợ.
Nếu không cải thiện mặc dù đã giảm liều, tạm ngừng điều trị tối
thiều lả 7 ngảy, cho đến khí độc tinh được giải quyết về mức 0-
1.
Việc tăng một mức liếu 1ả được phép theo quyết định cùa bảc sĩ
điều trị.
Không cải thiện Tạm ngửng đỉểu trị cho đến khi độc tính được giải quyết về mức
trong vòng 7 ngảy 0-1.
hoặc xuất hiện lẩn Khi trở lại điểu trị, giảm 1iếu 40 mg (một viên).
2 Việc tăng một mức liều lá được phép theo quyết định của bảc sĩ
đỉều ni.
Xuất hiện lần thứ 3 Tạm ngừng điều trị cho đển khi độc tính được giải quyết về mức
0-1.
Khi trở lại diều ni, giám liếu 40 mg (một viên).
Việc tăng một mức liếu lá được phép theo quyết định cùa bảc sĩ
đỉều trị.
Xuất hiện lần thứ 4 Dừng điếu ni
Mức độ 3 Xuất hiện lẩn đầu Áp dụng ngay các biện pháp hỗ trợ. Tạm ngừng điều trị it nhất 7
ngảy cho đến khi độc tính được giải quyết về mức 0-1.
Khi điều trị lại, giảm Iiều 40mg (] vỉên).
Việc tăng một mức liều lá được phép theo quyết định cùa bảc sĩ
điều trị.
Xuất hiện lấn thứ 2
Áp dụng ngay cảc biện pháp hỗ trợ. Tạm ngừng diển trị ít nhất 7
ngảy cho đến khi độc tinh được giải quyết về mức 0-1.
Khi đỉều trị lại, giảm liều 40mg (] viên).
Sttvarga/CCDSSIDSI [ 12/“P1 VN04
01
r(
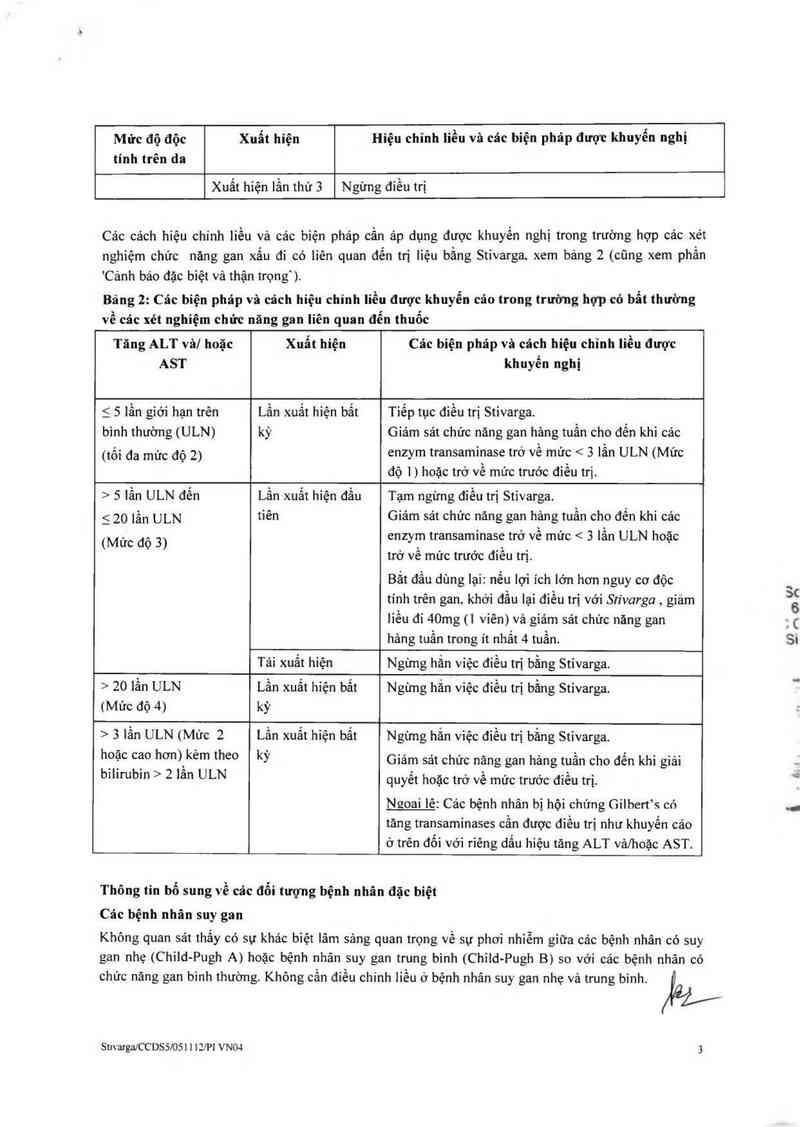
Mức độ độc
tính trên da
Xuất hiện
Hiệu chỉnh liều và các biện phảp được khuyến nghị
Xuất hiện lần thử 3
Ngừng điều trị
Các cảch hiệu chỉnh 1iếu vả các biện phảp cần ảp dụng được khuyến nghị trong trường hợp các xét
nghiệm chức năng gan xấu đi có Iiên quan đến trị Iiệu bằng Stivarga. xem bảng 2 (cũng xem phần
'Cảnh bảo đặc biệt vả thặn trọng“ ).
Bảng 2: Các bỉện pháp vả cách hiệu chỉnh liền được khuyến cáo trong trường hợp có bất thường
về các xét nghiệm chức năng gan liên quan đến thuốc
Tăng ALT vâ/ hoặc
AST
Xuất hiện
Các biện pháp và cách hiệu chỉnh liều dược
khuyến nghị
S 5 lần giới hạn trên
bình thường (ULN)
(tối đa mức độ 2)
Lần xuất hiện bất
kỳ
Tiểp tục diều trị Stivarga.
Giảm sảt chức năng gan hảng tuần cho đến khi các
enzym transaminase trở về mửc < 3 lần ULN (Mức
độ 1 ) hoặc trở về mức trước điều trị.
› 5 lần ULN đến
5 201ần ULN
(Mức độ 3)
Lần xuất hiện đầu
tiên
Tạm ngừng điểu trị Stivarga.
Giảm sát chức năng gan hảng tuần cho đển khi cảc
enzym transaminase trở về mức < 3 lần ULN hoặc
trở về mức trước điếu trị.
Bắt đầu dùng lại: nếu lợi ích lớn hơn nguy cơ độc
tinh trên gan. khới đẩu lại điếu trị với Stivarga , giám
Iiều đi 40mg (] viên) vả giảm sát chức năng gan
hảng tuấn trong it nhắt 4 tuần.
Tái xuất hiện
Ngừng hẳn việc điều trị bằng Stivarga.
› 201ần ULN
(Mức độ 4)
Lần xuất hiện bất
kỳ
Ngừng hắn việc điều trị bằng Stivarga.
› 3 lằn ULN (Mức 2
hoặc cao hơn) kẻm theo
bilirubin › 21ẩn ULN
Lấn xuất hiện bất
kỳ
Ngừng hắn việc điểu trị bằng Stivarga.
Giảm sát chức nãng gan hảng tuần cho đến khi giải
quyểt hoặc trở về mức trưởc điều trị.
Ngoai lê: Các bệnh nhân bị hội chứng Gilbert’s có
tăng transaminases cấn được điều trị như khuyến cáo
ở trên đối với riêng dắu hiệu tăng ALT vả/hoặc AST.
Thông tin bổ sung về cảc đổi tượng bệnh nhân đặc biệt
Các bệnh nhân suy gan
Không quan sát thấy có sự khảc biệt lâm sảng quan trọng về sự phơi nhiễm giữa các bệnh nhân có suy
gan nhẹ (Child-Pugh A) hoặc bệnh nhân suy gan trung binh (Child—Pugh B) so với các bệnh nhân có
chức nảng gan bỉnh ihường. Không cần điều chinh liểu ở bệnh nhân suy gan nhẹ và trung bình. liỡp
Smarga/CCDSSIOSI l 12/P1VN04
Khuyển cảo giảm sát chặt chẽ an toản trên những bệnh nhân nảy (xem thêm phần "Cảnh báo đặc biệt và
thận trọng khi sử dụng" vả ~"Đặc điêm dược động học”).
Stivarga không được khuyến cảo sử dụng ở những bệnh nhân suy gan nậng (C hild-Pugh C) vì Stivarga
chưa được nghiên cửu trong nhỏ… đân số nảy.
Bệnh nhân suy thận ` ~
Trong cảc nghiên cứu lâm sảng. không quan sát thẩy có sự khảo bỉệt về tính phơi nhiêm. an toản hoặc
hiệu quả giữa cảc bệnh nhân suy thận nhẹ vả bệnh nhân có chức nãng thận binh thường. C ảo dữ liệu
dược động học còn hạn chế cho thấy không có sự khảo biệt trong sự phới nhỉễm ở nhũng bệnh nhân suy
thận trung bình. Không cần điều chinh liếu ở những bệnh nhân suy thận nhẹ hoặc trung bình (xem thêm
phần “Đặc điếm dược động học’). Không có dữ lỉệu lãm sảng cho cảc bệnh nhân Suy thận nặng.
Người giả
’l`rong cảu nghìén cưu lảni >ễìlìg, ixiìỎTiể có sự khác nhau đi'LLLg kế trong phơi nhiễm. tinh an toản hoặc
hìệLi quả được quan <át giữa bệnh iih£uL giả (L'uới J_-65) vả bộnh nhân Lnè. Có rắt Í1 thỏng tin ở bộnh nhân
Ii`ỗT) 75 tuôi.
Trẻ cm
Khòng đưng Stivưrga ớ bệnh nhi trong cht định Ling thư đại trực Lrẩ1ng.
Chống chỉ định
Bệnh nhản quả mẫn vơi hoạt chủt L :) hải kị. Lhiinh phần tả được nản trong cớng thừc thước.
Cânh bảo đặc biệt và thận trọug khi sử dụng
Ca'c tác dụng trên gan
Những bẩt thường về xẻt nghiệm chức nâng gan (a]an'me aminotransferase -ALT, aspartate
aminotransferase —AST vả bilirubin) thường được quan sát ở những bệnh nhân được điểu trị với
Stivarga. Những bất thường nghiêm trọng về các xét nghiệm chức nảng gan (mức độ 3 đến 4) và rối
loạn chửc năng gan với cảc biểu hỉện lãm sảng (bao gồm cả tử vong) đã được báo cáo trên một tỷ lệ nhỏ
các bệnh nhân (xem phẩn “Tác dụng không mong muốn’).
Khuyến cảo thục hiện xe't nghiệm chừc năng gan (ALT. AST vả bilirubin) trước khi bắt đầu điếu trị
Stivarga vả giám sảt chật chẽ (ít nhắt 2 tuẳn/lần) trong vòng 2 thảng đầu điếu trị. Sau đó, nến tiếp tục
giám sảt định kỳ it nhất là hảng thảng và khi có chỉ định lâm sảng.
Regorafenib lả một chẳt ức chế men uridine diphosphate glucuronosỵl transferase UGTIAI (xem phần
'Tương tảc với cảc thuốc khác vả cảc dạng tướng tác khác'). Tăng bilirubin gián tiếp (không Iiến hợp)
nhẹ có mẻ xảy ra ớ cảc bệnh nhân bị hội chứng Gilbert.
Đối với những bệnh nhân có xét nghiệm chức năng gan xẩu đi có thế do điều trị bằng Srivarga (ví dụ
khi không có nguyên nhân năm khảc rõ ráng. như tắc mật sau gan hoặc tiến triến của bệnh). cần tuân thử
việc điều chỉnh liều vả những lời khuyến vế giám sảt trong Bảng 2 (xem phẩn “Liều dùng vả cách
dùng’ - mục ~Hiệu chinh1iếu’).
Cần giảm sát chặt chẽ về an toản chung trên các bệnh nhân có suy gan nhẹ hoặc trung bình (xem phần
'Liếu dùng vả cảch dùng` — mục “Bệnh nhân suy gan’ vả “Đặc đỉếm dược động học’). Stivarga không
được khuyến cảo sử dụng ớ những bệnh nhân suy gan nặng (Child-Pugh C) vi Stivarga chưa được
nghiên cứu trong nhóm dân số nảy và sự phơi nhiễm có thể bị tăng lên ở những bệnh nhân nảy. Ắẩừ
StivargulCCDSẳ/OSI l 12:1’1 VNU4 4
ưẵÒwỆ
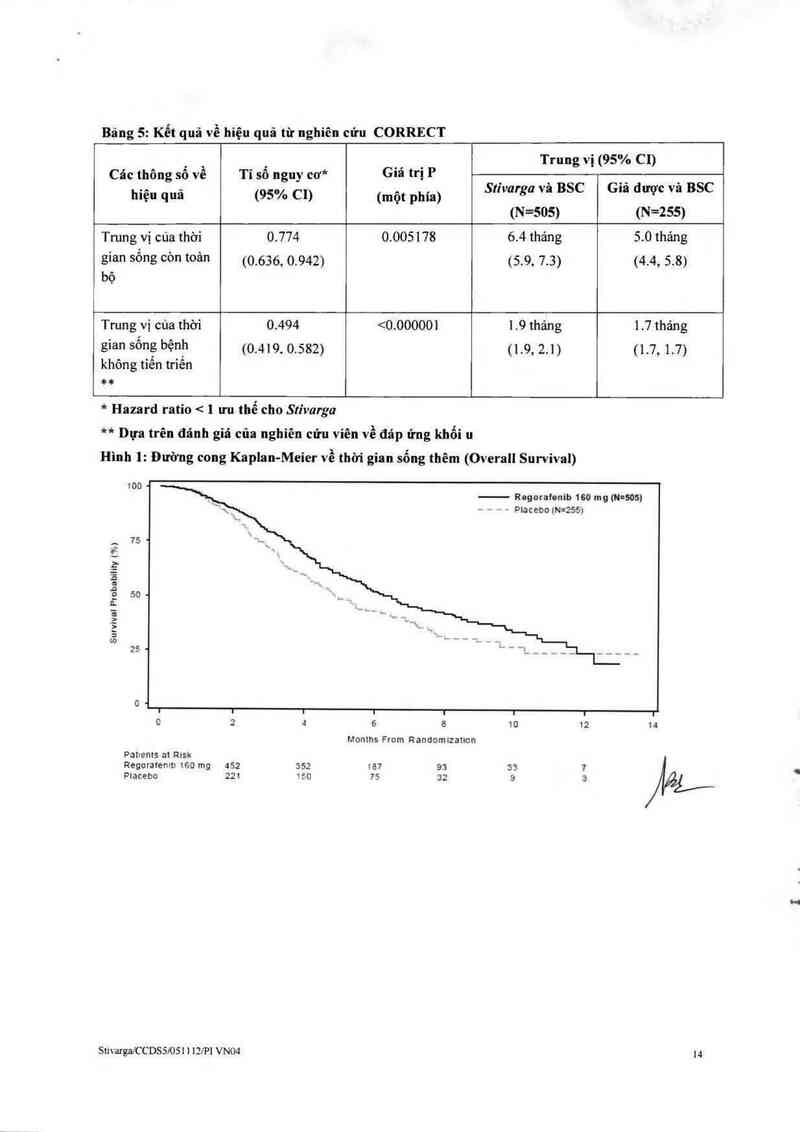
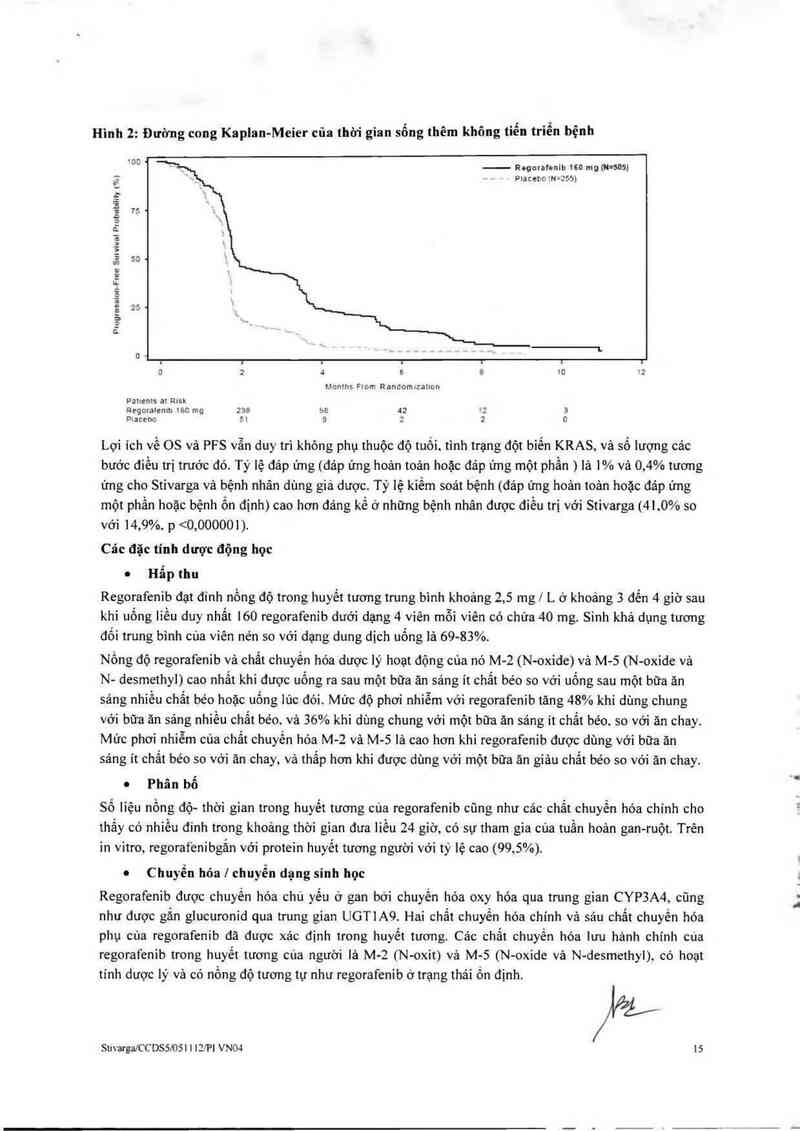
Rệưh nhân có khối n đột biện KRAS
ơ nhửng bệnh nhân có khối u đột biện KRAS. thi ginn sớng bệnh không tìến LJ-iện (PFS ; được ghi nhịn
cớ cai thiện đáng kế vả hiện qua trến sớng còn toi… bộ (05) đã được ghi nhận lả Lhấp hơn về mặt =,ồ
iượng (xem phần "Các đậc tính dược lưc hợc"). Do độc tinh liên quan đến điếu trị lả đáng kẻ. cảc bác Sĩ
Liên dảnh giá một cách cắn thận lợi ich vả mi m h`ni kế Loa regorafenib () bệnh nhân có khối u đột biến
KRAS
Xuất huyễt
Stivarga có liên quan đến tăng tằn suất các biến cố chảy mảu. đôi khi gây từ vong. (xem phần “Tác
dụng không mong muốn’). Cần giảm sát số lượng các tế bảo mảu vả eảc thông số đông máu trẻn những
bệnh nhân có yếu tố nguy cơ chảy máu. và trên những bệnh nhân đỉều trị với cảc chẳt chống đông (như
warfarin) h0ặc dùng các sản phẩm điều trị đồng thời khác ]ảm tăng nguy cơ chảy mảu. Trong các trường
hợp chảy mảu cẳn can thỉệp y tế khắn cẳp. nên cân nhắc ngừng hẳn Stivarga
Thiếu mảu cục bộ và nhồi máu cơ tim
Stivnrga cớ [iến quan với sự gia tăng tẩn sưắt mắc mới bệnh tim thiều mé… cục bộ vả nhồi mé… eo tim
(xem phẳn “Tác Lỉụng khỏng Lnnng mướn’ở. Bệnh nhác đau thăt ngực không ỏn định hoặc ccm đau thăt
ngục mới khới phát (trong vong 3 iháng bắt đỄLLL điếu trị Stivarga). nhồi máu cơ tim gần đây ('ưong vong
6 tháng hẳt đấu đỉều lrị Stivarga) LL`L bệnh iihiìn có phân độ suy lim NYHA 11 hoặc cao hớn bị ioại khoi
nghiên cớu iâm sảng
Bệnh lìiìẩlì có tiến sư bệnh Lim Lhiếư mún cục hộ Lớn được theo dỏi các đắn hiệu vả triệu chứng iảm sảng
cưa bệnh tim thiếu LLLL’LLL cục bộ. 0 nhưng bệnh nhảm có bệnh tim thiếu máu cục bộ VảỮìOậC nhỗi mảu cớ
Lim tiến triến. được khuyến cáo sư đụng ngẳt quãng Stixarga cho đến khi bệnh được giái quyết. Quyết
định tải điếu trị St'i’vizrga phải đưa trẻn xem xét cắn thận những lợi ich vù rùi ro tiềm tảng cún Lng bệnh
nhản. Nón chảtn đưt điếu trị Slìvarga nếu không có hướng giải qu_x LỄt.
Hội chứng hệnh Lý chẩt trắng não có hổi phục (Reversible Posterior Leukoencephalopathy
Syndrnme)
Hội chửng bệnh lý chất trắng não có hồi phục (Reversiblc Posterior Leukoencephalopathy Syndrome —
RPLS) đã được bảo cảo có liên quan với việc điều trị Stivarga (xem phần “ Tảo dụng không mong
muốn". Các dấu hiệu và triệu chủng của RPLS bao gồm co giật, đau đầu, tình trạng rối loạn tâm thần,
rối loạn thị giảc hoặc mù vỏ não, có hoặc không có kèm theo tãng huyễt ảp. Chẩn đoán xảo định RPLS
cẩn chụp ảnh não. Ở những bệnh nhân xuất hỉện RPLS, ngừng sử dụng Stivarga. cùng với kỉểm soát
tảng huyết ảp vả điếu trị hỗ trợ cảc triệu chứng khảo. Chưa rõ tinh an toản của việc bắt đẳu sử dụng Iại
Iiệu pháp Stivarga ở những bệnh nhân trước đó trải qua RPLS.
Thi'mg vả rò đường tiêu hóa
Thủng vả rò đường tiêu hóa đã được bảo cảo ở những bệnh nhân được điều trị với Stivarga (xem phần
'Tác dụng không mong muốn`). Những sự cố nảy cũng được biết lả cảc biến chứng thường gặp 1iến
quan đến bệnh ở những bệnh nhân có khối u ảc tính trong ổ bụng. Cần ngừng Stivarga ở những bệnh
nhân bị thủng hoặc có lỗ rò đường tiêu hỏa. Chưa biết về tính an toản cùa việc bắt đầu sử dụng Iại
Stivarga sau khi bị thủng hOặc rò dường tiêu hóa.
Tăng huyết áp động mạch
Stivarga có iiên quan với tăng tần suất mẳc tăng huyết ảp động mạch (xem phần 'Tác dụng không
mong muốn’). Cẩn kiểm soát hưyết ảp truớc khi bẳt đầu điều trị với Stivarga. Khưyến Cảo theo dõi
huyết áp và điều trị tăng huyết áp theo hướng dẫn điều trị chuẩn. Trong trường hợp tăng huyết áp nặng
Stivargai'CC'DSẵlũã] 1 1211²1 VNO4 5
m;Lr-ẹ
hay kẻo dải cho dù đã điều trị đầy đù. nên tạm ngừng Stivarga vảJ'hoặc giảm liều theo quyết định của
bảo sĩ đìếu trị (xem phẳn “Liều lượng vả cảch dùng’ — mục “Hiệu chỉnh liều`). Trong trường hợp của
Lãng huyết áp kịch phát. nên ngừng sử dụng Stivarga.
Cảc biến chứng trên việc Iảm Iảnh vết thương
Không có nghiến cứu chính thức được thực hỉện về tác đụng cùa Stivarga trên việc lâm lảnh vết thương.
Tuy nhiên. do các sản phẳm điều trị có đặc tính chống tạo mạch có thề ức chế hoặc ảnh hưởng đền sư
lảm lảnh vết thương- khuyến cảo tạm thời ngừng Stivarga vì lý do thận trọng ở những bệnh nhân phải có
phẫu thuật lởn. Kinh nghiệm lâm sảng về thời gian bắt đằu iại điếu trị sau can thiệp phẫu thuật lớn còn
hạn chế. Vì vặy. quyết định tiếp tục điếu trị Stivarga sau một can thiệp phẫu thuật lớn cần phải dựa trên
đảnh giả lâm sảng về tinh trạng lảnh cùa vết thương.
Độc tính trên da
Phản ứng da 1òng bản tay- bản chân ( HFSR l palmar-plantar erythrodysesthesia synđrome) vả phảt ban
là cảc phản ứng có hại trên đa thường gặp nhất cúa Stivarga [xem phần *Tảc dụng khỏng mong muốn’).
Cảc biện phảp phòng ngừa HFSR bao gồm điếu trị cảc vết chai vả sử dụng đệm giảy vả găng tay để
ngăn chặn áp lực ấn mạnh lên gan bản chân và lòng bản tay. Điều trị HFSR CÓ thế bao gổm việc sử
dụng các loại kem cớ tảo dụng tiến sừng (ví dụ như kem có urê. salicylic acid. hoặc alpha hydroxy] acid-
được bội một cách vừa đủ chi trên các khu vực bị ảnh hướng) và cảc loại kem dưỡng ấm (được bôi
rộng) đế lảm giảm triệu chứng. Giảm liều vả / hoãc ngùng tạm thời Stivarga, h0ặc trong các trường hợp
nặng hay kéo dải, cần cân nhắc ngùng lâu dải Stivarga (xem phẳn “Liều lượng vả cảch dùng’ — mục
”Hiệu chinh liếu’).
Cảo bẩt thường về xét nghiệm sinh hỏa và chuyển hóa
Stivarga có liên quan đển tăng tằn suất có bắt thường về điện giải (bao gồm hạ phosphate mảu. hạ calci
mảu. hạ natri máu vả. hạ kali mảu) vả các bất thường về chuyển hóa (bao gổm cả tăng hoóc môn kích
thích tuyển giáp. lipase vả amylase). Những bất thường nói chưng lả từ nhẹ đến trung bình. không liên
quan đến biền hỉện lâm sảng. vả thường không cần tạm ngừng thuốc hoặc giảm liều. Khuyến cáo cần
giảm sát các thông số sinh hóa vả chuyển hóa trong quá trình điếu trị Stivarga vả ảp dụng các biện pháp
điều trị thay thể phù hợp với các hướng dẫn thực hảnh lâm sảng nểu cần. Tạm ngừng hoặc giảm liều
hoặc ngưng vĩnh viễn Stivarga cần được xem xét trong trường hợp bất thường đảng kể kéo dải hoặc tải
phát (xem phằn “Liều lượng vả cảch dùng " — mục “Hỉệu chỉnh liếu’).
Tương tác với th uốc khác và các loại tương tác khác
Chẩt ức chế J căm ứng CYP3A4
Số lỉệu in vítro chi ra rằng regorafenib dược chuyến hóa bởi cytochrome CYP3A4 vả uridine
diphosphate glucuronosyl transferase UGTIAO.
Dùng ketoconazole (400 mg trong 18 ngảy). một chẳt ức chế CYP3A4 mạnh. với một liều duy nhất
regorafenib (`160 mg vảo ngảy 5) dẫn đển sự gia tăng phơi nhiễm regorafenib trung bình (AUC) khoảng
33%. và giảm sự phoi nhiễm cưa các chẳt chuyền hóa có hoạt tính. M-2 (N-oxit) vả M—5 (N-oxide vả N—
desmethyl) trung bỉnh khoảng 90%. Cẩn trảnh sử dụng đồng thời thuốc ức chế mạnh hoạt tinh C YP3A4
(ví dụ như clarithromycin. nước ép bưởi, itraconazole, ketoconazole. posaconazole, telithromycin vả
voriconazole) vì ảnh hưởng cưa chùng trên sự phới nhiễm với trạng thải ốn định của regorafenib vả các.
chất chuyến hóa cùa nó (M-2 Vả M -5`) chưa được nghiên cửu.
StivargaJCCDSỉ'iìẳl 1 12fPI VNO-i ô
Dùng rỉfampin (600 mg trong 9 ngảy), một chất cảm ứng CYP3A4 mạnh. với một liều duy nhắt
regorafenib (160 mg vảo ngảy 7) dẫn đến lảm giảm AUC cùa regorafenib trung bình khoảng 50%. tăgng
3 đến 4 lẳn phơi nhiễm trung binh cùa chẩt chuyến hóa có hoạt tinh M-S, và không thay đôi phơi nhiếm
cùa chắt chuyến hóa có hoạt tỉnh M-2. Cảc chất cảm ứng mạnh hoạt tính CYP3A4 khảc (ví dụ như
phenytoin, carbamazepine. phenobarbital) cũng có thể lảm Lãng chuyển hóa regorafenib. Do sự giảm
nồng độ trong huyết tượng của regorafenib có thể dẫn đến giảm hiệu quả. cần trảnh sử dụng cảc chất
gây cảm ứng mạnh CYP3A4. hoặc nên xem xét lưa chọn một thuốc thay thế khi dùng đồng thời. khỏng
có hoặc rất ít có khả nâng câm L'mg CYP3 A4.
Cơ chẩt UGTIAI vả UGTIA9
Số Iiệu in vitro cho thẳy regorafenỉb cũng như các chất chuyến hóa hoạt động cùa nỏ M—2 ức chế
glucoronỉn hóa trung gian bới uridine transferases glucuronosyl diphosphate UGTIAI vả UGTIAO.
trong khi M-S chi ức chế UGT1A] ớ nồng độ đạt được trong cơ thể ở trạng thải ổn dịnh.
Dùng regorafenib với một khoảng nghi dải S ngảy trước khi dùng irinotecan ]ảm tảng khoảng 44%
AUC trung bình cùa SN-38, một cơ chắt của UGTIAI và lá một chất chuyền hóa có hoạt tính cùa
irinotecan. Cũng quan sa't thấy có sự gia tăng phơi nhiễm trung bình AUC với ìrinotecan khoảng 28%.
Điểu nảy cho thắy rằng việc sử dụng đổng thời regorafenib có thế lảm tảng phơi nhiễm hệ thống với cảc
cơ chất của UGTIAI vả UGT1AO.
Cơ chẩt BCRP (Breast cancer resistance protein : protein kháng ung thư vú) và P-glycoprotein
Dữ lỉệu in vitro cho thẳy rằng regorafenib là một chất ức chế —BCRP vả P-glycoprotein. Điều trị đồng
thời regorafenib có thế lảm tăng nồng độ trong huyết tương cùa cơ chất của BCRP, như methotrexate.
hoặc cảc cơ chẳt cùa P-glycoprotein, như digoxin.
Cơ chẳt chọn lọc cũa các phân nhỏm CYP
Dữ iiệu in viJro cho thấy rắng regorafenib là một chất ửc chế cạnh tranh cùa các cytochrome CYP2C8.
CYP2C9, CYP2Bô ở nống độ đạt được in vivo ở trạng thải ổn định (nồng độ đỉnh trong huyết tương là
8,1 micromolar). Tiếm năng ức chế in vỉtro đối với CYP3A4 vả CYP2C l 9 ít rõ rảng hơn.
Một nghiên cứu lãm sảng thăm do cơ chất đã được thực hiện để đánh gỉá hiệu quả cùa 14 ngảy dùng
regorafenìb vởi liều 160 mg trên dược động học các cơ chắt của CYP2CS ( rosi glitazone), CYP2CO (S—
warfarin), CYP2C 19 (omeprazole) vả CYP3A4 (midazoiam). Dữ lìệtt dược động học cho thắy rằng
regorafenib có thế được dùng đồng thời với cảc chẳt nến cvmcs. cvpzco. CYP3A4, vả CYP2C] 0
mà không có tương tác thuốc có ý nghĩa lâm sảng (xem thêm phẩn “Cảnh bảo đặc biệt và thận trọng').
Khảng sinh
Phim ĩẵCh nồng dộ - lllÒ'i giun cho Lhắ;` regoratenib tả các chắt chuyên hớa cưa nó có thế trai qua tuần
hoán gíƯ1-I'UỘI (xcm phần "Các đặc Linh được động học”). Việc ›iL'L đụng động thời với khzing ..em phần 5.2). Các thưốc gắn ncid
tnật như choiest_vrantiit vả choicstngci có thế Lương Lác với L'chLưiibhib băng cảch hinh thảnh phức hợp
khớng hờn Lan có thế anh thưLìg đến sư hẩp thLL ilnvậc tái hắp thu). vi vậy đẫn dến kha nảng giam SỰ
phoi nhiếni. Ý nghia lảin séLng cLLJ'J những tướng tác Liêm tưng ná; iá không rỏ. nhưng co [i1L' đẩn đến
giờ… hiện tịiliì L`L1ấ1 rcgoratenib
StivargalCCDSẳ/OSI ] lZf'PI VNO4 7
Có thai và cho con bú
Trảnh thai
Phụ nữ có khả năng mang thai phái được thông báo rằng regorafenib có thể gây hại cho thai.
Phụ nữ khả năng mang thai và nam giới nên đảm bảo sử dụng biện phảp tránh thai hiệu quả trong quá
trinh điều trị và kéo dải đến 8 tuần sau khi hoản tắt điều trị.
Phụ nữ có thai
Khỏng có dữ liệu về việc sử dụng của regorafenib ở phụ nữ mang thai.
Dựa trên cơ chế tảc dụng. regorafenib bị nghi ngờ gây ra tốn hại cho thai khi dùng trong thời gian mang
thai.
Các nghiên cứu trên động vật đã cho thẳy có độc tính trến Sỉnh sản (xem dữ liệu 'Dữ iiệu an toản tiền
lâm sảng’).
Không nên sử dụng Stivarga trong thởi kỳ mang thai. trừ khi rõ rảng lả cần thiết vả sau khi xem xét cẳn
thận những lợi ích cho mẹ vả nguy cơ cho thai nhi.
Cho con bú
Chưa biết liệu regorafenib/chất chuyển hóa có được bải tiết trong sữa mẹ hay không.
Ở chuột. regorafeniblchắt chuyến hỏa được bảỉ tiết qua sữa.
Không thể loại trừ nguy cơ cho 11'è bú mẹ. Regorafenib có thể gây hại cho sự tăng trường vả phảt triền
cùa trẻ em (xem dữ liệu 'Dữ liệu an toản tiền lâm sảng’). Phải ngimg cho con bú trong thời gian đìều trị
vởi Stivarga.
Khả năng sinh sán
Khõng có dữ liệu về tác dụng cưa Stivarga trên khả năng sinh sán ở người. Kểt quả nghiên cứu trên
động vật cho thây regorafenib có thế Iảm giảm khả năng sinh sản của động vật đực vả cải (xem dữ líệu
'Dữ liệu an toản tiên lâm sảng`).
Ẩnh hưởng trên khả năng lải xe hoặc sử dụng máy móc
Không có nghiên cứu về những ảnh hưởng cùa Stivarga trên khả năng lải xe hoặc sử dụng mảy móc.
Nếu bệnh nhân có cảc triệu chưng anh hưtnig đến kha nảng tập tl'Ltng vả phan L'mg khi điếu trị với
Stit Lưgn. họ khớng được iái xe hn_v vịm hảnh máy móc chợ đến khi cớc Linh hướng giảm bớt.
Tảc dụng không mong muổn
Tỏm tắt thông tin về an toản
Thông tin về an toản tông thề cùa Stivarga được dụa trên dữ liệu từ hơn 1.200 bệnh nhân được điều trị
trong cảc thử nghiệm lâm sảng bao gồm dữ liệu pha 111 có đối chứng palcebo trên 500 bệnh nhân bị ung
thư đại trực trảng di căn (CRC ). Phản ửng có hại cùa thuốc thường gặp nhẩt (>; 30%) ở bệnh nhân
dùng Stivarga là suy nhược/ mệt mòi. phản ủng da chân-tay, tiêu chảy. giảm sự thèm ản và giảm lượng
thức ăn. tăng huyết ảp. mắt gỉọng vả nhiễm trùng.
Cảc phán ửng có hại cùa thuốc nghiêm trọng nhẩt ở những bệnh nhân đùng Stivarga lả tốn thương gan
nậng. xuất huyết vả thùng đường tiêu hóa.
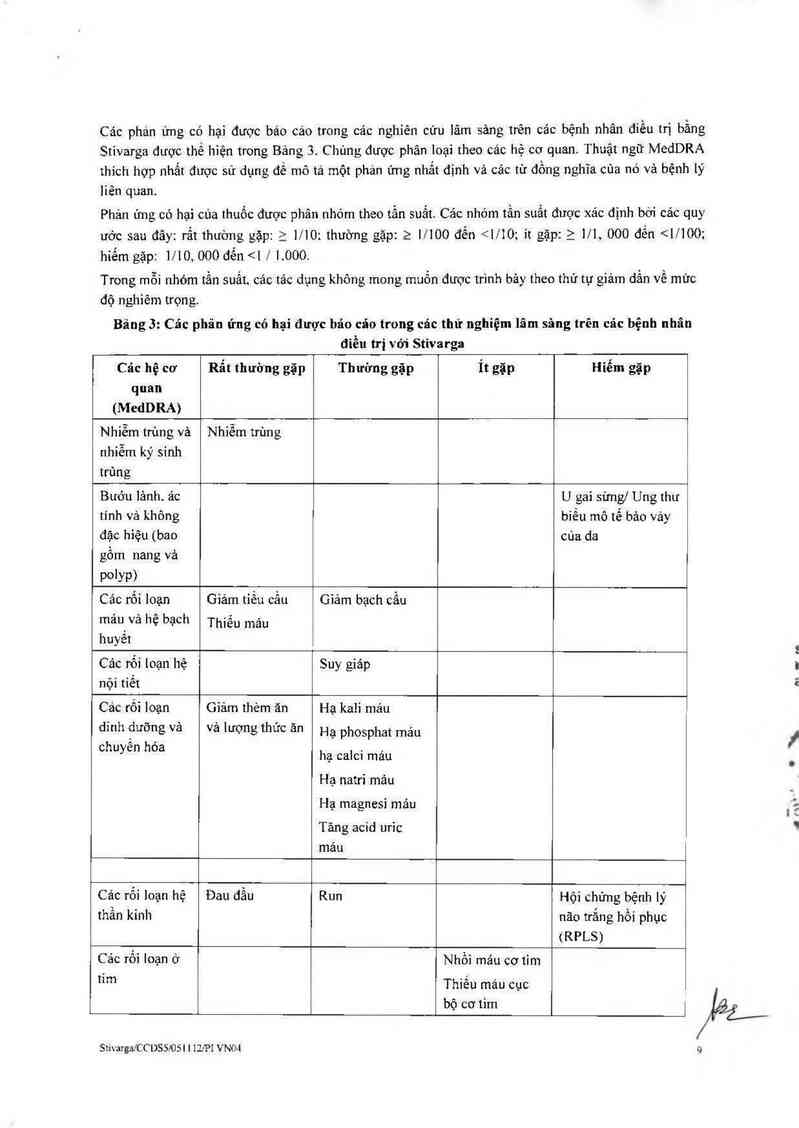
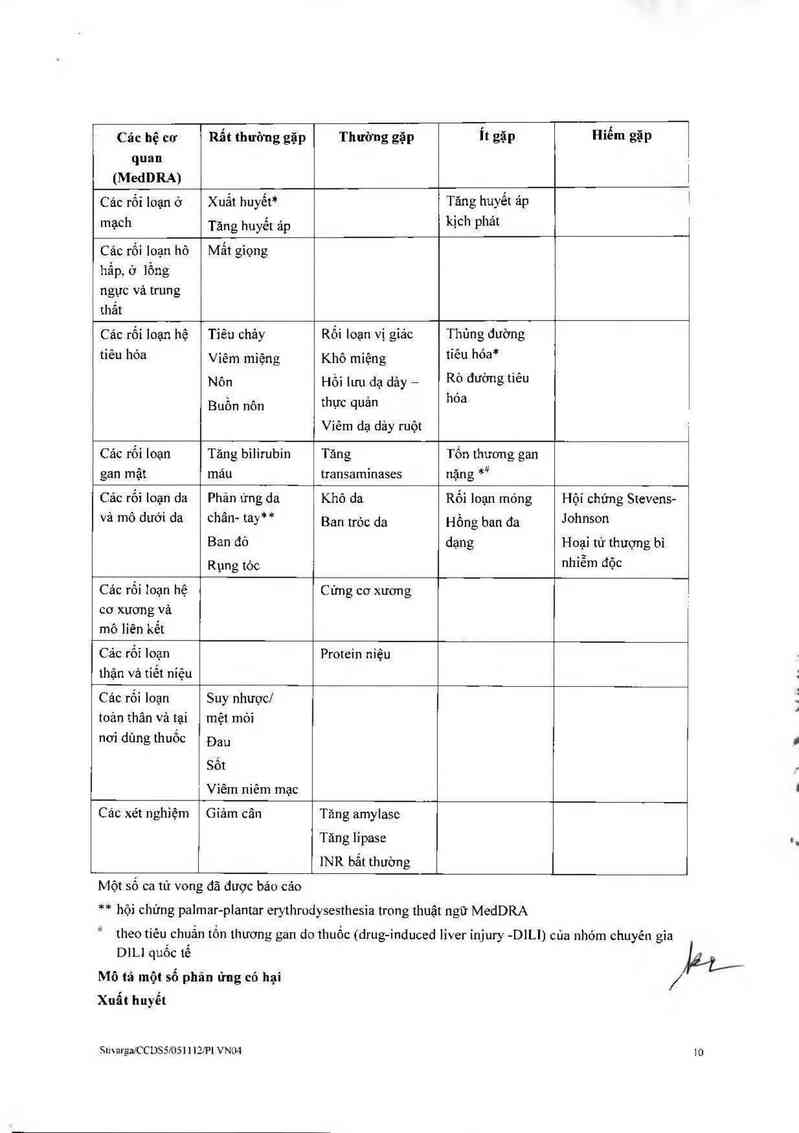
Bảng các phản ứng có hại
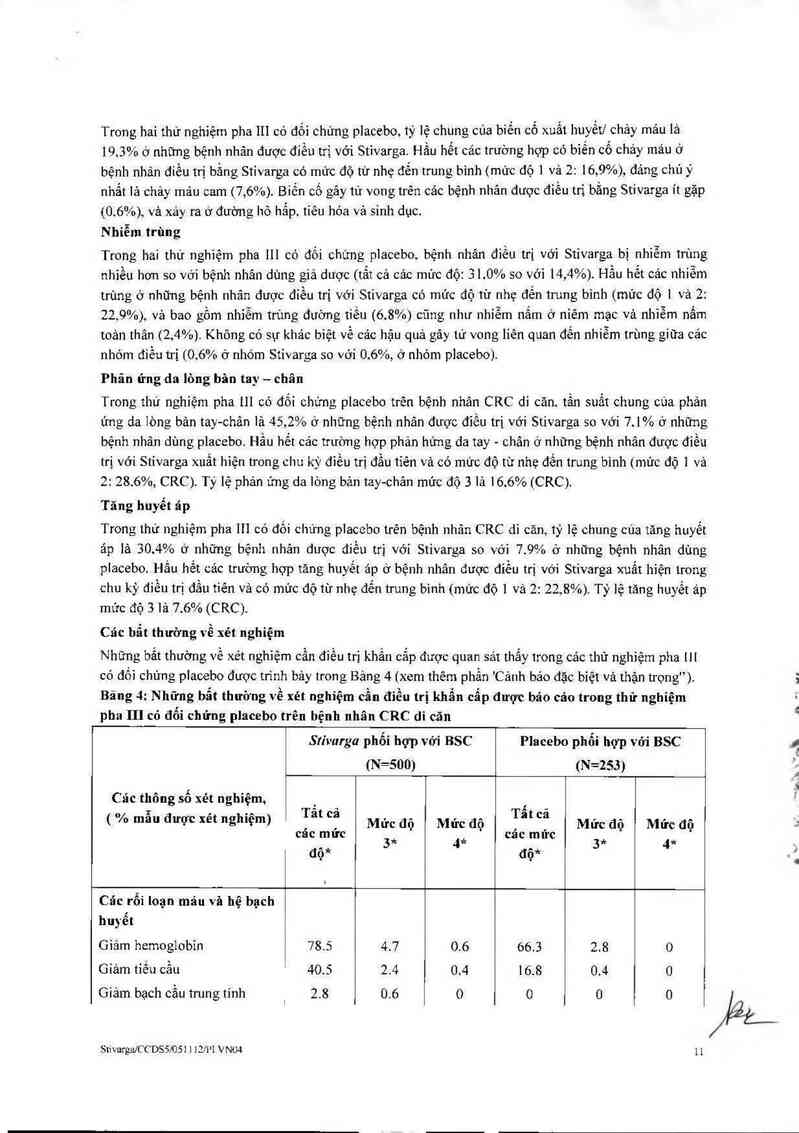
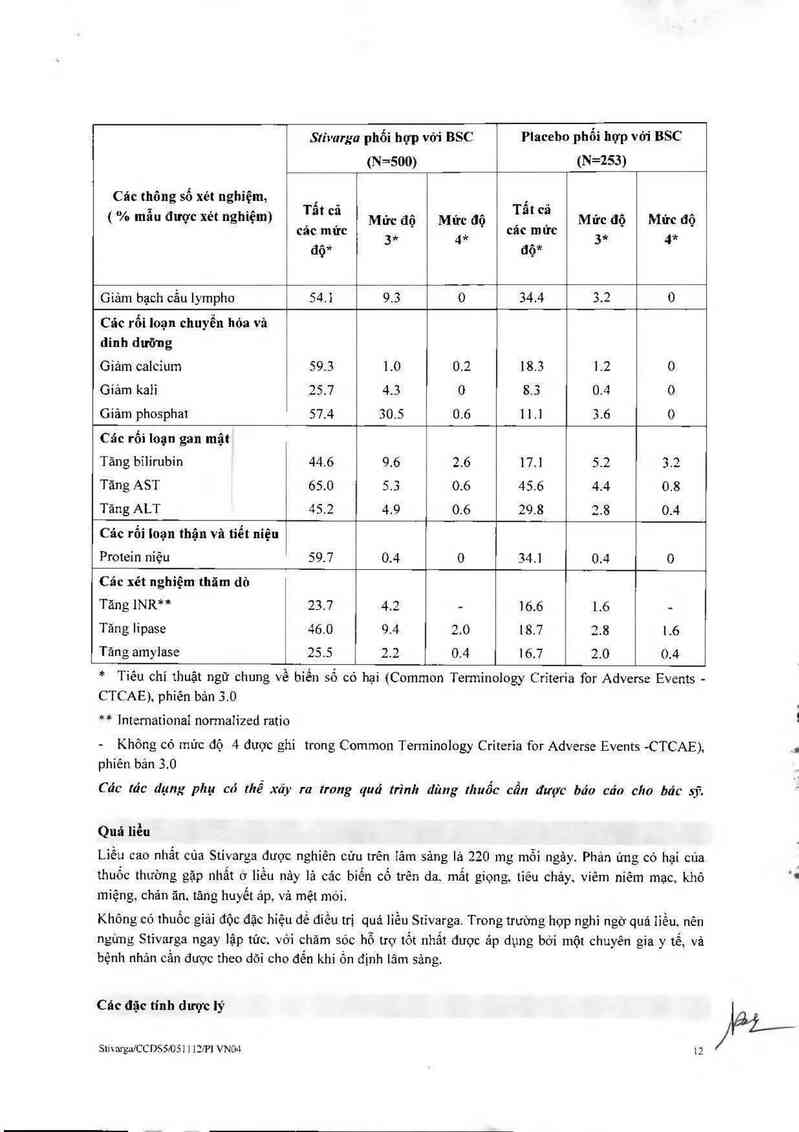
SttvmgalCCDSẵ/OSI 1 12!P1 VNO4 8
\i.…, … —
Cảo phạn ứng có hại được báo cáo trong cảc nghiên cửu lâm sâng trên cảc bệnh nhân điểu trị bầng
Stivarga được thế hiện trong Bảng 3. C hủng được phân loại theo các hệ cơ quan. Thuật ngữ MedDRA
thích hợp nhất được sử dụng để mô tả một phản ứng nhắt định vả các từ đồng nghĩa của nó và bệnh lý
liên quan.
Phản ứng có hại cùa thuốc được phân nhóm theo tần suất. Cảo nhóm tần suất được xảc định bới cảc quy
ước sau đây: rất thường gặp: z mo: thường gặp: 2 moo đến <1/10; ít gặp: z m, 000 đền <…00;
hiểm gặp: mo, 000 đến
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng