








BỘ Y TẾ 4/gS—ctT
CỤC QUẢN Líf nược #
ĐÃ PHÊ DUYỆT
Lấn dáuz..ẾJ…ẩ.J…
A|uo ungoeỊm snnueABiim mg
NIGV.LNVS
_luu unndụauạ. XH
\ Hx 'PmưlựIu llnn' Hx ~Pmuiptu n…;-
Active ingredients with ooncentration. , ,ọ
strength: Gemcitabine Hydrochloride 1140 Sim … ² °°°'- M N… JJ
\
i
0 S A N T A B 1 N mg equivalent to Gemciiabine 1000 mg S A N T A BI N ẵTễerẫẵ'ẵcfẹrỉìỉỉẳẵẹ ẾẦ
. _ . vỉ
Gemcitabme IOOOmg Dosage form :» IV Fur lntravenous Gemc:tabme IOOOmg “Keep outefReachofChildren" É`ả
'Ị)
Injection Only. Carefully read the accompanying ầĩ
lndications. contraindỉcation. dosage & |nstructlons before use. i
administration and further Information: ỂẵdẵoNpĩ
See the acoompany leaiiet. Mtg: ddlmmey
Package: Box oi 1 vial Exp.: ddlmmlyy
EXPORT PACK
For lntravanms lrịoclion Oniy
For lntravenous injection Only l … mua …
I
SANTAIIN
m
Mili lo slm Oullđllilỉul I'Iỵdioehiuìuls lHOmg l
duan Cluudlủlto: mm nụ … Dmm Mudú W uu lim
liumg dung tìm nưyũn mm nuch
Bủoqunn uni Im IIIÌL nlưúi JD`(' Trtnll lnh Mu
: gẵi dd» ửng ỵlh' Ilthi l iu
' 16 58. NSX. ÍlDwn!ntNu. Mfg. Exptnùl b… H
i m d…h. L'thg chi oịnh. I.nều Im; n M dùng dl: Ihthg
tin 'lhư ma lumm dia nì um Im… ilm›
Ml'ufln'nd W' Mnnuhtlurul hys :… dn ml:
THYMOORGAN PHARMAZIF. ~ GmbH i THYMOORGAN PHARMAZIE — GmbH ỊẸYỂ°ORGÊNSẸỂMARỵAZIỂ GMB_H
S²híffsmhfn 23… 38690. Vienenhurg ' Germany , Schitfgmbcn 2.1, 38690, Vicnnnhurg - Germany ùn' dfflỀtễ ' ' … '"Ị'ĐW
Puked hy hẹm by- PNG qạzmwxros SA_ưLANT m
PNG GEROLVMATOS SA (PLANT B`) ` PNG GEROLYMATOS SA tpLANT B’) 4Asklxpnw.Krymen ^tlũl. Hẵffl. HY Up
4 Askiỉpinu, Kryonen' Attiki, l4568, Greece 4 Asklipiou. Kryoncri Attiki, l4568, Greece nmug
ĐỂ u du uy hi ơn. Đọc kỹ hlhnl dlu nìdụng Irnk
… IìuL _ A
_ _ i
…… t,,
Phâg . Ẩ.eriuH
_ : 8 n , _, :..
D-3ĩíst '; _. . IìrỉjHỒiJ'i'Q
:
ổ. ` :… '
. -Ệ,í . g_p’. ,_ _
rx_ 38bbliỉf, J ạ:..ipiibUrg … ,___,__ iLm-uuanp-Tn
f- —un—ut
83? g g SANTABIN _,_,
| m……w-nncun
ã I_u-…umulm …Mlmg Wh~'I…
DỢcDII'~~Ọ
» ỉ Ad`nmnợaú_ mthW,
nam c…mmnymơum '…1
. ncht'ưWlhi'ìưuiMiWM
… ..uauu
nn-mmẵ'nwzuuư (ini Doann Mn IV Fa lntmvemus
s…nwu Jat~> \…m; ( em- im'emnũnly
Pniníh
l')«. zuw›ianm xmlư.mì i.-
] Asll…prl um… Au…u luu \ .-.
4ksur
Rx Thuốc kẽ a… L;
Đọc kỹ hưởng dẫn sữ dụng lrước khi dùng
Hỏi bác st hoạc dược sĩdễ biết ma… chi riết
Để xa tấm My Irẻ em
SANTABIN
Bột dông khô pha tỉêm Gemcitabine 200 mg & 1000 mg
THÀNH PHẢN:
Mỗi iọ 200 mg chứa:
Iloạl chất: Gemcitabinc hydrochloride tương đương Gcmcitabine 200mg.
Mỗi iọ 1000 mg chứa:
Hoại chất: Gemcitabinc hydrochloride tương đương Gemcitabine IOOOmg.
Tá dược: Mannitol, Natri acetat, Acid Hydrochlorid (diển chinh pH), Natri hydroxid (diều chinh pH).
DẠNG BÀO CHẾ: Bột dông khô pha tiêm.
)
DƯỢC LỰC HỌC
Nhóm diểu m dược học: Đổng phân của Pyrimidìnc. _
ATC: LOi racos. _/{4/
Z`ảcdungđõc ' ` " ~ ' ` ' ': //
Gcmcitabine có độc tính dáng kể trên nhiều loại tế bâo u cùa nguời và chuột dược nuôi cắy. T ác dụng
dộc :ế bảo dặc trưng ở gỉai doạn mnh giới (31/S. ln vilro, tác dụng độc tể bỉm của gemcitabine phụ
thuộc vảo nồng dộ vả thời gian dùng thuốc.
ủing kháng u lrnag gảc mẩu !iểzz lg'm sòng:
Đối với các mẫu khối u ở loải vật — tác dụng khảng u cùa gemcitabinc phụ thuộc thời bỉểu dùng thuốc.
Khi dùng liều mỗi ngảy, gemcitabine gây chết vật thí nghiệm mà tác dụng kháng u rất ít. Trải lại, khi
dùng liều cách 3 hoặc 4 ngảy ] lần. gemcitabine ờ lỉều không gây chết lại có tác dụng khảng u rất tốt
trên nhiều loại u ở chuột.
C huvến hỏa rể băn vả cơ chế léc ặỏng:
Gemcitabine (dFdC) được biến dưỡng trong tế bảo bởi men nucleosidc kinasc thảnh diphosphate _
(dFdCDP) vả triphosphate (dFdCTP) nucleoside hoạt tính. Tác dụng dộc tế bảo của gemcitabinc là do
dFdCDP vả dFdCTP ức chế quá trinh tống hợp ADN. Trước hết, dFdCDP ức chế men rihonuclcotìdc c .…
reductase, iả men duy nhắt xúc tác cảc phản ứng tạo ra deoxynucleosidc ttiphosphate để tống hợp
ADN. Ức chế men nảy sẽ lảm giảm nổng độ deoxynucleoside nói chung, đặc biệt lả nổng độ dCTP.
Thứ hai lâ, dFdC'I'P cạnh tranh với dCTP để gắn vảo DNA. Tương tự, một luợng nhỏ gemcitabine
cũng có thể gắn vảo RNA. Như vậy, gìảm nồng dộ nội bảo của dCTP khiến cho việc gắn dFdCTP vảo
ADN dễ dảng hơn. Thực chẩt ADN polymcrase epsilon không lhế Ioại bỏ gemcitabine vả sừa lại chuỗi
ADN dang phảt triến. Sau khi gcmcitabine gắn vảo ADN. ] nucleotide nữa gắn thêm vảo chuỗi ADN
đang phát triến. Sau khi gắn thêm nucleotide nảy. sự tống hợp ADN thực sự bí ủc chế hoản loản
(masked chain termination). Sau khi gắn vảo ADN, gemcítabine thủc dẩy quả trinh hùy diệt tế bảo
theo chương trinh dinh trước, được gọi lả "apoptosis"
DƯỢC ĐỌNG HỌC
Dược dộng học cùa Gcmcitabine dã dược nghiên cứu trên 353 bệnh nhân trong 7 nghiên cứu gồm i2ii
phụ nữ vè 232 nam giới trong độ luổi từ 29 đến 79 tuổi. Những bệnh nhân nảy có khoảng 43% măc
ung thu phồí tế bảo khỏng nhỏ vả 35% dược chấn doán ung thư tụy. Các thông số dược động học sau
… dược cho các liều trong khoảng từ 500 đến 2.392 ngm² tiêm truyền tĩnh mạch từ 0,4 đển 1,2 giờ.
+ Nồng dộ dinh lrong huyết lương (đạlđ1mclrong vòng 5 phú! mu khi Iruyền): 3,2 — 45.5 ug/ml.
+ m“ Jic_h phân bố của khoang Irung lăm: 12,4 Vm² ở phụ nữ và l7,5 ưm² ở nam gỉới (biến thiên giữa
các cá thế lá 91,9%).
+ Thế Iích phân bố ở cảc khoang ngoai vi; 47,4 Vm². Giới khõng ảnh hưởng đến thế tich phân bố
ngoại vi
4 Liên kết vái protein huyết lương: khỏng dảng kể.
+ Đó rhanh Ihải loản cư Jhế:
Trong khoảng từ 29,2 llgiờlm²~ 92,2 l/giờlm2 phụ thuộc vảo giới vả tuổi (biến lhiên giữa các cá thể là
52.2%). Độ thanh thải ở phụ nữ khoảng 25% thốp hơn ở nam giới. Mặc dù nhanh nhưng độ thanh thải
ở cả nam gỉới vù nữ giới dền giặm củng vởi luối tác. Ó liều dể nghi 1000 mg/m2 truyền tĩnh mạch
trong thời gian 30 phút, không băt buộc phái giám liêu Gemcitabine khi giâm dộ thanh thải ở phụ nữ
và nam giới.
+ Sự bt`u' n'ếl qua nước liều.- < 10% thuốc dược bâi tiết duởi dạng không chuyền dối.
+ Dỏ Ihanh ma: ở lhặn: 2-1 i/giờim²
f, Thới gian bản Ihải :
Trong khoáng từ 42 dển 94 phủt phụ thuộc vảo luổi vá giởi. Ó Iiều đế nghi, Gemcítnbine thái trừ gần
như hoân toân trong khoáng 5 -i 1 giờ từ khi bắt đầu truyền. Gemcitabine không tích lũy khi dùng \
iần mỗi tuần.
1I/ . -
Chuyến hóa ẠỊểỔ
Gcmcitabinc duợc chuyến hóa nhanh bởi cytidinc deaminase ở gan, thận, máu vả các mô khác.
Chuyển hóa ngoải tế bảo cùa gemcitabinc thảnh dạng mono, di, tríphosphate (dFdCMP, dFdCDP.
dFdCTP), trong đó dFdCDP vù dFdCTP dược coi lá có hoạt tinh Những chất chuyền hóa bên ngoải
mảng tế bảo nảy không được phát hiện trong huyết tương vả nước tiểu.
Chắt chuyển hỏa chủ yếu, 2'-deoxy-2’.2`-điliuoroưridine (dFdU), không phải iâ dạng có hoạt tinh và
dược tim thẩy trong huyết tương vả nước tiểu.
Duợc dộng học của dFdCTP:
Chất chuyển hớa nảy có thề dược tim thấy trong tế bảo mảu dơn nhân ngoại biên và những thông số
sau dược tham khảo từ những lẻ bảo nảy.
Thời glan băn lhái; 0.7 — 12 giờ.
Nồng dộ thuốc nội bảo gia lăng tương ứng vởi Iiều Gemcitabine 35-350 mg/sz30 phủt, với nồng dộ ở
trạng thái ốn đinh dẹt 0,4—5 uglml. Ở nổng dộ Gemcitabỉne huyết thanh itên 5 ụg/ml, nồng dộ dchTP
không tảng — chứng tỏ rằng hoạt chắt nây có lhể được bão hòa trong những tế bảo náy. Sau khi dùng
iiều LOOOmg/m²BO phủl. nổng dộ thuốc gổc trong huyết tương > 5 ụglml khoáng 30 phủt sau kểt thủc
truyền dịch vả nổng độ nảy sẽ cao hon thêm 0,4 ụg/ml nếu thêm ! gíờ.
Dược dậng học của dqu:
Nồng độ đính trong huyểl lương (3-15 phút sau 30 phút truyền I . OOOJng/mz): 28-52 ug/ml
Nồng độ đáy khi dùng [ lắn mỗi !uần: 0.07 — 1,12 ụg/mi. không có sự tích iũy rỏ rảng.
Nống đô huyết rương bn pha lmmg đuơng đường cong rhới gian, lliời gian băn lhải lrung bình của
pha cuối: ss giờ (trong khoảng 33~84 giờ).
Sự hình Ihảnh dqu !ừ chấl gốc: 91%-98%.
Thế lích phăn bố lrung binh của khoang lrung lãm; 18 II…2 (trong khoáng i l~22 llm²).
Thế Iich phán bổ hằng định mmg bình mai).- 150 ifm² (trong khoảng 96 - zzs v…²i.
Phân bố ở mỏ: rắt tộng.
Độ Ihanh Ihải biếu kiến rrung bình: 2,5 llgiờlm² (trong khoáng 14 ifgiờ/m²>.
Bcii tìếl qua nước tiểu: Bải tiết hết qua nước tiểu.
Thái trừ toìtn bộ:
sỏ lượng được tìm Ihấy rrong 1 ruần: 92-98%. trong đó có 99% lá dqu, 1% được bải tiểt vảo phân.
Điều lrị kếl hợp Gemcitabjne vả Carboplan'n: khi điểu tri kết hợp với carboplatin, dược động học cùa
gemcitabine không thay dôi.
Gemei!amin điều rrị kểl họp với Paclitaxel: diển trị kết hợp không Iảm thay đổi duợc động học cùa cả
Gemcitabinc hoặc Paclitaxel.
TƯỢNG TÁC THUỐC VÀ cÁc DẠNG TƯỢNG TẨC KHÁC
Điều trị bằng phương pháp X-quang:
- Đồng lhởi (ltếl họp hoặc điểu lri cóch n/mu S 7 ngủy): Dựa trên kết quả nghiên cứu tiền lâm sảng vả
lám sâng, Gemcitabiuc có hoạt tinh nhạy cám với bt'rc xạ. Trong một nghiên cứu lâm sảng timt, dùng
Gemcitabinc ờ iiều i000 mglm² 6 tuấn lìên tiếp dồng thời với phương pháp xạ trị ngục cho nhũng
hệnh nhân ung thư phổi tể bâo không nhủ, đã xáy … tinh trạng viêm niêm mạc nặng vả có khả náng đe
dọa tinh mạng. dặc biệt viêm thưc quan vả viêm phổi dã dược quan sát thấy đặc biệt ờ những bệnh
nhân nhận Itrợng lởn tia X tmng quả trinh diển trị (Thể tích diển trị trung binh 4795 C…J). Các nghiên
cứu dược thực hiện sau dò dã dề nghị rằng có thể khả thi khi dùng Gemcitabine ở iiều thấp hơn cùng
vởi xạ trì với độc tinh có thể dự doán dược như nghiên cứu pha II ở bệnh tmg thư phổi tế bảo không
nhỏ [ iều diều tri chiếu tia xạ ngực 66 Gy dược dùng dồng thời vởi (ìcmcitabinc (600mg/m, 4 lần) và
Í(£ả
cispiatin (80mglmẫ 2 iần) trong thòi gian 6 tuần Phác dỗ tối ưu và nn toản cho việc dùng đồng thời //
Gemcitnbine với Iiều phỏng xạ diếu trị vẫn chưa dược xảc dịnh
- Liên tục (cách nhau > 7 ngảy): Các thông tin sẵn có không chỉ ra được bất kỳ việc tăng độc tính nảo
khi dùng Gemcimbinc cho những bệnh nhân đã điều trị bằng tia xạ trước dó, hơn iả các bửc xạ thu hổi.
Dữ liệu cho thấy có thể dùng Gemcitabine sau khi không còn những ảnh hưởng cấp tinh của tia bứt: xạ
hoặc ít nhắt 1 tuần sau khi chiếu xạ. Hiện vẫn chưa có thông tin nảo cho thấy có sự gia tăng độc tính
khi nhận xạ trị sau khi dùng Gemcitabine
Các thuốc chống đông máu dụng uống (như Warfarin):
Tăng tẩn suất kiếm soát ti iệ tiêu chuẩn hóa quốc tế ( INR) do tãng nguy co tác dụng chống dông máu,
Vaccin dự phòng bệnh sốt vãng:
Chống chi đinh dùng dồng thời do nguy cơ gây tử vong
Vaccin sống giùm độc lực (ngoại trừ vaccine dự phòng sốt vâng):
Không khuyến cáo sử dụng dồnt,I thời do nguy cơ gây tt“: vong, đặc biệt ở những bệnh nhân suy giảm
miễn dich. Khuyến cáo sử tiụng vnccìne bắt hoạt nền có sẵn ( ví dụ: bệnh bại lỉệt).
Phenytoin:
Khuyến cáo không nên sử dụng dồng thời. Ngưy cơ iám trầm trọng cơn co giật do Iảm giám sự hấp
thu phenytoin ờ dạ dây — ruột. Gia tảng độc tinh. hoặc lảm giảm tảc dụng cùa Gemcitabine do
phenytoin lảm tăng quá trinh chuyển hỏa qua ở gan.
Ciclosporin, tacrolimus:
Ức chế miễn dịch quá mức với nguy cơ Iảm tăng sinh mô bạch huyết
cni ĐỊNH
Ung thư bâng quang
Dùng kết hợp vởi Cisplatin đế diều trị ung thư bảng quang di căn hoặc đang tiến triển tại chỗ.
Ung thư vú: Ung thư vú di cản hoặc dang tiến triển tại chỗ: kết hợp vởi paciitaxel trên những bệnh
nhãn có tái phát sau khi hóa tri Iiệu dược đua ra trước hoặc sau khi phẫu thuật. Hỏa trị liệu trưởc nên
bao gồm với một anthracycline trừ khi có chống chi đinh trên lâm sảng.
Ung thư phổi tế bòo không nhỏ:
Ung thư phổi lề bảo không nhỏ di căn hoặc tại chỗ: kết hợp với các thuốc kim hảm tế bảo khảc. Điều
trị giảm dau ở người 1ởn mắc bệnh ung thư phổi tế bảo không nhỏ di cãn hoặc tiến triến tại chỗ.
Ung thư tuyến tụy
Ung thư tuyến tụy di căn hoặc tiến trìển tại chỗ ở nhũng bệnh nhân thể trạng tốt với dự ttũ tùy xương
cờn đây đủ.
LIÊU LƯỢNG VÀ cÁcu DÙNG
Tiêm truyền sau khi pha ioãng.
Dung dịch pha lại không mâu hoặc có mảu vảng nhạt.
Ung thư bèng quang (diều trị kết bợp): '
Người lởm Liều dề nghị đổi với Gcmcitahine lả ioooing/m². dược truyền 3o phủt. Nên dùng
Gemcitabinc vâo ngảy 1. 8 vá 15 của mỗi chu kỳ 28 ngảy khi dùng kểt hợp với cisplatin. Cisplatin
dùng với Iiều 7OmgIm2 vảo ngây [ sau khi ditng (ìemcitabine hoac ngảy 2 cùa mỗi chu kỳ 28 ngáy.
Chu kỳ 4 tuần nảy sau dó dược lặp iại. Giảm iiều ntỗi chu kỳ hoặc trong 1 chu kỳ là dựa trên dộc tính
xảy ra ở bệnh nhân.
Ung thư vú (điều trị kểt hợp) _. /g(k —
Người lán: Gemcitabine dược dề nghị sử dụng cùng với Paclitaxel như sau: /’/
Paclitaxel (l75mglmz) dược ttuyển lĩnh mạch ttên 3 giờ trong ngảy \ tiếp theo Gemcitabinc
(iZSOmg/mz) truyền tĩnh mạch 30 phủt trong ngảy thứ 1 và ngảy thứ 8 của chu kỳ điều trị 21 ngảy.
Giám liều mỗi chu kỳ hoặc ttong 1 chu kỳ lả dụa trên độc tính xảy ra ớ bệnh nhân. Số lượng bạch cầu
hat tuân phẩn ít nhẩt 1,5x 10°/1 truớc khi điều trị vởi kết hợp cùa Gcmcitabinc + pac1itaxel.
Ung thư phối tế hùo không nhỏ (diều tri kết hợp):
Nguời Iởn: Gemcitabỉne kết hợp với cisplatìn đã được kiềm tra khi sử dụng 2 chế độ liều. \ chế độ
được sử dụng trong thời gỉan 3 tuần và 1 chế độ đuợc sử dụng trong thời gian 4 tuần.
Thời gian 3 tuần sử dụng Gemcitabine tzsomg|m², dược truyền 30 phủt vảo ngảy ] vả ngảy 8 của mỗi
chu kỳ 21 ngảy. Giảm liễu mỗi chu kỳ hoặc trong 1 chu kỳ là dụa ttên dộc tinh xây ra ở bệnh nhân.
Thời gian điều trị 4 tuần sử dụng Gemcitabine 1000mg/mì, truyền vởi thời gian 30 phủt vảo ngảy thứ
1, 8 vả ngảy thứ 15 của mỗi chu kỳ 28 ngảy. Giảm liổu mỗi chu kỳ hoặc trong 1 chu kỳ lả dựa trên độc ,'
tính xảy ra ở bệnh nhân. 1
Liều Cispiatin được sử dụng trong khoảng 75—100mg/m2 1 lền mỗi 3 hoặc 4 tuần.
Ung thư phổi tể bâo không nhỏ (sử đụng đơn độc):
Người Iởn: Liều dề nghi của Gcmcitabine lả 1000mg/m2 truyền trong 30 phủt. Liều nên được lặp 1ại
mỗi tuần trong thời gian 3 tuần. sau đó nghỉ 1 tuần. Sun đỏ, chu kỳ 4 tuần được iặp lại. Giảm liều dựa
trên độc tinh xz'ty … ở bệnh nhân.
Ung thư tuyến tụy
Nguời lởn: Liều đề nghị của Gemcitnbinc lả 1000mg/ml truyền trong thời gian 30 phút. Liều được lặp
lại một lần mỗi tuần lẽn tới 7 tuần. sau dó nghỉ 1 tuần. Chu kỳ tiếp theo truyền Gemcitabinc một lằn
mỗi tuần trong 3 tuần sau dó ] tuần nghi. Giảm Iiều mỗi chu kỳ hoặc trong 1 chu kỳ lả dựa trên độc
tỉnh xảy ra ở bệnh nhản.
Điều chinh liền ở bệnh nhân dộc tính đối với huyết học:
Trước mỗi liểu Gemcitabinc, bệnh nhân phải được kiềm soát số lượng tiểu cầu, bạch cầu và bạch cẩu
hạt. 1.iều gemcitabine phải được giảm hoặc ngùng nểư có độc tính đổi với huyết học theo sự điều
chinh liều dưới đây:
Ung thư phổi tế bảo nho, ung thư bảng quang vả ung thư tụy:
Bảng 1 dưới đây thế hiện việc điếu chinh liễu Gemcitabinc khi sử dụng đớn độc hoặc khi kết hợp với
cisplatin. Điều chinh liều dựa trét: tỉ lệ sat: Vito ngây thứ 8 vâ/hoặc ngây 15 cùa chu kỳ 21 ngảy hay 28
ngảy đổi với ụng thu phối tế bảo khỏng nhỏ vả ung thư bảng quang. vù cho bất kỳ liểu nảo trong chu
kỳ 7 hoặc 3 tuần đối với ung thư tuy.
Bámz ]
Số lượng bẹch cầu hụt toân phồn Số lượng tỉểu eẩu % cũa tỗngriiỷềtlai
3 o
… _ _ _ <:JtJt__ _… __ _ __(L'f’ị'L .… _______ ,
>1 Vả > 100 100
0.5-1 Hoặc 50~100 vs
_ < 0,5 Hoặc < 50 Ngưng dùng † +
* Việc điều trị có thể tiếp tục vảo ngảy thứ 1 của chu kỳ tiếp theo.
— Đổi vởi việc đỉều chính iiều cispiatin khi điều tti kết hợp. xin xem thông tin về việc kê đơn thuốc nảy
từ nhả sản xuất.
Ung thư vú:
Bảng 2 duới đây thế hiện việc diểu chinh liều Gemcitabine khi sử dụng kể! hợp với Paciitaxcl, Việc
diều chinh liều dựa trên tỉ lẽ sau xảy ra vảo ngảy thứ 8 trong chu kỳ 21 ngãy của ung thư vú. /Ứị
Bảng 2: 1/
Số lượng bạch cẩu Số Iuợng tiễu cầu % Tống Iiều
toùn pttầu (x to’m (, mm,
ì 1,2 Vả > 75 100
1 - < 1,2 Hoặc 50-75 75
0,7— <1 Vả ì 50 50
<0,7 Hoặc <50 Ngưng dùng“
* Việc điều tri có thể tiếp tục vâo ngảy 1 của chu kỳ tiếp theo.
Việc điều chỉnh liều của Gemcitabinc (khi dùng kết hợp với Paciitaxel) cho các chu kỳ sau phụ thuộc
vâo độc tinh trên huyết học. Bệnh nhân giảm bạch cầu trung tính có sốt pha 4 —hoặc là bò liễu vảo cảc
ngảy thứ sx hoặc khời đầu chu kỳ trễ (a 2 tuần) vả dùng 15% tiều khới đầu cùa chu kỳ trưởc. Liều
ngảy thứ 8 sẽ dược dùng tương tự liều dùng của liều !.
Việc diều chinh 1iểu paclitaxel trong điếu tri kết hợp, xin xem thông tin kê đơn từ nhà sản xuất.
Người giă:
Gemcitabine dung nạp tốt ở những bệnh nhân › 65 tuối. Mậc dù, độ thanh thải cùa Gemcitabine và
thời gỉan bún thải bị ảnh hướng bời tuối tác, không có đề nghị cụ thể trong việc đíều chinh liều ở
người giả.
Trẻ em:
Gemcitabine chưa được nghiên cứu trên trẻ em. Khõng khuyến cảo dùng thuốc nảy ở trẻ.
Suy gnn vù thặn:
Hiện vẫn chưa có nghiên cứu nảo dược thục hiện trên những bệnh nhân có sưy gan hoặc thận đáng kể
cnờnc cni ĐỊNH
Quá mẫn cảm với Gemcitabinc hoặc với bẩt kỳ thảnh phần nảo của thuốc.
Phụ nữ cho con bú trong thời gian điều trị với Gemcitabinc.
Kết hợp với vaccine dự phòng bệnh sổt vảng.
CẨNH BÁO ĐẶC BIẸT VÀ THẬN TRỌNG KHI SỬ DỤNG.
CẢNH BÁO
Kéo dải thời gian ttuyền vả giảm khoảng cách giữa các 1iếu sẽ 1ảm tăng độc tính.
Ttong một số hiếm trường hợp suy thận, bao gồm hội chứng urc tán huyết đã được háo cz’to. Nên
ngửng điểu tri nếu có đấu hiệu cùa bệnh thiếu máu t:in huyết ở mao mạch như giâm nhanh nồng độ
haemoglobin cùng với sự giảm lượng tiếu cằu, tảng nồng dộ hilirubin huyết thunh. creatinin huyết
thanh, nitơ urê huyết hoặc lactate dehydrogenase. Ngay cả khi ngửng điếu trị với Gemcitabine, suy
thận vẫn không có khả năng hồi phục vú có lhề cằn thiết phái thẩm phân máu.
Ánh hướng dối với phối, thinh thoảng trầm trọng (như phù phổi, viêm phối kẽ hoặc hội chứng suy hô
hẩp ớ ttgười lớn), dã được báo cáo hỉếm khi liên quan tới việc diển tri Gcmcitabine. Nguyên nhân
bệnh của những ânh littớttg nảy vẫn chưa được biết tõ. Nều ủnh hướng trên phổi trớ mìn trầm trọng.
phải ngừng dùng Gemcitabine. Sử dụng sớm cảc biện pháp hỗ trợ có thể cải thiện tinh trạng hệnlt.
Nguy cơ tác dụng không mong muốn xảy ra trên phối ờ bệnh tthản bị ung thư phồi vt’t phổi di căn cao
hớn so với cảc dạng ung thư khác, vì vậy cần cân nhắc khi xem xẻt điểu trị cho những bệnh nhãn nảy.
Sử dụng Gcmcitabine cho những bệnh nhân di căn gan hoặc có tiễu sứ vỉêm gan do dùng thuốc ilưỚC/lr
dó nghiện ruợu, xơ gan: có thề lâm trầm trọng thêm cho người bị bệnh gun tiếm ẩn.
Tương tác giữa Gemcitabine và xạ tri.
Nếu thoát mạch xảy ra, ngưng truyền ngay lập tức và bắt đầu iại với một ven kliảc. Bệnh nhân phải
được theo dõi cấn thận sau khi dùng thuốc.
THẬN TRỌNG
Diều tri với Gemcitabine chỉ nên bắt đầu bời hoặc được tư vấn bời một bác sĩ có nhiều kinh nghiệm
trong việc sử dụng các thuốc gây độc tế bảo.
Bẹnh nhân điểu trị với Gemcitabine phải được theo dõi thật chặt chẽ. Trang thiết bị phòng thi nghiệm
phải có sẵn dễ kiểm tra tinh ttạng của bệnh nhân. Có thể yêu cầu điều trị cho bệnh nhán bị ảnh hướng
bời độc tính.
Ó bệnh nhân suy chức năng tủy xương, nên thận trọng khi bắt dầu điều tri. Với các phương qhảp điều
trị khảc cũng gây độc tế bảo, nguy cơ suy tủy xương tích lũy phải đuợc xem xét khi đang điêu trị với
Gemcitabine cùng với củc phương pháp hỏa trị khác.
Số lượng tiều cẩu. hạch cầu vả bạch cầu hạt phái đuợc kìểm tra truớc mỗi liếu sử dụng. Nổng độ máu
ngoại vi có thể tiếp tục bị xẩu đi sau khi ngưng điều tti với Gemcitabine.
Gemcitabinc phải được sử dụng thận trọng ở những bệnh nhân suy gan thận khi không có dầy đủ
thông tin iâm sảng cho phép sự đề nghị mức liều rõ rảng ở nhóm bệnh nhân nảy.
Bệnh nhân đẹng dùng Gcmcitabinc nên kiềm tra chức nãng gan thận, bao gổm ttansaminasc vả
Creatinin huyêt thanh
Phụ nữ có khả nãng mang thai nẻn thực hiện từng bước để tránh mang thai.
Nam giới đang điều trị với Gemcitabine được khuyên sử dụng biện pháp trảnh thai hiệu quả
PHỤ NỮCÓ THAI vÀ CHO CON BỦ
Phụ nữ có thai
tt
ì?
OiFt
Không có đủ lỉệu về việc sử đụng Gemcitabine ở phụ nữ mang thai. Nghiên cứu trên động vật cho
thẩy cỏ dộc tính dối với khả năng sinh sản. Dựa trẻn kểt quả từ nghiên cứu ở động vật và cơ chế tác
đụng cùa Gcmcitabine, thuốc không nên dùng trong thời gian mang thai đặc biệt trong 3 thảng đầu
tiên của thai kỳ trừ khi thật cần thiết. Phải cân nhắc giũa lợi ich của việc điều tri và nguy cơ có mẻ khả
năng xáy ra cho thai nhì ở mỗi trường hợp cụ thể
Phụ nữ có khá nãng mang thai vả nam giới nên sử dụng cảc biện pháp tránh thai hiệu quả trong thời
gian điếu tri và lên tới 3 tháng sau khi điểu tri. Nam giới đuợc khuyên nên tham khảo thêm lời khuyên
về việc bảo quản các tinh trùng iạnh trước khi điểu tri bới vì khả nãng gây vô sinh.
Phụ nữ cho con bủ:
Gemcitabine không duợc biết lá có bải tiểt vảo sữa mẹ hay không. Cần chống chi đinh cho con bú vì
khả năng ảnh hướng xấu tới trẻ sơ sinh.
Khả năng sinh săn:
Không có dũ1ìệu ưên người về ảnh huởng của Gcmcitabinc trên khả nảng sinh sản. Dũ quan sát thắy
các tác dụng không mong muốn ở động vật
ẨNH HƯỞNG CỦA THUỐC LÊN KHẢ NĂNG LÁ! XE VÀ VẶN HÀNH MÁY MÓC
Gemcitabine có thể gây mệt mỏi từ nhẹ đến vừa, đặc biệt trong những trường hợp có kết hợp với rượu.
Khả năng lái xe và vận hânh máy móc có thế bị ảnh hưởng. Bệnh nhân bị mệt mỏi không nên 1ái xe và
vận hùnh máy móc, /(Q
/l/,
TÁC DỤNG KHÔNG MONG MUÔN
Các tác dụng không mong muốn thường xuyên nhân dã dược báo cảo khi điều trị với Gcmcỉtabine bao
gổm: buồn nôn, có hoặc không có nôn, vả tăng men gan (aspartate aminotransferasefalanine
aminotransfetase) vả alkaline phosphatasc, dược bảo cáo trên khoảng 60% bệnh nhân, protein niệu,
huyết niệu đă được báo cáo trên khoáng 50% hệnh nhân; khó thở dược báo cáo ở 10-40% bệnh nhân
(tỉ lệ cao nhẳt trên bệnh nhân ung thư phổi); phải han da do dị ứng xảy ra ở khoảng 25% bệnh nhân và
liên quan đến ngứa ớ 10% bệnh nhân. Liều lượng. tốc dộ truyền vả khoảng cảch giữa các liều sẽ ảnh
hưt'mg đến tằn suắt vả mức độ trấn: trọng cùa cảc tảo dụng không mong muốn. '1`ảc dụng không mong
muốn 1ỉên quan đến việc hạn chế Iiểti là giám số lượng tiều cầu, bạch cầu và bạch cầu hạt.
Bảng sau là tác dụng không mong mưốn vả tẩn suất dụa trên nghiên cứu lâm sảng vù cảc báo cảo có từ
trong quả trinh đùng thuốc.
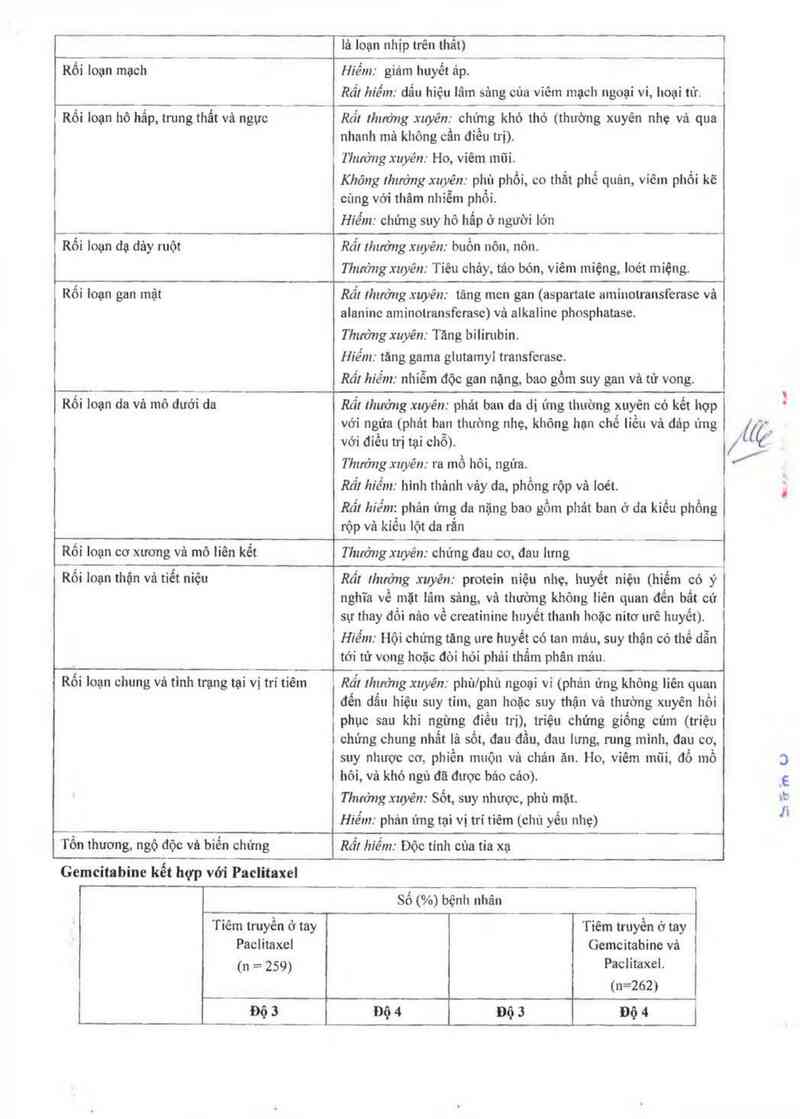
Tần suất: Rất thường xuyên (21/10); thường xuyên (ìl/ 100 — ; rẩt hiếm < 15 (3.1) 3 (1,1)
Tièu cầu 0 o 14 (5,3) I t0.4)
Bạch cầu trung ] 1 (4,2) 17 (6,6)' 82 (31.3) 45 (17,2)*
tính/ bạch cẩu hạt
Giảm bẹch cẩu 3 (1.2) 0 12 (4,6) 1 to.»
trung tinh có sốt
Rối loạn chung vả
tinh trụng tại vi tri
tiêm
Mệt mỏi 3(1,2) ] (0,4) t5(5,7) zto,si
Rối loạn dạ dảy
ruột
Tiêu chây su,9i 0 L_— 8(3,1) 0
Giảm bạch cấu trung tinh độ 4 kéo dải › 1 ngây xảy ra ớ 12,6% bệnh nhân khi dùng kết hợp _
Gemcitabine + Paclitaxel vả 5,0% ở bệnh nhân đùng Paciitaxei ((ộ
Tác dụng không mong muốn gia tãng thì không liên quan dến việc tăng tỉ lệ mắc cảc bệnh nhiễm trùugj _/-
huyết. Mệt mòí vả giâm bạch cầu trung tính có sốt xảy ra thường xuyên khi dùng Gemcitabine kết hợp
với Paciitaxel. Mệt mòí nhưng không liên quan đến thiếu máu thuờng tự khỏi sau chu kỳ đẩu tiên
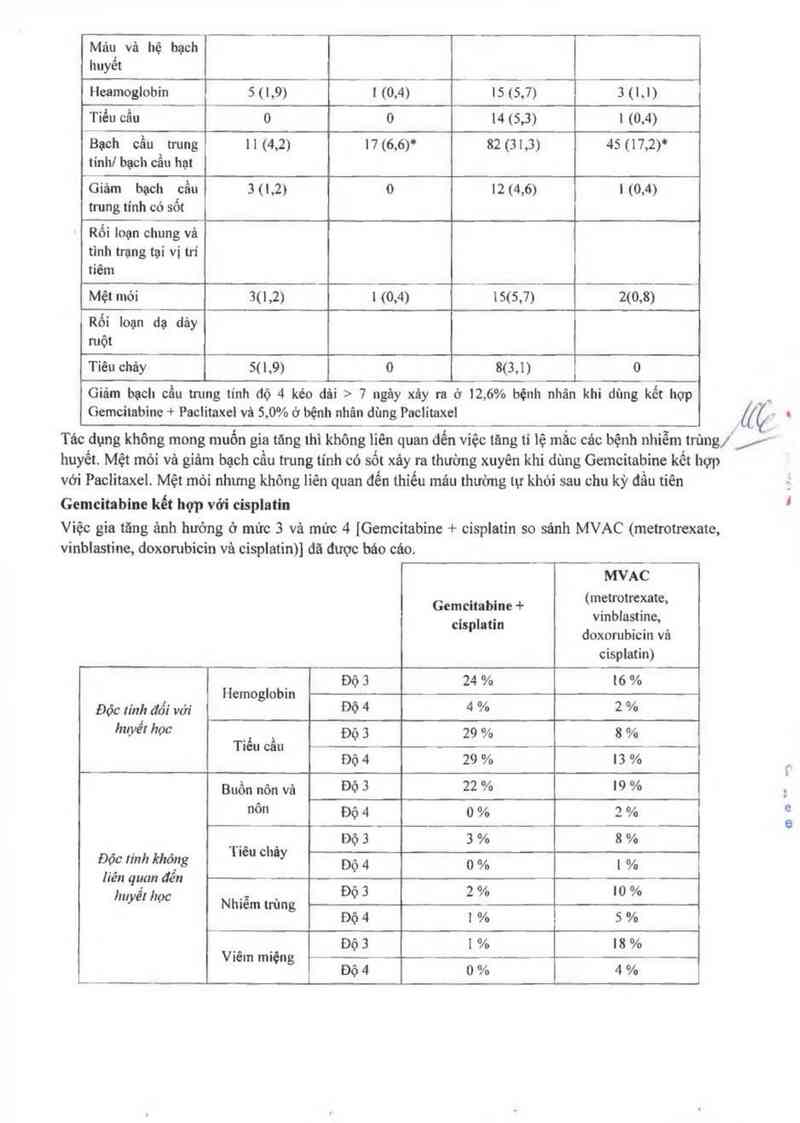
Gemcitabine kểt hợp với cisplatln
Việc gia tăng ảnh hưởng ở mức 3 vả mức 4 [Gemcitabínc + ciSplatin so sánh MVAC (metrotrexate,
vỉnblastine, doxorubicin vả cisplatin)l dã được bớc cảo.
MVAC
Gemcitabine + (lcẵỉỉẫịìẫlaet'e’
cisplatin doxorưbicin vả
cisplatin)
Độ 3 24 % 16 %
Hemoglobin
Độc Iỉnh đối vởi ĐỎ 4 4 % 2 %
'“Wế' học Độ 3 29 % 8 %
Tiểu cầu __ _
Độ 4 29 % 13 %
Buồn nôn vã Độ 3 22 % 19 %
nôn Độ 4 o % 3 %
_ h Dò 3 3 % 8 %
Độc lính khỏng T'ẽ“ ° ỜY Dộ 4 0 % I %
Iiên quan dển Độ 3 2 0/ m 0/
, o o
huyê' học Nhiễm trùng
Dò 4 i % s %
Độ 3 l % 18 %
Víêm miệng
ĐÔ 4 0 % 4 %
o
..`
om.-
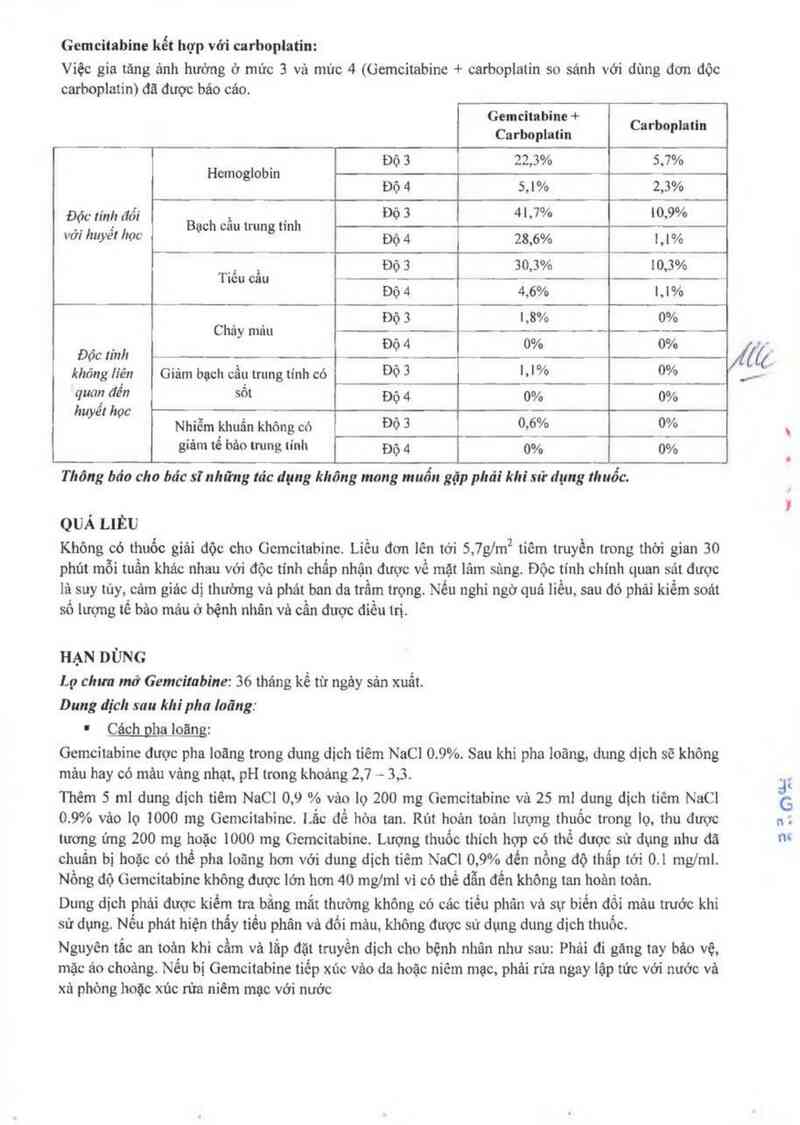
Gemcitabine kết hợp vởi carhoplatin:
Việc gia tăng ánh hướng ở mức 3 và mùc 4 (Gemcitabine + carboplatin so sánh với dùng đơn độc
carboplatin) đă được báo cảo.
Gcmcitabine + .
Carboplatin Carboplatln
Độ 3 22,3% 5,7%
Hemoglobin `
Độ 4 5.1% 2.3%
, .-. Độ3 41,1% 10.9%
Đ.ộc Imỉt đu: Bạch cẩu trung tinh
vơ: huyet học bộ 4 28,6% 1, | %
Độ 3 30,3% 10,3%
Tiếu cẩu » -
Độ 4 4,6% l.l°/o
Dộ 3 1,8% 0%
Chảy máu _ ~Ẻ _ _“
_ , Độ 4 0% 0%
Đọc linh
khỏng liên Giảm bạch cầu trung tinh có Đọỉ "W° 0%
quan đến sốt Độ 4 0% 0%
huyếl hỌC . o o
Nhiễm khuẳn không có ĐỌ 3 0v6 /° 0/°
giảm tế bảo trung tính Độ 4 0% 0%
T hông báo cho bác sĩ những tác dụng không mong muốn gặp phai! khi sử dụng thuốc.
QUẢ LLÊU
Không có thưốc giải độc cho Gemcitabine. Liều đơn lẽn tới 5,7g/m2 tiêm truyền trong thời gian 30
phủt mỗi tuẳn khác nhau với độc tinh chẩp nhận được về mặt lâm sảng. Độc tính chính quan sải được
là suy tùy, cám giác dị thường và phát ban da ttầm trọng. Nếu nghi ngờ quá liều. sau đó phải kiểm soát
số lượng tế bâo mải: ớ bệnh nhân và cần được điểu ttị.
HẠN DÙNG
Lọ chưa mở Gemcitnbine: 36 thảng kế từ ngây sán xuất.
Dung dich sau khi pha loãng:
' M=
Gemcitabine dược pha loãng trong dung dich tiêm NaCI 0.9%. Sau khi pha loãng, dung dich sẽ không
mỉm hay có mâu vâng nhạt. pH trong khoảng 2,7 — 3,3.
Thẻm 5 ml dung đich tiêm NaCI 0,9 % vảo 1ọ 200 mg (iemcitabinc vả 25 ml dung dich tiêm NaCI
0.9% vảo lọ 1000 mg Gemcitahinc. 1.ẳc để hòa tan. Rút hoản toản lưt_mg thuốc trong lọ, thu dược
tương ứng 200 mg hoặc 1000 mg Gcmcitabine. Luợng thuốc thich hợp có thế đuợc sử dụng như đã
chuẩn bị hoặc có thể pha loãng hơn với dung dich tiêm NaCI 0,9% đến nồng dộ thấp tới 0.1 mglml.
Nồng độ Gcmcitabine không được lởn hơn 40 mglml vi có thể dẫn đểu không tan hoản toản.
Dung dịch phải được kiểm tra bầng mắt thường không có các tiều phân vả sự biển đối mảu trước khi
sử dụng. Nếu phát hiện thấy tiều phân vả đối mảu, không được sử dụng dung dich thuốc.
Nguyên tắc an toản khi cầm vả lắp đặt truyền dich cho bệnh nhân như sau: Phải đi gảng tay bảo vệ,
mặc áo choáng. Nếu bi Gemcitabine tiềp xúc vâo da hoặc niêm mạc. phải rửa ngay lập tức với nước vả
xả phòng hoặc xúc rừa niêm mạc vởi nuớc
'l'inh tương hợp cùa Gemcitabinc với các thuốc khác chưa được nghiên cứu Các thuốc vả chất pha
loãng khảc không được trộn lẫn với Gcmcitabine. Không có sự không tượng hợp nâo đuợc quan sz'tt
thẩy với việc sử dụng chai truyền hoặc tủi Polyvinyl Chloride vả bộ dây truyền.
' Lm.dịgz
Tốt nhẩt 1ả đung địch pha loãng được chuẩn bị ngay trước khi sử dụng nhưng dung dịch Gcmcitabinc
có thề bền trong 24 giờ ớ nhiệt độ phòng có kiểm soát
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng