










Product: KUTU SDZ MONTE LUKAST 4MG TOGR SA VN
Puckuge: 7 sơchets
Size: 67 x 30 x 95 mm
Muteriul number: 4616485?
Phơrmucode: 1 l'258
Colors: Puntone 541C, Pơntone 279C, Puntone 268C,
cutter
1 Ì258
gc_….w_
Sundoz Montelukast OGR 4 mg
Montelukast 4mg i
zi SANDOZ
u N0voưflu cumpuny
Mỏ! gỏi mm chúa
quteluiuti tdưđ
dụng Munlelukqsi
nnIri) 4mg
Chi định, Iiẽu dung.
«xh dung va tu:
thong … lhóc …
ucm lờ hướng riủn
u'l dụng.
Eúo quun á nhiẻl đỏ
dvói 30`C, giữ thuoc
nong huo hì gốc đi
minh anh song Vu
dó ó'm,
Tuỏu chuồn NSX
Đoc lty' hmng dún st.
dung hưlc lthi dùng
Giđíhiúc ngcủi tdm
Wi của Nỗ un
Rx Prescription drug
Sundoz Montelukast OGR 4 mg
Montelukast 4mg
Orơl gronule
Box of 7 suchets
/ỈÍVÍI\ . ;
s SA ,D_OIZ 'J~_ .
u Nc«vmfiịi cpmp cuỳí ỉ f
Rx Thuôo bon theo đơn
Scndoz Montelukast OGR 4 mg
Montelukast 4mg
Cốm uống
Hộp 7 gói
5 SANDOZ
1: N…… t…puhy
ỉ“ 1111111111111
——›
SDK
Nhu uin mm
Sundoz Iluc Sơtơyi
ve Ticuet A 5
GE Pth Aka
Mon 9 Coơde
No |, ruuoo
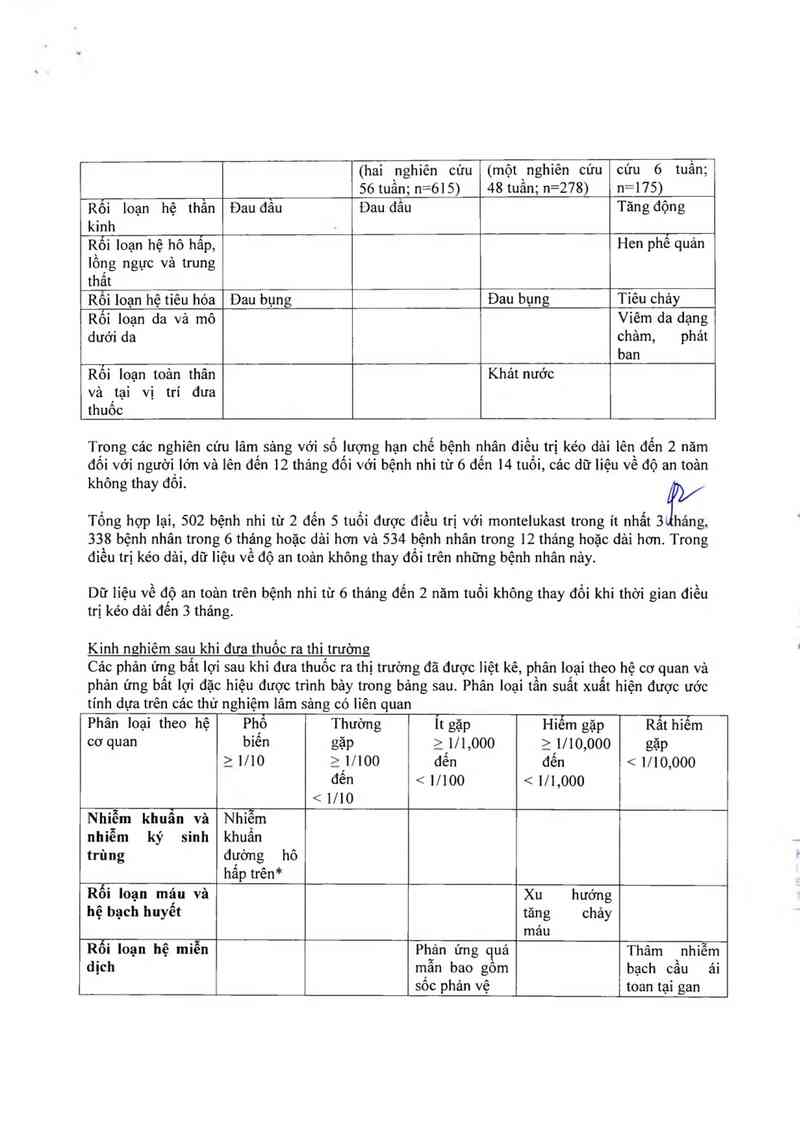
Gubu Ku 1/100 đến < 1/10) iiến quan đến thuốc dưới đây được ghi
nhận từ các thứ nghỉệm lâm sảng trên bệnh nhân được diễu trị bằng montelukast vả ở mức độ lớn
hơn bệnh nhân điếu trị bằng piacebo:
Phân ioại theo hệ Bệnh nhân tử 15 Bệnh nhỉtừỏđến Bệnh nhì tù2 đến Bệnh nhỉ 6
cơ quan tuốỉ trở lên 14 tuốỉ 5 tuối thảng đến 2
(hai `nghiến cứu (một nghỉên cứu (một`nghiến cứu tuốỉ
12 tuân; n=795) 8 tuân; n=201) 12 tuân; n=461) (một nghỉên
(hai nghiên cứu (một nghiên cứu cứu 6 tuần;
56 tuẫn; n=615) 48 tuần; n=278) n=175)
Rối loạn hệ thần Đau đẫu Đau đấu Tăng động
kinh '
Rối loạn hệ hô hấp, Hen phế quản
lồng ngực vả trung
thất
Rối loạn hệ tiêu hóa Dau bụng Đau bụng Tiêu chảy
Rối loạn da vả mô Viêm da dạng
dưới da châm, phát
ban
Rối ioạn toản thân Khát nước
và tại vị trí đưa
thuốc
Trong các nghiên cứu lâm sảng với số lượng hạn chế bệnh nhân điếu trị kéo dải lên đến 2 năm
dôi với người lớn và lên dên 12 tháng đối với bệnh nhi từ 6 đến 14 tuôi, cảc dữ liệu về độ an toản
không thay đôi.
Tống hợp lại, 502 bệnh nhi từ 2 đến 5 tuối được điều trị với montelukast trong ít nhất 3ítĩg,
338 bệnh nhân trong 6 thặng hoặc dải hơn và 534 bệnh nhân trong 12 tháng hoặc dải hơn. Trong
điêu trị kéo dải, dữ liệu về độ an toản không thay đôi trên nhũng bệnh nhân nảy.
Dữ liệu về độ an toản trên bệnh nhi từ 6 thảng déh 2 năm tuổi không thay đối khi thời gian điếu
trị kéo dải đến 3 thảng.
Kình nghỉêm sau khi đưa thuốc ra thì trường
Cảo phản ứng bất lợi sau khi đưa thuốc ra thị trường đã được Iiệt kê, phân loại theo hệ cơ quan và
phản ứng bất lợi đặc hiệu được trình bảy trong bảng sau. Phân loại tần suất xuất hiện được ước
tính dựa trên cảc thử nghiệm lâm sảng có 1iên quan
Phân 1oại theo hệ Phố Thường Ít gặp Hiếm gặp Rất hỉếm
cơ quan bỉên gặp 2 1l1,000 ì Il 10,000 gặp
2 1/10 zI1/1oo dến đến < mo,ooo
đên < 1/100 < 1/1,000
< 1/10
Nhiễm khuẩn và NỂếm
nhiễm ký sinh khuẩn
trùng dường hô
hấptrên*
Rối loạn máu và Xu hướng
hệ bạch huyết tăng chảy
máu
Rối loạn hệ miễn Phản ứng quá Thâm nhỉễm
dịch mẫn bao gôm bạch cầu ải
sốc phản vệ toan tại gan
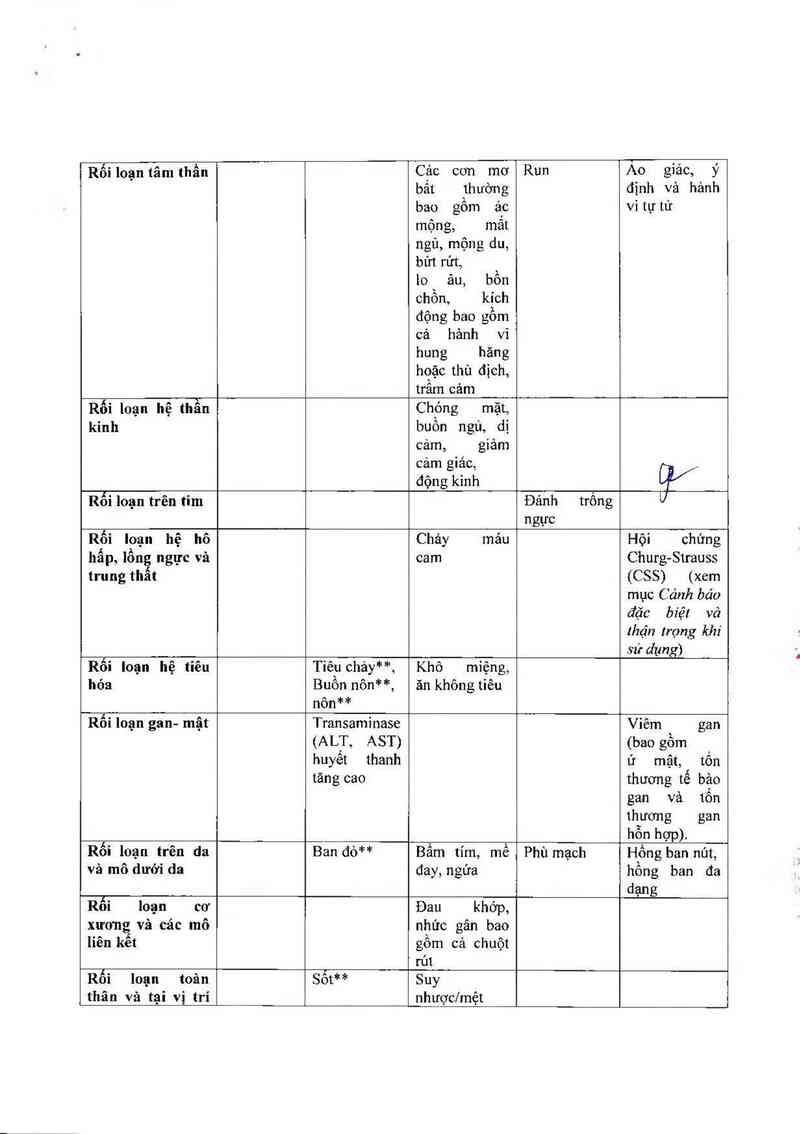
Rối loạn tãm thần
Cảo con mơ
bất thưòng
bao gồm ảo
mộng, mắt
ngù, mộng du,
bứt rứt,
io âu, bồn
ohồn, kích
động bao gồm
cả hảnh vi
hung hăng
hoặc thù địch,
trầm cảm
Run
Ao giảc, ý
định vả hảnh
vitự tứ
á
Rối loạn hệ thân
kỉnh
Chóng mặt,
buôn ngủ, dị
cam, giảm
cảm giác, .
động kinh il/
Rối loạn trên tim Đảnh trống U
ngực
Rối loạn hệ hô Chảy mảu Hội chứng
hấp, lồng ngực vả cam Churg-Strauss
trung thất (CSS) (xem
mục Cănh báo
đặc biệt vả
Ihận trọng khi
sử dụng)
Rối Ioạn hệ tiêu Tiêu chảy**, Khô miệng,
hóa Buồn nôn**, ăn không tiêu
nôn**
Rối loạn gan- mật Transamỉnase Viếm gan
(ALT, AST) (bao gồm
huyết thanh ứ mật, tốn
tăng cao thương tế bảo
gan và tốn
thương gan
hỗn hợp).
Rối loạn trên da Ban đỏ** Bầm tím, mề Phù mạch Hổng ban nút,
và mô dưới da đay, ngứa hồng ban đa
dạng
Rối loạn cơ Đau khớp,
xương và cảc mô
Iiên kêt
nhức gân bao
gôm cả chuột
rút
Rối Ioạn toản
thân và tại vị trí
Sốt**
Suy
nhược/mệt
|Ĩĩưa thuốc | 1 i mỎỈi Phù i i _i
*Các phản ứng bất lợi nảy, được ghi nhận là cảc phản ứng bắt lợi phổ biến trên bệnh nhân dùng
montetukast, củng được ghi nhận lả cảc phản ứng bắt lợi phổ biến trên bệnh nhân dùng placebo
trong cảc thử nghiệm lâm sảng
** Các phản ứng bắt lợi nảy, được ghi nhận lá các phản ứng bất lợi thường gặp trên bệnh nhân
dùng montelukast, cũng được ghi nhận là cảc phản ứng bắt lợi thường gặp trên bệnh nhân dùng
placebo trong cảc thử nghiệm lâm sảng
Thông báo cho bảo sỹ các tác dụng không mong muốn gặp phải khi sử dụng thuốc.
QUÁ LIÊU
Chưa có thông tin đặc hiệu về đỉều trị quá iiếu montelukast. Trong cảc nghiên cứu hen phế quản
mạn tính, montelukast được dùng lỉếu lến đến 200 mg/ngảy cho người lơn trong 22 tuần và cảc
nghiên cứu ngắn hạn, dùng liếu lẻn đến 900 mg/ngảy trong khoảng 1 tuần mà không ghi nhận
được phản ứng bắt lợi nghiêm trọng nảo trên lâm sảng.
Đã có cảc bảo các về quá liếu cấp tinh sau khi đưa thuốc ra thị trường vả trong cảc nghiên cứu
lâm sảng với montelukast. Các báo cảo nảy bao gồm cảc báo cáo trên người 1ớn vả trẻ em với
liếu cao hơn 10… mg (khoảng 61 mg/kg trên trẻ em 42 tháng). Các biền hiện lâm sảng và các xét
nghiệm phù hợp với dữ liệu em toản trên người lớn và trẻ em. Không có cảc phản ứng phụ trong
đa sô các bảo cảo quá liếu. Cảo phản ứng bất lợi thường gặp nhất phù hợp với cảc dữ liệu vô độ
an toản cúa montelukast bao gồm đau bụng, buồn ngú, khảt nước, đau đầu, nôn và tăng động tâm
thần vận động KILJ
Hiện chưa biết liệu montelukast có khả năng thẳm phân qua thẩm phân mảu hoặc phúc mạc hay
không.
ĐẶC TÍNH DƯỌC LỰC HỌC
Nhóm dược lý đ1eu trị: Thuốc điếu trị cảc bệnh tắc nghẽn đươn g hô hấp, các thuốc hệ thống khảo
đê điếu trị cảc bệnh tắc n ghen đươn g hô hấp, đối khảng receptor leukotriene
Mã ATC: ROBDCO3
Cảc cysteine leucotrien (LTC4, LTDỂ, LTEJ4) lả cảc eicosanoid có tảo dụng gây viếm mạnh được
giải phóng từ nhỉếu loại tế bảo bao gồm tế bảo mast vả bạch cầu ải toan Cảo chắt trung gian gây
hen quan trỌng nảy gắn vảo cáo thụ thể leucotrien cysteine (CysLT) Thụ thế CysLT typ 1
(CysLTi) được tim thấy trong đường hô hấp cứa người (bao gôm các tế bảo cơ trơn đường hô hấp
vả vả oảo đại thực bảo đường hô hắp) và trên cảc tế bảo gây vỉêm khác (bao gồm bạch cầu ải
toan vả một số tế bảo thản tùy). Cảo CysLT liên quan đến sinh lý bệnh cúa hen phế quản vả vỉẽm
mũi dị ứng. Trong hen phế quản, cảc leucotrien gây co thắt phế quản, bảỉ tiết chất nhầy, tăng tính
thấm thảnh mạch và huy động bạch cầu ái toan. Trong viêm mũi dị ứng, CysLTs được giải phóng
từ niêm mạc mũi sau khi tiếp xúc với dị ứng nguyên trong các phản ứng ở cả phạ sớm vả pha
muộn và Iiên quan dến cảc triệu chứng cùa vỉêm mũi dị ứng. Dùng CysLT xịt mũi đã cho thẳy
lảm tăng sức đề khảng đường hô hắp qua mũi vả gây các triệu chứng tắc nghẽn.
Montelukast là một chất có hoạt tinh đường uống, thuốc có ải lực cạo và gắn chọn 1ọc trên thụ thê
CysLTl. Trong các thử nghiệm lâm sảng, montelukast ức chế co thăt phế quản do hít LTD4 khi sử
dụng liếu thấp 5 mg. Tảo dụng giãn phế quản của cảc thuôc chủ vận_beta được cộng hợp do tác
dụng cùa montelukast. Điếu trị bằng montelukast có tác dụng ức chế co thăt phế quản ở cả pha
sớm vả muộn do cảc kháng nguyên gãy ra. Montelukast 1ảm giảm bạch cãu ái toan trong mảư
ngoại vi trên người lớn và trẻ em so với nhóm dùng piacebo. Trong một nghỉên cứụ riêng biệt,
diều trị bằng montelukast lảm gỉảm có ý nghĩa bạch câu ái toan trong đường hô hâp (đo trong
đờm) và trong mảu ngoại vi đồng thời cải thiện việc kiểm soát hen trên lâm sảng.
Trong cảc nghiên cứu trên người lớn, montelukast với liếu 10 mg một lần/ngảy cải thỉện có ý
nghĩa thể tích thở ra gắng sức trong 1 giây (FEV.) so với _dùng placebo (thay đổi 10,4% so với
2,7% ban đầu), lưu lượng đỉnh (PEFR) buổi sáng (thay đôi 24,5 Llphút so với 3,3 Llphút ban
dầu) vả lảm giảm có ý nghĩa tổng lượng thưốc chủ vận beta sử dụng (thay đôi — 26,1% so với —
4,6% ban đầu). Cải thiện đỉếm triệu chứng hen phế quản ban ngảy và ban đêm được bệnh nhân
ghi nhận tốt hơn đảng kể so với placebo.
Cảo nghiên cứu trên người trướng thảnh về tác dụng hiệp đồng trên lâm sảng của montelukast với
các corticosteroid dạng hít (% thay đối so với ban đầu khi dùng beclomethason cùng vời
montelukast so với chi dùng beclomethason, tương ứng với FEVi 1ả 5,43% so với 1,04%; sử
dụng các chẩt chủ vận beta 1ả —8,70% so với 2,64%). Khi so sảnh với beclomethason dạng hít
(200 ụg hai lầnlngảy với dạng ống hit), montelukast đã cho thấy đảp ứng ban đầu nhanh hơn, mặc
dù trong một nghiên cứu trên 12 tuần, beclomethason cho thấy tảo dụng điều trị trung bình lớn
hơn (% thay đồi so với ban đầu khi so sánh montelukast với beclomethason, tương ứng đối vởi
FEVI: 7,49% so với 13,3%; sứ đụng cảc chất chủ vận beta: - 28,28% so với — 43,89%). Tuy
nhiên, khi so sánh với beclomethason, một tỷ lệ cao bệnh nhân được điếu trị bằng mđnteìứkast
đạt được đảp ứng iâm sảng tương tự (cụ thể 1ả 50% bệnh nhân điếu trị bằng beciomcthtiiio'ấ có sự
cải thiện FEVi khoảng 1 1% hoặc nhiến hơn so với ban đầu, trong khi có khoảng 42% hếnh nhân
dùng montelukast đạt được đảp ứng tương tự).
Một nghiên cứu lâm sảng đã được thực hiện để đảnh giá hiệu quả của montelukast trong điếu trị
triệu chứng viêm mũi dị ửng theo mùa trên bệnh nhân từ 15 tuối trở iên bị hen phế quản có kèm
theo viêm mũi dị ứng theo mùa. Trong nghiến cứu nảy, vỉên nén montelukast 10 mg dùng một
1ầnlngây cho thấy có tác dụng cải thiện có ý nghĩa thống kê điếm triệu chứng viêm mũi hảng
ngảy khi so sảnh với placebo. Đỉểm triệu chứng viêm mũi hảng ngây là trung bình điếm triệu
chứng viêm mũi ban ngảy (bao gồm nghẹt mũi, sổ mũi, hắt hơi, ngứa mũi) và điếm triệu chứng
ban đêm (bao gổm nghẹt mũi lảm tỉnh giấc, khó ngủ vả điếm thời gian thức giấc bạn đẽm). Đảnh
giả tống thế vỉêm mũi dị ửng đã được cải thìện có ý nghĩa so với nhóm chứng, được thực hiện bởi
cả bệnh nhân và bảo sĩ. Đánh giá hiệu quả của thuốc trên hen phế quản không phải iả mục tiêu
chính trong nghiến cứu nảy.
Trong một nghiên cứu 8 tuần trên bệnh nhỉ (6 đến 14 tuổi), montelukast 5 mg dùng một lằnlngảy
cặi thiện có ý nghĩa chức năng hô hẳp so với placebo (FEV. thay đối 8,71% so với 4.16% bạn
đâu; AM PEFR thay đôi 27,9 l/phủt so với 17,8 l/phút ban đầu) vả 1ảm giảm mức đó cần thiết
phải sử dụng cảc thuốc chủ vận beta (thay đối — 1 1,7% so với + 8.2% ban đầu).
Khả năng lảm giảm có ý nghĩa co thẳt phế quản do gắng sức (EIB) đã được chứng minh trong
một thử nghiệm iâm sảng 12 tuân trên người trưởng thảnh (giảm tôi đa FEVI 22,33% đối với
montelukast so với 32,4% đối với placebo; thời gian phục hồi trong vòng 5% so với ban dầu của
FEVi là 44, 22 phủt so với 60, 64 phút). Tác dụng nảy được duy tri trong 12 tuần nghiên cứu. Khả
năng Iảm giảm EIB cũng đã được chứng minh trong một nghiên cứu ngắn hạn trên bệnh nhi
thảnh (giảm tối đa FEV; 18,27% so với 26,1 1% , thời gian phục hồi trong vòng 5% so với ban
đầu của FEVi lả 17,76 phứt so với 27,98 phút). Hỉệu quả cúa thuốc trong cả hai nghiên cứu nảy
đã được chứng minh ở cuối khoảng Iiếu dùng thuốc một lần trong ngảy
Trên bệnh nhân bị hen phế quản nhạy cảm với aoid acetylsalicylic dùng đồng thời các
corticosteroid dạng hít vả/hoặc dạng uỏng cùng với montelukast có sự cải thiện có ý nghĩa trong
việc kiếm soát cơn hen (thay đổi FEVi 8,55% so với- —1 ,74% ban đầu và giảm tổng lượng thuốc
chủ vận beta sử dụng -22, 78% so với 2,09% ban đầu).
ĐẶC TÍNH DƯỢC ĐỘNG HỌC
Hấp thu
Montelukast được hấp thu nhanh sau khi uống Đối với viến nén bao phim 10 mg, trên người lớn
nồng độ đỉnh trung bình trong huyết tương (Cmax) đạt được sau 3 giờ (T,…) sau khi uỏng thuốc
lúc đói. Sinh khả dụng đường uỏng trung bình là 64% Sình khả dụng đường uống vả Cmax không
bị ảnh hướng bới bữa ăn bình thường. Độ an toản vả hiệu quả cùa thuốc đã được chứng minh
trong cảc thử nghiệm lâm sảng khi dùng vỉên nén bao phim 10 mg không phụ thuộc vảo thời gian
tiêu hóa thức ăn.
Đối với viên nén nhai 5 mg,trên người lớn, nồng dộ đinh Cmax đạt được sau_ khi uổng 2 giờ lúc
đói. Sinh khả dụng đường uỏng trung bình cùa thuôo là 73% và bị giảm xuông 63% do bữa ăn
thông thường.
Phân bộ
Montelukast gắn với protein huyết tương trên 98%. Thể tích phân bố trung bình của montel kast
ở trạng thải ốn định là 8-11 lít. Cảo nghiên cứu trên chuột cống với montelukast gắn phóng xạ
cho thấy sự phân bố hạn chế qua hảng rảo mảu não. Hơn nữa, nồng độ thuốc gắn phóng xạ sau 24
giờ tại các mô khác 15 tối thiếu.
Chuyển hỏa sinh hoc
Montelukast được ohuyển hóa với tỷ lệ 1ớn.Trong cảc nghiên cứu ở liếu điều tri, không phảt hiện
được nồng độ các chất chuyến hóa trong huyết tương cùa thuốc ở trạng thải ôn định trên người
lớn và trẻ em.
Các nghiên cứu in vitro sử dụng microsom gan người cho thấy cytochrome P450 3A4, 2A6 vả
2C9 tham gia vảo quá trình chuyến hóa montelukast. Ngoài rạ, ở nông độ điều trị trong huyết
tương của montelukast không' ưc chế cytochrom P450 3A4,2C9,1A2,2A6,2C19 hoặc 2D6. Các
chất chuyến hóa cùa montelukast it có vai trò trong hiệu quả điếu trị của thuốc
T_hải trừ
Thanh thải huyết tương trung binh cùa montelukast lả 45 ml/phủt trên người lớn khỏe mạnh. Sau
khi uống một liếu montelukast gắn phóng xạ, 86% chất có hoạt tính phỏng xạ được tìm thấy
trong phân thu thập trong 5 ngảy sau và < 0, 2% được tìm thấy trong nước tiếu. Cùng với việc ước
tinh sinh khả dụng đường uống của montelukast, kết quả nảy cho thấy montelukast vả các chất
chuyên hóa của nó được bải tiêt chủ yêu qua mật.
Cảo đăc tính trên bênh nhân
Không cấn thiết hiệu chinh Iiếu trên bệnh nhân oao tuối hoặc bệnh nhân suy gan nhẹ đến trung
bình. Cảo nghiên cứu trên bệnh nhân suy thận chưa được thực hiện Tuy nhiên, do montelukast
vả cảc chất chuyến hóa của nó được thải trừ theo đường mật, không cân thiết phải hiệu chỉnh 1iếu
trên những bệnh nhân nảy. Chưa có cảc dữ liệu vê dược động học cùa montelukast trên bệnh
nhân suy gan nặng (đỉếm Child- Pugh >9).
Với liếu cao montelukast (gấp 20 đến 60 lần Iiếu được khuyến cảo trên người lớn), đã quan sảt
thấy sự giảm nổng của the0phyllin huyết tương. Tảo dụng nảy không được ghi nhận ở liếu 10 mg
được khuyến cảo dùng một iần/ngảy
BẨỌ QUÁN : Bảo quản ở nhiệt độ dưới 30°C, giữ thuốc trong bao bì gốc để trảnh ảnh sảng và
đô âm.
HẠN DÙNG: 24 tháng kế từ ngảy sản xuất.
ĐỎNG GÓI: Hộp 7 gói cốm.
TIÊU CHUẨN: Nhã sản xuất.
CHÚ Ý:
Đọc kỹ hướng dẫn sử dụng trưởc khi dùng.
Nếu cẩn thêm thông tin xin hỏi ý kiểu bác sỹ.
Để xa tầm tay trẻ em.
Thuốc nảy chỉ dùng theo đơn của bảo sỹ.
Tờ hướng dẫn sử dụng nây được duyệt lần cuối tháng 09-2013.
NHÀ SẢN XUẤT: Sandoz Ilac Sanayi ve Ticaret, A.S.
Gebze Plastikciler Organize Sanayi Bolgesi, Ataturk Bulvari 9. Cad. No:], TR-41400 Kocaeli,
Thổ Nhĩ Kỳ
nọ. qth TRƯƠNG
Pi1'RLTONfi Diií—Nci
Jiẳỵượín —Ífil_i| ›hrìn_ỵ
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng