











d`f
"/9c léa—aĐ-sLLD ?
Mamhmmd bylSểm xuát bỞII
Oncoủc Phanna Prodưtion GmbH.
Nn Phammk Deesau. Robiau.
06861. GơmunyĐức
Rebasod bleuAt xưởng bở»:
Janmn Phanneooutia NV.
Tumhoutseweg 30. Boeru B~2340.
BolgiumlBi
Xuất xứ BI
CTĐK: Jmn-Cclng Ltd.. Thai Lm
DfflK:
`
Janssen J
Chi đ|nh. cách dùng. ohóng ohỉ
dinh vá dc thòng tin khác: …
xetnưongùơtuởngdánsủ
dungkèmlhoo.
muóc BÁN THEOĐơN
ae quu TAYTRẺ
ĐỌC KỸ HƯỜNG DAN sữ
oụuo mước KHI nùuo
Lo chứa 100 mg bendamustm
hyứochlorid. tương Gương
90.8 mg bendamustin.
Sau khi hoan nguyên. 1 ml dung
dịch pha tiem omn 2.5 mg
bendanwsun hyửodilofid
SĐK: VN - xxxxx - xx
Hopuo
`
Janssen J
( lnch )
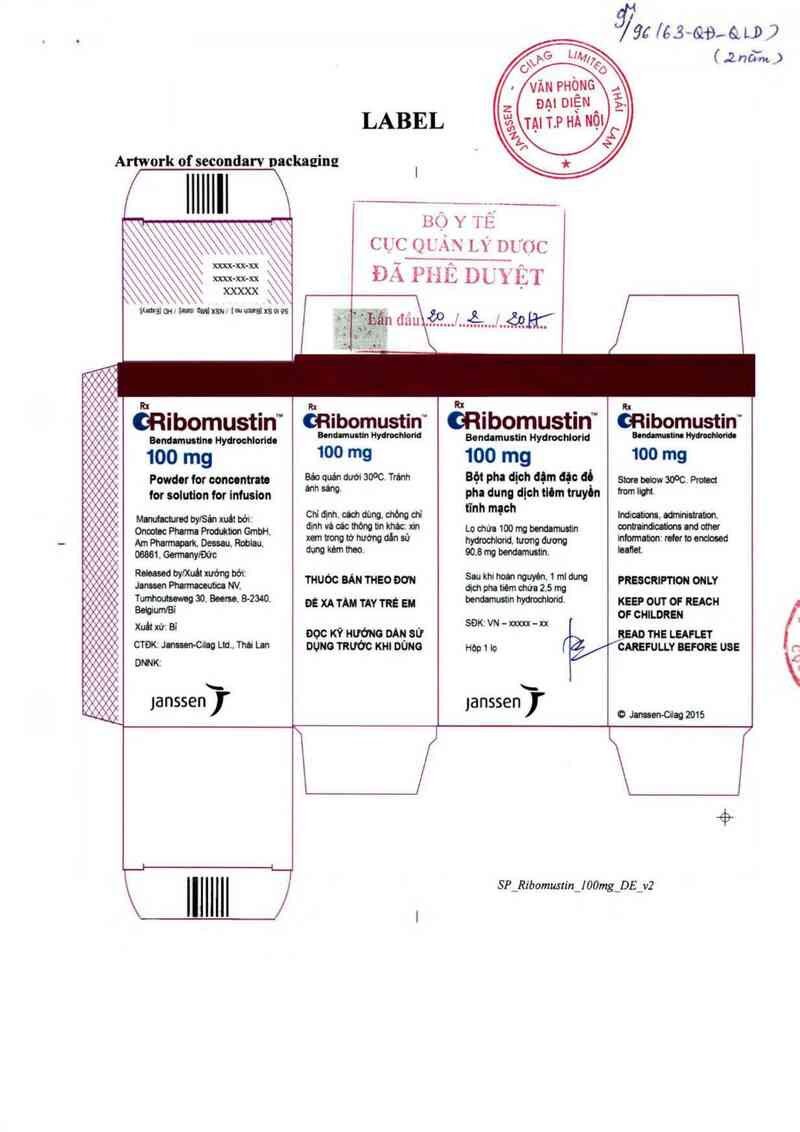
LABEL
Artwork of secondarv nackazinz
HO \
Cl( QL \Ĩ\ l.I \ DI ()(
Đ \ Pu ' xịD L \ Í_ Ì
lmalm lmmxsmlmmlxsouos Lấlì đc… 'quỂ ___~Ậ__ ..... _<ỆQỞ
Ri n : … R! : u . Rl I ' … ù u :
CRubomustm ORlbomustln' ORlbomustm GRlbomustln'
Bom…an Hydmhlorido B'“MM" WW B'ndtmustin Hydrochiodd W… W…
100 mg 100 mg 100 mg 100 mg
Powdor for ooneontmn Bả° °Uản dưới ²°°°- Tfấnh Bột pha dỉ°h dịm đặc GỒ sm … aoOc. P…
for solution for Infuslon °"“ “"“ pha dung dỊch tMm truyòn … …
tĩnh mạch
lndmtiom, mmtrabon
eontrumiedom and omer
infoưnau'on rdu » endosed
luflet
PRESCRIPTION ONLY
KEEP OUT OF REACH
OF CHILDREN
READ THE LEAFLET
/CAREFULLY BEFORE use
0 Januen-Chg 2015
Y—'__ụ"f
\ lllllll /
SP_Ribomusu'nj 00mg_DE_v2
LABEL
Artwork of primary packaging
— ORlbomustln“ 100 mg
~Ả—Ỉ Bendamustlm Hydrochloride ! Bendemustln Hydrochlorid Jỡl'lSSEI'ìÌ
`ịx g au pha enn «… m a phi em m «… ưuyòa … mạch
\ \ Lo đtứe 100 mg bondamustin hydrodũorid. tương dương 90.6 mg bendamustin
` Manulectured by/Sản má! bởi: Onootec Pharma Produklion anH. Gennmyfflức
Released byth xưởng bởi: Janssen Pharmaoeutice NV. BelgiumlBỉ
\ 0 Jmn-Chn 2015
661353 __
PP_ Rib omusu'n _ ] ()0mg_ DE_v2
, “ HÒNG
RIBOMUSTINTM VâẩfmẹNA
Thuốc nây chỉ dùng theo đơn của bác sỹ.
Đ c kỹ hướng dẫn sử dụng trước khi dùng.
Neu cần thêm thông tin xin hỏi ý kiên bác sỹ.
THÀNH PHẦN 5 . _
Bendamustin hydrochlorid dạng bột vi tinh thê, mảu trăng đê hoản nguyên và pha loãng
thảnh dung dịch truyền tĩnh mạch.
Lọ chứa 25 mg bendamustin hydrochlorid, tương đương 22,7 mg bendamustin.
Lọ chứa 100 mg bendamustin hydrochlorid, tương đương 90.8 mg bendamustin.
] ml dịch dậm đặc chứa 2,5 mg bendamustin hydrochlorid khi được hoản nguyên theo
Hưởng dẫn sử dụng và xử lý.
Tả dược: Mannitol
cni ĐỊNH
Bệnh bạch cầu lympho mạn: Điều trị bước một cho bệnh bạch 'cầu lympho mạn (giai
đoạn B hoặc C theo Binet) ở bệnh nhân không thích hợp hóa trị phôi hợp vởi f]udarabin.
U lympho không Hodgkin: U lympho không Hodgkin thế diễn tỉến chậm ở bệnh nhân
bệnh tiến triến sau điều trị với rituximab hoặc hóa trị phối hợp với ntuximab.
Đa u tủy: Điều trị bước một cho đa u tủy (phân loại Durie—Salmon giai đoạn II có tiển
triến hay giai doạn III) phối hợp với prednison ở bệnh nhân trên 65 tuôi mã không thích
họp ghép tế bảo gốc tự thân và bệnh nhân có bệnh lý thềm kinh trên lâm sâng vảo thời
điêm chẩn đoán mà không thể sử dụng đỉếu trị có bortezomib hay thalidomid.
LIÊU DÙNG VÀ CÁCH DÙNG
Dùng tiêm truyền tĩnh mạch trong 30—60 phút.
Bệnh bạch cẩu lympho mạn: bendamustin hydrochlorid 100 mg/m² diện tích bề mặt cơ
thể, vảo ngảy 1 và ngảy 2 cùa cảc chu kỳ, mỗi chu kỳ 4 tuần, tối da 6 chu kỳ.
U lympho không Hodgkỉn: bendamustin hydrochlorid 120 mg/m² diện tích bề mặt cơ
thể, vảo ngảy 1 vả ngảy 2 của cảc chu kỳ, mỗi chu kỳ 3 tuần trong ít nhất 6 đến 8 chu kỳ
(tối đa 8 chu kỳ).
Đa u tủy: bendamustin hydrochlorid 120- ]50 mglm² diện tích bề mặt cơ thể, vảo ngảy 1
và ngảy 2, phối hơp với prednison 60 mg/m² diện tích bề mặt cơ thể tiêm tĩnh mạch hay
uống từ ngảy 1 đến ngảy 4 cúa cảc chu kỳ, môi chu kỳ 4 tuần trong ít nhất 3 chu kỳ.
Nên trì hoãn hay ngừng điều trị nếu số lượng bạch cầu gìảm 3.000 /ụL vả! hoặc số lượng
tiếu cầu giảm < 75. OOQ/ụL. Có thể tiếp tục điểu trị sau khi số lượng bạch cầu tãng >
4. OOO/ụL vả số lượng tiêu câu tăng > 100. OOO/ụL.
Số lượng bạch cầu và tiều cầu thấp nhất đo được sau 14… 20 ngảy, phục hồi sau 3— 5 tuần
Khuyến cáo nên theo dõi chặt chẽ công thức mảu trong khoảng thời gian nghỉ không điều
trị (xem Cảnh bảo và thận trọng).
Pl_Ribomustin_DE_lPl Dec 2014_v1 ] ’]2
Trong trường hợp độc tính không thuộc huyết học, việc giảm liếu phải dựa trên mức độ
độc tính xâu nhất theo Tiêu chuẩn độc tính thường gặp (CTC) của chu kỳ trưởc. Khuyến
cáo giảm 50% liều dùng trong trường hợp độc tính mức độ 3 theo CTC. Khuyến cảo
ngìmg điều trị trong trường hợp độc tính mức độ 4 theo CTC.
Nếu cằn điều chinh lìếu cho một bệnh nhân thì liếu đã giảm được tính riêng cho bệnh
nhãn đó phải được dùng vảo ngảy 1 vả ngảy 2 cùa chu kỳ điếu trị tương ứng
Xem hướng dẫn chuẩn bị vả sử dụng thuốc trong mục Hưởng dẫn sử dụng vả xử lý.
Say gan
Dựa trên dữ liệu dược động học, không cằn điếu chinh liếu ở bệnh nhân suy gan nhẹ
(bilirubin huyết thanh < 1,2 mg/dL). Khuyến cảo giảm 30% liều dùng ở bệnh nhân suy
gan trung bình (bilirubin huyết thanh 1,2— 3 mg/dL).
Khộng có sẵn dữ liệu ở bệnh nhân suy gan nặng (bilirubin huyết thanh > 3 mg/dL) (xem
Chống chỉ định).
Suy th ạn
Dựa trên dữ liệu dược động học, không cần đỉều chỉnh liếu ở bệnh nhân có độ thanh thải
creatinin > 10 mL/phút Kinh nghiệm ở bệnh nhân suy thận nặng còn hạn chế.
Bệnh nhân nhỉ
Tính an toản và hiệu quả của bendamustín trên bệnh nhân nhi chưa được xác lặp do ữ
liệu còn hạn chê.
Bệnh nhân cao tuổi
Không có băng chửng cho thây cân điêu chỉnh liêu ở bệnh nhân cao tuôi (xem Đặc tính
dược động học).
CHỐNG CHỈ ĐỊNI-Ị
Quả mẫn với hoạt chất hoặc với bất kỳ tá dược nảo (xem Tá dược)
Đang cho con bú
Suy gan nặng (bilirubin huyết thanh > 3 mg/dL)
Vảng da
Suy tủy xương nặng vả thay đối số lượng tế bảo mảu nghiêm trọng (bạch cầu giảm <
3.000 fụL vả/ hoặc tỉểu câu gỉảm < 75. OOO/ụL)
Trải qua đại phẫu dưới 30 ngảy trước khi bắt đầu điếu trị
Nhiễm trùng, đặc biệt đi kèm giảm bạch cầu
Đang chủng ngừa bệnh sốt vảng
CẢNH BÁO VÀ THẬN TRỌNG
Say tủy
Bệnh nhân được điếu trị với bendamustin hydrochlorid có thế bị suy tủy (suy tùy xương).
Khi có biến cố suy túy do điều trị, nên theo dõi bạch cằu, tiểu câu, hemoglobin và bạch
cầu trung tính vả đánh giá lại trước khi bắt đầu chu kỳ điều trị tiếp theo. Trước khi bắt
đầu chu kỳ điều trị tiếp theo, khuyến cảo cẩn đạt được cảc thông số sau đây: số luợng
bạch cẩu > 4 OOO/ụL và số lượng tiểu cầu > 100 OOOÍụL.
Suy tủy do điếu trị có thể cân điếu chỉnh liếu vảfhoậc trì hoãn ]iếu. Không nên dùng
ribomustin khi bị suy tùy nặng hoặc thay đồi số lượng tế bảo máu nghiêm trọng. Xem
phần Liều dùng và cách dùng.
Nhiễm trùng
Đã có báo cảo về nhiễm trùng, bao gồm viêm phổi và nhiễm khuẳn huyết. Trong vải
trường hợp hiếm gặp, nhiễm trùng liên quan vởi tỉnh trạng cần phải nhập viện, sốc nhiễm
PI_Ribomustin_DE_lPl Dec zom_w 212
//uSÚJ—x`
trùng và tử vong Bệnh nhân suy tùy sau đỉếu trị với bendamustin hydrochlorid thì dễ bị
nhiễm trùng. Bệnh nhân bị suy tủy sau điều trị với Ribomustin được khuyên liên hệ vởi
thầy thuốc nếu có những triệu chứng hay dấu hiện nhiễm trùng. bao gỏm sốt hay triệu
chứng của đường hô hấp.
Phản ứng trên da
Một sô phản ứng trên da đă được báo cáo Cảo biến cố nảy bao gốm phát ban, phán ứng
độc trên da vả phảt ban da dạng bóng nước Một vải biến có xảy ra khi dùng bendamustin
kết họp với cảc tác nhân chống ung thư khác, do đó chưa rõ mối lìên hệ chỉnh xác. Khi
xuất hiện phản ứng trên da, nêu tiếp tục điếu trị thì cảc phản ứng nảy có thế tíến triến và
nặng lên; vì thế cân theo dõi chặt chẽ cảc bệnh nhân có phản ứng da Nếu phản ứng da
nghiêm trọng hoặc tiến triền nên tạm dừng hay ngừng điều trị Ribomustin. Đối với
nhưng phản ứng trên da nghiêm trọng mà nghi ngờ có liên quan vởi bendamustin
hydrochlorid thì nên ngừng điếu trị Đã có bảo cảo vế cảc trường hợp bị hội chứng
Stevens-Johnson vả hoại tư biếu bì nhiễm độc (TEN) khi dùng bendamustin đồng thời
với allopurinol vả cảc thuốc khác được biết gây nên hội chứng nảy.
Bệnh nhân có các rổi Ioạn tim
Nên theo dõi chặt chẽ nổng độ kali trong mảu trong thời gian điếu trị vởi bendamustin
hydrochlorid và nên bổ sung kali khi K <3, 5 mEq/L và phải đo điện tâm đồ.
Buồn nôn, nôn
Có thể dùng thuốc chống nôn để điếu trị cảc triệu chứng buồn nôn vả nôn.
Hội chứng ly gỉảỉ khổi u '
Đã có bảo cáo về hội chúng ly giải khối u liên quan đển điếu trị với Ribomustin ở những
bệnh nhân tham gía cảc thử nghiệm lâm sảng. Hội chứng nảy có khuynh hưởng xảy ra
trong vòng 48 giờ cùa liều Ribomustin đầu tiên và nêu không can thiệp có thể dẫn đến
suy thận câp và tù: vong. Cảc biện phảp dự phòng bao gôm tình trạng dịch đầy đù, theo
dỏi chặt chẽ sinh hóa mảu, đặc biệt là nông độ kali vả acid uric Có thể cân nhắc sử dụng
allopurinol trong 1 đến 2 tuần đầu tiên điếu trị với Ribomustin nhưng không nhất thiết là
một điều trị tiếu chuẩn.
Sốc phản vệ `
C ảc phán ứn g trong khi truyền đối với bendamustin hydrochlorid thường xảy ra ở cảc thử
nghiệm lâm sảng. Nhin chung cảc triệu chứng thường nhẹ, bao gôm sốt, ớn lạnh, ngứa vả
nôi ban. Trong một số hiếm trường hợp đã gặp phản ứng phản vệ hay sốc phản vệ nặng
Phải hỏi bệnh nhân về các triệu chứng gợi ý phản ứng do truyền sau chu kỳ điều trị đằu
tiên. Phải cân nhắc sử dụng cảc biện phảp phòng ngừa cảc phản ứng nặng bao gồm sử
dụng khảng histamin, hạ sôt vả coưỉcosteroid ở những chu kỳ tiếp theo trên những bệnh
nhân có xảy ra phản ứng tiêm truyền trước đó.
Những bệnh nhân bị phản ứng kiểu dị ứng độ 3 hoặc xấu hơn là những trường họp điển
hình không được sử dụng lại thuốc.
Ngừa thai
Bendamustin hydrochlorid là chất gây đột biến và quải thai.
Phụ nữ không nên có thai trong thời gian điều trị Bệnh nhân nam không nên có con trong
lúc điếu trị vả đến 6 thảng sau điều trị. Cảc bệnh nhân nảy nên được tư vẳn về việc bảo
quản tinh trùng trước khi điếu trị với Ribomustin bởi vì có khả năng bị vô sinh không hổi
phục.
Thoát mạch
Pl_Ríbomustin_DE_lPl Dec 2014_v1
L\J
IQ
e\`ỡ \\
l/ ’/2
Nên ngừng ngay lập tức nếu truyền thuốc ra ngoải mạch. Nên lẳy kim ra sau khi đã hút ra
một ít. Sau đó nên chườm lạnh vùng mô bị tôn thương vả đề cao cảnh tay. Chưa thẳy lợi
ích rõ rảng với những điếu trị hỗ trợ như sử dụng corticosteroid
Bệnh ác tính khác
Đã có bảo cáo về các khối u thứ phát, bao gồm hội chứng rối loạn sinh tủy, cảc rối loạn
tăng sinh tủy, bệnh bạch cằu cấp dòng tủy vả carcìnôm phế quản. Chưa xác định được
môi liên quan với điều trị bendamustin.
Tải hoạt động viêm gan B
Đã có báo cáo về tái hoạt động viêm gan B bao gồm kết cục tử vong và có thể xuất hiện
viêm gan do tải hoạt vi rút viêm gan B. Nên áp dụng cảc biện pháp thích hợp xác định
bệnh nhân nhìễm viêm gan B trước khi điếu trị với Ribomustin, nên theodõi thường
xuyến chức năng gan và các chi dắu (markers) viêm gan B, nên sử dụng thuôo thích hợp
vả/hoặc biện phảp phòng ngừa để ngăn ngừa tái hoạt vi rút viêm gan B.
TƯỚNG TẤC VỚI CÁC THUỐC KHẢC vÀ CÁC LOẠI TƯỚNG TÁC KHÁC
Không có nghiên cứu tương tảc thuốc z'n-vivo.
Khi kết hợp Ribomustin với cảc thuốc gây ức chế tủy, có thế có khả năng ảnh hưởng trên
tủy xương do Ribomustin vả/hoặc các thuốc sử dụng đồng thời. Bất kỳ điều trị nảo lảm
giảm thể trạng cúa bệnh nhân hay suy giám chức nãng tủy xương cũng có thế gia tăng
độc tính của Ribomustin.
Kết hợp Ribomustin với cyclosporin hay tacrolimus có thể dẫn đến ức chế miễn dịch quá
mức với nguy cơ lảm tăng sinh dòng lympho.
Kìm hảm phân bảo có thể lảm giám sự tạo thảnh kháng thể sau chủng ngừa vi rủt sống
giảm độc lực và lảm tăng nguy cơ nhiễm trùng có thể dẫn đến kết cục từ vong. Nguy cơ
nảy tảng lên ở những đối tượng đã bị ức chế miễn dịch bởi bệnh lý nến cùa họ.
Sự chuyền hóa bendamustin liên quan dến enzym có cùng chức năng cytochrom P450
(CYP) 1A2 (xem Đặc tính dược động học). Vì thế, có khả năng xảy ra tương tác với các
chất ức chế CYP1A2 (như fiuvoxamin, ciprofioxacin, acyclovir, cimetidin)
PHỤ NỮ có THAI, CHO CON BÚ VÀ KHẢ NẨNG SINH SÁN
Phụ nữ có thai
Không đủ dữ kiện về việc sử dụng Ribomustin ơ phụ nữ có thai. Trên các nghiên cứu tiền
lâm sảng, bendamustin lả chất gây độc phôi /thai, sinh quải thai vả gây độc gen (xem
Thông tin tiền lâm sảng). Phụ nữ có khả năng mang thai phải dùng các biện phảp tránh
thai hiệu quả trước, trong và một tháng sau khi điếu trị với Ribomustin.
Trong thời gian mang thai, không nên sử dụng Ribomustin trừ khi lợi ích vượt trội nguy
cơ. Người rnẹ nên được biết về nguy cơ đối với thai. Nếu điếu trị với Ribomustin lả hoản
toản cần thiêt trong lúc đang mang thai hay nếu có thai trong khi đang điếu trị, bệnh nhân
nến được biết vê nguy cơ cho đứa trẻ chưa sinh ra và nên được theo dõi cần thận Nên
xem xét khả nảng tư vân về di truyền
Phụ nữ cho con bú
Chưa rõ bendamustin có đi qua sữa mẹ hay không, vì thể chống chỉ định Ribomustin khi
đang cho con bú (xem Chống chỉ định). Phải ngừng cho con bú trong qua'. trình điều trị
vởỉ Ríbomustin.
Khả nãng sinh sản
PI_Ribomustỉn_DE_lPl Dec 2014_v1 4; l 2
{Z
'— 9 >— \ln
II/
'N'l
Nam giới được điếu trị với bendamustin nên được khuyên không có con trong khi điếu trị
và 6 thảng sau khi kết thủc điếu trị. Nên tư vân bảo quản tinh trùng trước điều trị bời vì
có thể xảy ra vô sinh không phục hồi khi điều trị với Ribomustin.
ẨNH HƯỞNG TRÊN KHẢ NĂNG LÁ] XE VÀ VẶN HÀNH MÁY MÓC
Chưa tiển hảnh cảc nghiên cứu về ảnh hướng của thuốc trên khả nãng lái xe vả vận hảnh
máy móc Tuy nhiên, mất điều hòa vận động, bệnh lý thần kinh ngoại vi và ngủ gả đă
được bảo cảo khi điều trị với Ribomustin (xem Tác dụng không mong muốn). Nên hướng
dẫn bệnh nhân trảnh những công việc mang tính nguy hiếm như lải xe vả vận hảnh mảy
móc nếu họ có những triệu chứng nêu trên.
TẢC DỤNG KHÔNG MONG MUÔN
Cảc phản ứng bất lợi thường gặp nhất khi sử dụng bendamustin hydrochlorid là phản ứng
bất lợi vế huyết học (giảm bạch cầu, giảm tiêu câu), độc tính trên da (phản ứng dị ứng),
triệu chứng toản thân (sốt), triệu chứng đường tiêu hóa (buồn nôn, nôn).
Bảng dưới đây cung câp dữ liệu thu được từ cảc thử nghiệm lâm sảng với bendamustin
hydrochlorid.
Pl_Ribomuslin_DE_lPl Dec 2014_v1 5x’ l 2
\“'It
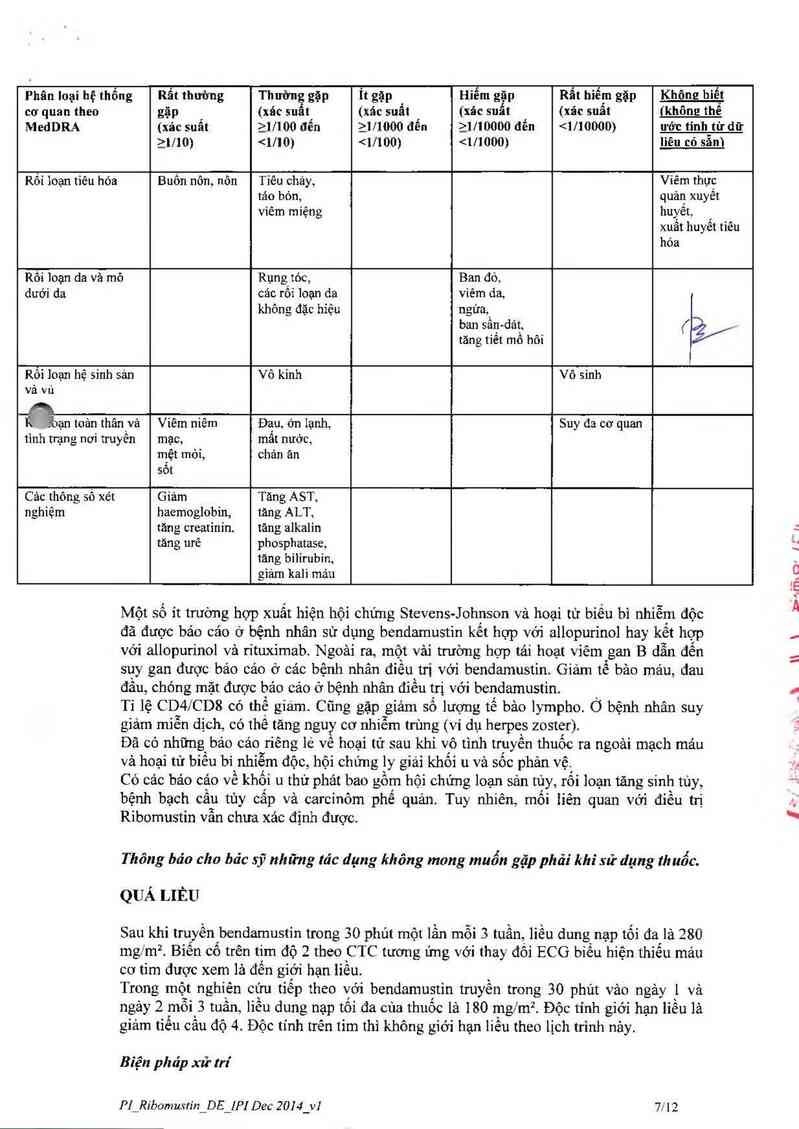
Phân loại hệ Rẩt thường gặp Thường gặp Hiếm gặp Rất hiếm gặp Không biết
thống cơ quan (_>_IJIO) (2… on đến (2111… đến emoooo đễn ( bendamustin > dihydroxy-bendamustin > chất chuyển hóa
oxy hóa > N—desmethyl bendamustin. Trong mật, cảc sán phẩm chuyển hóa chính có tính
phân cực bị thải trừ.
S ưy gan
Ở các bệnh nhân có 30-70% gan bị phá hùy do khối u vả suy gan nhẹ (bilirubin huyết
thanh < 1,2 mg/dL), đặc tinh dược động học không thay đổi. Không có sự khảo biệt có ý
nghĩa giữa bệnh nhân nảy với bệnh nhân có chức năng gan và thận bình thường về Cmax,
tmax, AUC, tuzg, thể tích phân bố và độ thanh thải. AUC và độ thanh thải toản bộ trên cơ
thể của bendamustin tỉ lệ nghịch với bilirubin huyết thanh.
Suy thận
Ở cảc bệnh nhân có độ thanh thải creatinin > 10 mL/phút, kể cả ca'c bệnh nhân phải lọc
máu, không có sự khác biệt có ý nghĩa so vởi bệnh nhân có chức năng gan và thận bình
thường xẻt về C…,,, t…,,, AUC, t…, mề tích phân bố và thanh thải.
Bệnh nhân cao taẩi
Bệnh nhân đên 84 tuôi cũng được bao gồm trong cảc nghiên cứu dược động học. Tuổi
cao không ảnh hưởng đên dược động học của bendamustin.
THÔNG TIN TIỀN LÂM SÀNG
Cảc phản ứng bất lợi không quan sảt thấy trên cảc nghiên cứu lâm sảng ,nhưng đã gặp ở
động vật với mức phơi nhiễm tương tự như mức phơi nhiễm trên lâm sảng và có khả
năng liên quan đến việc sử dụng trên lâm sảng như sau:
Cảo nghiên cứu mô học ở chó cho thấy xung huyết đại thể nhin thấy được ở niêm mạc và
xuất huyết đường tíếu hóa. Nghiên cứu vi thể qua kính hiến vi cho thắy những thay đổi
rộng của mô bạch huyết thế hiện sự ức chế miễn dịch và các thay đối của ông thận vả tinh
hoản cũng như cảc thay đối hoại tứ, teo nhớ của biếu mô tiến liệt tuyến
Các nghiên cứu ở động vật cho thấy bendamustin là tác nhân gây độc thai và quải thai.
Bendamustin gây ra sự khảo thường của nhiễm sắc thể vả là tác nhân gây đột biến gen in-
vivo cũng như in- -vivo Trong nghiên cửu dải hạn ở chuột cải, bendamustin lả tảc nhân
sinh ung thư.
TÍNH TƯỢNG KY
Thuốc nảy không nến trộn vởi cảc thuốc khảc ngoại trừ những thuốc được đề cặp trong
phần Hướng dẫn sử dụng và xử lý.
HẠN DÙNG
PJ_Rìbomustỉn_DE_lPl Dec 2014_v1 101'12
\\'L\ / ….
36 thảng từ ngảy sản xuất.
Không dùng thuốc đã quá hạn sử dụng ghi trên nhãn.
Bột đông khô nên được hoản nguyên ngay sau khi mở lọ thưốc.
Thuôc hoản nguyên cân được pha loãng ngay với dung dịch NaCl 0,9%.
Dung dịch truyền tĩnh mạch
Sau khi hoản nguyên vả pha loãng, thuốc ổn định về hóa học và vật lý trong 3 ,5 giờ ở
25°Cf 60%RH vả trong 2 ngảy ở 2°C đến 8°C trong túi bằng polyethylcn. '
Từ quan điếm về vi sinh học, đung dịch nảy nên được sử dụng ngay tức thì. Nếu không
được sử dụng ngay, người dùng chịu trảch nhiệm về thời gian và điếu kiện báo quan
trước khi sử dụng..
ĐIỀU KIỆN BẢO QUÁN
Giữ thuốc trong hộp đế trảnh ánh sáng.
Bảo quản ở nhiệt độ dưới 30°C.
Để bảo quản thuốc đã hoản nguyên hay pha loãng, xem Hạn dùng.
Ểả/
Để xa tầm tay trẻ em.
QUY CÁCH ĐÓNG GÓI
Bendamustin được đóng gói trong lọ thủy tinh 26 mL hoặc 60 mL mảu nâu loại I với nút
lọ bằng cao su và một nắp lọ bằng nhôm, dễ mớ.
Lọ 26 mL chứa 25 mg bendamustin hydrochlorid.
Lọ 60 mL chứa 100 mg bendamustin hydrochlorid.
Hộp 1 lọ.
HƯỞNG DÂN SỬ DỤNG VÀ XỬ LÝ
Khi thao tác Ribomustin, nến trảnh hít vảo hay tiểp xúc với da vả niêm mạc (mang găng
tay và quần ảo bảo hộ!) Phần cơ thể bị nhiễm thuốc nên được nìa cấn thận bằng nước vả
xả phòng, nên rứa mắt với nước muối sinh lý Khuyến cáo nếu có thế nến pha chế trên
những bản lảm việc an toản đặc biệt không thấm nước, nến hấp thu hoản toản Phụ nữ có
thai tránh không thao tảc xử lý các chất kìm hăm tế bảo
Bột pha dung dịch đậm đặc để pha dung dịch truyền tĩnh mạch phải được hoản nguyên
với nước pha tiếm, pha loãng với dung dịch pha tiêm NaCl 9 mg/mL (0,9%), sau đó sử
dụng bầng cảch truyền tĩnh mạch. Nến sử dụng kỹ thuật vô trùng.
l. Hoản nguyên thuốc
Hoản nguyên mỗi lọ Ribomustin chứa 25 mg bendamustin hydrochlorid trong 10 mL
nước pha tiêm vả lắc.
Hoản nguyên mỗi lọ Ribomustin chứa 100 mg bendamustin hydrochlorid trong 40 mL
nước pha tiêm vả lẳc
Mỗi mL dung dịch đã hoản nguyên chứa 2,5 mg bendamustin hydrochlorid và lá dung
dịch không mảu, trong suốt.
2. Pha Ioãng
Ngay khi thu được dung dịch trong sưốt (thường sau 5- 10 phút) pha loãng ngay toản bộ
liếu khuyến cảo cùa Ribomustin với dung dịch NaCl 0,9% đế được thể tích cuối cùng
khoảng 500 mL.
Ribomustin phái được pha loãng với dung dịch NaCl 0,9% vả không được phép pha với
bất kỳ dung dịch tiêm truyền nảo khác.
PI_Ribomuslin_DE_lPl Dec 2014_v1 1 la' 12
luu\
I
3. Cách dùng ' `
Dung dịch pha chế được trưyên tĩnh mạch trong 30-60 phủt.
Lọ thuôc chỉ sử dụng một lân duy nhât.
HỰỚNG pẨN_ HỦY THUỐC
Bât cứ chê phâm không sử dụng hoặc thừa nên được hủy bỏ theo những qui đinh của
nước sở tại.
Am Pharmapark, Dessau, Roblau, 06861, Đức
Dán nhăn, đóng gói thứ cấp và xuất xưởng lô thảnh phẩm tại:
Janssen Pharmaceutica NV
Tumhoutseweg 30, Beerse, B-2340, Bỉ
Sản xuất tại: Oncotec Pharma Produktion GmbH (%
Công ty đãng ký: JANSSEN-CILAG Ltd., Thái Lan
Mọi câu hỏifBáo cáo tác dụng ngoại ý/ Than phiền chất lượng sản phẫm xin Iiến hệ:
VPĐD Janssen-Cilag Ltd., TP Hồ Chí Minh.
ĐT: +84 8 38214828
E-mail: iacvndrugsafetv’ầrits.ini.com
Phiên bản: JPJ Dec 2014. số 2
PI_Ribomutịn_DE_lPl Dec 2014_v1
Ngảy sửa đôi: 8/5/2015
TUQ. cth TRU'ỚNG
p.TRUờNG pnòwo
Jiỷuyễn JỈểJJ Jfễìny
Pl_Ribomustin_DE_lPl Dec 2014_v1 12/12
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng