



















«… wma n.: ị
… … W … {
It … m 6 I
i…tnun ...—. ì
m...... '
…ummq mm m……
nmu… '
m m ng m … …
u nud uu W uỔưNM
uwt_ml_—Tể_
……um. —.—.
..an- -. l
…...-_…—
_d…ndh_h_lu-D_
lưu _
iÝ…ffl…WWđ
Page 1 of 2
VĂN PHQNG
ĐẠ1 DIẸN
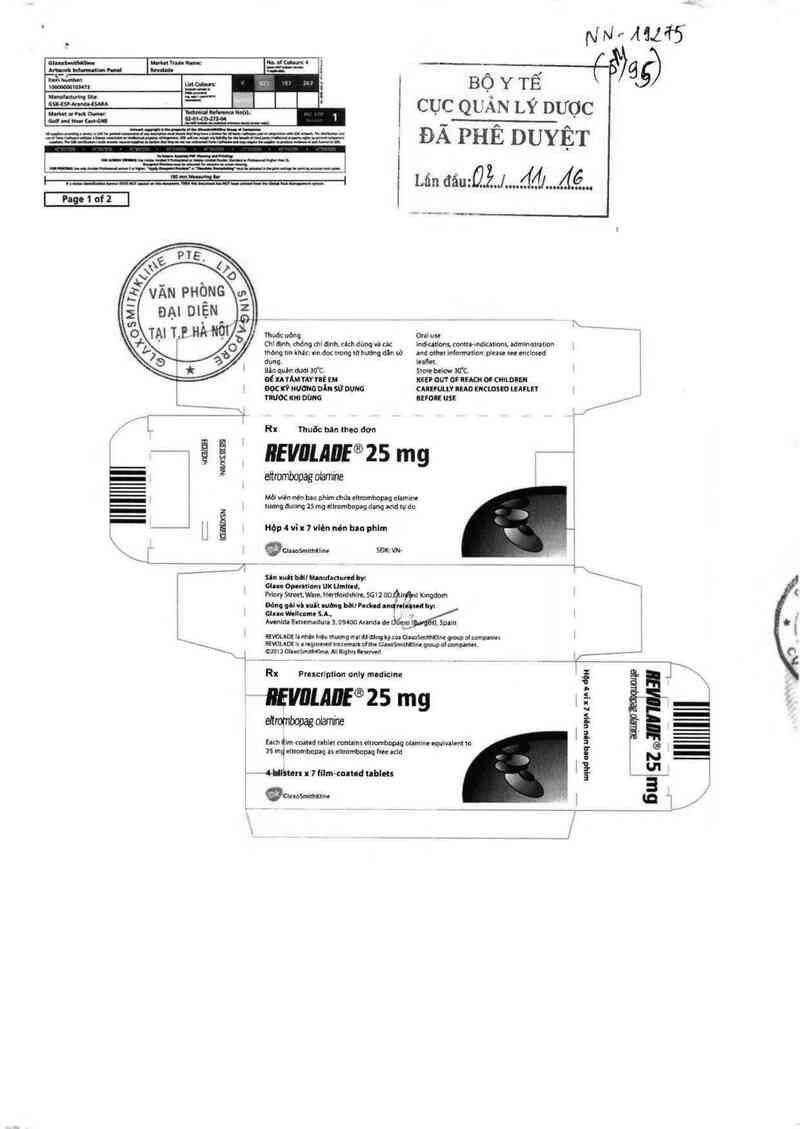
Thuốc uđnq
Chí otnh. chóng chi đinh. dch dùng vì nc
thong tin khdc: xin đoc uong «! hướng dln sử
dụng.
Băn quin dườl 30'C
ot xa fAM nv nè m
oọcưÝ Nưth DẨu sử ounc
rnuơc x… Dt'me
i Ru Thuốc Mn thuc đơn
—.ậẵ
eitmmbopag olamhe
Hộp 4 vi ! 7 viên nẻn hu phim
` ›, '- gcthmimxlme
nrvuuuf®zs mg
Mòi vlên nén ban phim dn): eluombopaq nbmim
4 lưmg đuunq 25 mg elnnrnhepag dang ›dd tự do
N…MM'S'
/
BỘ Y TẾ T
cục QUÁN LÝ DƯỢC
ĐÃ PHÊ DUYỆT
Liin đâu:Qằ...J.….fíđĩl…Ảẽ….
om un
Indinttons, —n ° … …c% =…“ ,, "E… .…th =** “
,.n ff P .1 /Ộ @ #“ «~ 3 nỐ rf> t›® fơt° wÊ ó'o
Ản ` g.dơ° Ỉểa'è f/" Ủẫw""ẵa u*ZẾ® *“Ểom” " ỂỄJ' _“ÍẵẨỔ, …J'Ềr"Ểẵfẵ Í…aụvỵịểẽ, 5 1
o _w* ' o° n nt › ..
=“ầ`t®w …» taú"M ,,ciOồ'Ễgnth WP aeỒ° "Ỉỗu “ÌwM “ °ỉễ V… 4“ m’ "
6 .ề“ sl ro w…th _ …»fflp ' ,ph nob'aẩẩỔ“
wn . . 19 Ol…ư ~ Ư M .
. 19 wtu. 19 =… . ID ìUllL… x 19
4 . - . … a 19 ……
19 ..
ỂCP. #- lOOOOOOOOẢ—ẽởS
ấtii)
.CtrtrNM
ĐẬI DIỆN
N H HÀ Nộ; ỔM/ýố
REVOLADE®
Eltrombopag olamine
Thuốc bán theo đơn
TRÌNH BÀY
Viên nén 25 mg
Viên nén 25 mg bao phim hình tròn, hai mặt lòi, mảu trắng. khắc chữ "GS NX3" vả "25"
ở một mặt. Mỗi viên nén bao phim chứa eltrombopag olamine tương đương vởi 25 mg
eltrombopag dang acid tự do.
Tả dược:
Viên nén trấn: Magnesi stearate, Manm'tol, Microcrystalline cellulose, Povidone,
Sodium starch glycolate.
Bao phim: Opadry White YS-1-7706-G (chứa Hypromellose, Macrogol 400
(polyethylene glycol 400), Titanium dioxide (E171), Polysorbate 80).
Viên nén 50 mg
\fiên nén 50 mg bao phim hình tròn, hai mặt lồi, mảu nâu. khắc chữ “GS UFU" vả "ỆỞ' ở
một mặt. Mỗi viên nén bao phim chứa eltrombopag olamine tương đương vởi 5ang /'
eltrombopag dạng acid tự do.
Tá duợc:
Viên nén trần: Magnesi stearate, Mannitol, Microcrystalline cellulose, Povidone, Sodium
starch glycolate.
Bao phim: Opadry Brown 03826716 (chứa Hypromellose, Macrogol 400 (polyethylene
glycol 400), Titanium dioxide (E171), Iron oxide red (E172), Iron oxide yellow (E172)).
QUY cÁcn ĐÓNG GÓI
Hộp 4 ví x 7 viên.
DẠNG BÀO CHẾ
Viên nén bao phim.
CHỈ ĐINH
REVOLADE được chỉ đ;nh điều trị xuát huyết giảm tiểu cầu miễn dịch (vô căn) (immune
1
4 ( f " _
CONFIDENTIAL UOZ J gng C" 1
€
CONFIDENTIAL
(idiopathic) thrombocytopenic purpura - iTP) mạn tính ở bệnh nhân người lớn khảng trị
với cảc điều trị khác (ví dụ corticosteroid, giobulin miên dịch).
uÊu LƯỢNG vÀ CÁCH DÙNG
Chế độ lìều của REVOLADE phải tính riêng cho từng cá thể dựa trên số lượng tiểu cằu
của bệnh nhản. Dùng liều thắp nhắt có hiệu quả để duy tri số iượng tiểu cầu theo chỉ
định trên lãm sảng.
Ở hầu hết ca'c bệnh nhân, sự tăng số lượng tiểu cầu có thể đo được sau 1 — 2 tuần
(xem Các nghiên cứu lâm sáng).
Người lởn
Lièu REVOLADE khởi đầu được khuyến các lá 50 mg một lần mỗi ngảy.
Theo dõi và điều chỉnh |iểu
Sau liều REVOLADE khởi đầu, chỉnh liều để đạt được vả duy trì số lượng tiếu cầu
P. 50.0001ụl cần thiết để giảm nguy cơ chảy mảu. Không dùng quá liều 75 mglngảy.
Nên theo dõi thường xuyên cảc xét nghiệm lảm sảng vè huyết học và chức năng gan
trong suốt quá trình điều trị vởi REVOLADE vả chỉnh liều REVOLADE dựa trên số
lượng tiếu cầu như trong Bảng 1. Trong suốt quá trinh điều trị với REVOLAIIÌ’E’.J nên
đánh giá hảng tuần công thức mảu toản phần (CBCs), kể cả số lượng tiếu cầu Ẩvỉghổt/
mảu ngoại vi, đến khi đạt được số lượng tiều cầu ồn định (2 50.0001ụl trong it nhất 4
tuân). Sau đó. hảng tháng nèn đánh giá công thức máu toản phần kể cả số lượng tiểu
cầu vả phết máu ngoại vi.
Nên sữ dụng chế độ liều thấp nhất có hiệu quả để duy trì số lượng tiểu cầu theo chỉ
định trên lâm sảng.
Bảng 1 Chỉnh iiều REVOLADE
số lượng tiều cầu Chỉnh liều hoặc đáp ửng
< 50.000/ụ1 sau ít nhắt 2 tuần Tảng 25 mg liều hảng ngảy iên tối đa 75 mglngảỵ
đìều trị
z 200.000/ụl đến 5 400.000/ụ1 Giảm 25 mg liều hảng ngảy. Đợi 2 tuần để đánh giá hiệu
quả của liều nảy vả bắt kỳ sự chỉnh liều nảo tiếp theo.
› 400.000/ụl Ngừng dùng REVOLADE; tăng tần suất kìếm tra tiểu cầu
iên 2 lần/tuằn.
Khi số lượng tiều cầu < 1so.ooomi bắt đầu điều trị iại với
liều hảng ngảy thâp hơn.
CONFIDENTIAL
Sau bảt kỳ sự điều chỉnh liều REVOLADE nản, nẻn theo dõi số lượng tiều cầu it nhất
hảng tuần trong 2 đến 3 tuần. Đợi ít nhầt 2 tuần để xem hiệu quả của bất kỳ sự chỉnh
liều nảo trẻn đáp ứng tiểu cầu của bệnh nhân trước khi xem xét việc chỉnh liều thèm. Ở
bệnh nhân xơ gan (tức suy gan), đợi 3 tuần trước khi tăng liều (xem Các nhóm đối
tượng bệnh nhân, Cảnh báo và Thận trọng).
Điều chỉnh Iiẻu tiêu chuẩn, giảm hoặc tăng. là 25 mg một lần mỗi ngảy. Tuy nhiên, ở
một số it bệnh nhân. có thể cần phối hợp các viên thuốc có hảm lượng khác nhau vảo
cảc ngảy khác nhau.
Nên uống REVOLADE ít nhất 4 giờ trưởc hoặc sau khi uống cảc sản phầm khảo như
thuốc khảng acid, sản phẩm từ sữa, hoặc ca'c chất khoảng bổ sung có chứa cation đa
hóa trị (ví dụ nhôm. caicicalci. sắt, magnesimagnesi, selenselen vả kẽm) (xem Tương
tác, Dược động học — Hấp thu).
REVOLADE có thể dùng cùng vởi thức ăn có chứa ít caici (< 50 mg) hoặc tốt hơn lá
không chứa caicicalcium (xem Tương tác, Dược động học).
Ngừng thuốc
Nên ngừng điều trị với REVOLADE nếu số lượng tiễu cầu không tăng đến mỨẮc'rĩđủ để
tránh chảy mảu nghiêm trọng trèn lâm sảng sau 4 tuần điều trị với REVOLAỐEỞ'TÍẽÍ
75 mg một lần hảng ngảy.
Các nhóm đối tượng bệnh nhân
Người cao tuồi
Dữ liệu về việc sử dụng REVOLADE ở bệnh nhân 65 tuối và lớn hơn còn hạn chế.
Trong các nghiên cứu lâm sảng của REVOLADE. nhìn chung không quan sảt thấy sự
khác biệt có ý nghĩa lâm sảng về tinh an toản của REVOLADE giữa cảc đối tượng tuổi
65 tuối trở lên vẻ cảc đối tượng trẻ hơn. Các báo cảo kinh nghiệm iâm sảng khác chưa
xác định được sự khảo biệt về đảp ứng giữa các bệnh nhân cao tuối vả bệnh nhân trẻ
hơn, nhưng củng không thể loại trừ môt số đối tượng iớn tuồi hơn có sự nhạy cảm cao
hơn.
Suy gan
Nên thận trọng vả theo dõi chặt chẽ khi sử dụng REVOLADE cho bệnh nhân xơ gan
(điểm Child Pugh Z5) (xem Cảnh báo vả Thận trọng). Nếu cần sử dụng REVOLADE
cho bệnh nhãn xuât huyêt giảm tiều cầu vô căn (ITP) bị suy gan , bắt đầu điều trị
REVOLADE ở liều 25 mg một lần hảng ngảy (xem Dược iý iâm sảng, Các nhóm đối
tượng đặc biệt).
Trẻ em
Tính an toản vả hiệu quả của REVOLADE trên trẻ em vẫn chưa được xác iập.
3
CONFIDENTIAL
Bệnh nhân Đông Á
Đối vởi bệnh nhân Đông Á (như Trung Quốc, Nhật Bản, Đải Loan hoặc Hản Quốc) bao
gồm cả những bệnh nhân bị suy gan, có thể cân nhắc giảm liều khởi đầu REVOLADE
xuống còn 25 mg một lằn hảng ngảy (xem Dược iý iâm sảng). Nên tiếp tục theo dõi số
lượng tiểu cầu của bệnh nhân vả tuân theo tiêu chí để chỉnh liều thêm.
CHỐNG CHỈ ĐỊNH
Chống chỉ định với bệnh nhân mẫn cảm với eltrombopag hoặc bất kỳ thảnh phần nảo
cùa thuốc.
CÀNH BÁO VÀ THẬN TRỌNG
Hiệu quả vả tính an toản của REVOLADE chưa được xác lập để sử dụng cho các tỉnh
trạng giảm tiểu cầu khảo kể cả giảm tiễu cầu do hóa trị vả hội chứng loạn sản tùy
(MDS).
Theo dõi chức năno oan: Sử dụng REVOLADE có thể gây ca'c bắt thường về xét
nghiệm gan mật. Trong các thử nghiệm lâm sảng vởi REVOLADE, đã quan sát thắy có
tăng alanine aminotransferase (ALT), aspartate aminotransferase (AST) vả bilirubin
giản tiêp trong huyêt thanh (xem Tác dụng không mong muốn).
Sự tăng nảy hầu hết lả nhẹ (Mức độ 1-2), hồi phục được vẻ không kèm theo cảơưriệu
chứng đảng kể trên lâm sảng có thể cho thầy suy chức nảng gan. Trong haiỉrlghiên/
cứu có đối chừng với giả dược, các biến cố bất lợi tăng ALT đă được báo cảo ở 5,7%
bệnh nhân điều trị vởi REVOLADE vả 4,0% bệnh nhân điều trị vởi giả dược.
Đo ALT, AST vả bilirubin huyết thanh trưởc khi bắt đầu REVOLADE, mỗi 2 tuân trong
giai đoạn chỉnh liều vả hảng thảng sau khi chọn được liều ổn định. Đảnh giá các xét
nghiệm huyết thanh bắt thường cùa gan bằng cách xét nghiệm lặp lại trong vòng 3 đến
5 ngảy. Nếu xảc nhặn có bảt thường. thì theo dõi cảc xét nghiệm huyết thanh của gan
cho đến khi các bất thường được giải quyết, ốn định, hoặc trở lại mức ban đầu. Ngừng
dùng REVOLADE nếu mức ALT tăng (2 3 lần giới hạn binh thường trên (ULNJ) vả:
e Có tiến triển, hoặc
o Dai dắng 2 4 tuần, hoặc
0 Kèm theo tăng bilirubin trưc tiếp, hoặc
o Kèm theo các triệu chứng lâm sảng của tốn thương gan hoặc bầng chứng gan mắt
bù
Thận trọng khi dùng REVOLADE cho bênh nhân bị bệnh gan. Sử dụng liều REVOLADE
khởi đầu thắp hơn khi dùng REVOLADE cho bệnh nhân xơ gan (suy gan) (xem Liều
lượng vá Cách dùng).
CONFIDENTIAL
Biên chứno Huvết khối/ Huvết khôi tắc mach: Biên cổ huyết khối tắc mạch (TEE) Có thể
xảy ra ở bệnh nhân ITP. Theo lý thuyết, số lượng tiểu cầu trên khoảng bình thường cho
thây có nguy cơ bị biến chứng huyết khốilhuyét khối tắc mạch. Trong cảc thử nghiệm
lâm sảng của REVOLADE. đã quan sát thắy ca'c biến cố huyết khối tắc mạch ở số
lượng tiểu cầu thầp vả bình thường. Trong các nghiên cứu ITP. đã quan sát thảy có 21
biến cố huyết khốilhuyết khối tắc mạch ở 17 trong số 446 bệnh nhân (3,8%). Các biến
cố huyết khối tắc mạch bao gồm: thuyên tắc mạch bao gồm cả thuyên tắc mạch phỗi,
huyết khối tĩnh mạch sâu, cơn thiếu máu cục bộ thoáng qua, nhồi máu cơ tim. đột quỵ
do thiếu máu cục bộ, và nghi ngờ PRIND (khiếm khuyết thần kinh do thiếu mảu cục bộ
có hồi phục vả kéo dải).
Thận trọng khi dùng REVOLADE cho bệnh nhân đã biết có cảc yếu tố nguy cơ huyết
khối thuyên tắc mạch (ví dụ. Yếu tố V Leiden. thiếu hụt yểu tố ATIII, hội chứng kháng
phospholipid). Nên theo dõi chặt chẽ số lượng tiểu cầu vả cân nhắc giảm Iliềìu,hoặc
ngừng điều trị vởi REVOLADE nêu số lượng tiểu cầu vượt quá mức mục tiêuĨtem Liều
iượng vè Cách dùng).
Trong một nghiên cứu có đối chứng ở bệnh nhãn giảm tiều cầu mắc bệnh gan mạn tính
(n=288, nhóm đối tượng nghiên cứu về tính an toản) trải qua các thủ thuật xâm lấn theo
chương trình, nguy cơ huyết khối tĩnh mạch cứa tăng ở bệnh nhân được điều trị với 75
mg REVOLADE một lần hảng ngảy trong 14 ngảy. 6 trong số 143 (4%) bệnh nhân
người Iởn mắc bệnh gan mạn tính dùng eltrombopag đã bị biến cố huyết khối thuyên
tắc mạch (tắt cả trong hệ thống tĩnh mạch cứa) vả 2 trong số 145 (1%) đối tượng trong
nhóm giả dược bị biến cố huyêt khối thuyên tắc mạch (1 đối tượng bị tắc hệ thống tĩnh
mạch cửa vả 1 đối tượng bị nhồi máu cơ tim). 5 đối tượng được điều trị với
eltrombopag bị huyết khối thuyên tắc mạch đá bị biến cố nảy trong 14 ngảy sau khi kết
thủc liều dùng eltrombopag vả số lượng tiểu cầu trèn 200.000 pl.
Chảy máu sau khi nơừnq dùnơ REVOLADE: Sau khi ngừng dùng REVOLADE, phần
lớn bệnh nhân số lượng tiếu cầu trở về mức ban đầu trong vòng 2 tuần (xem Các
nghiên cứu lám sáng), mả việc nảy Iảm tăng nguy cơ chảy mẻ… và trong một số trường
hợp có thể dẫn đến chảy máu. Phải theo dõi số lượng tiểu cầu hảng tuần trong 4 tuần
sau khi ngừng dùng REVOLADE.
Sư hình thènh Reticuiin tủy xươno vả nơuv cơ xơ hóa tủy xươno: Chất chủ vận thụ thể
Thrombopoietin (TPO)` bao gồm cả REVOLADE, có thể tăng nguy cơ phát triến hoặc
tiến triển sợi reticuiin trong tủy xương.
Trước khi bắt đầu dùng REVOLADE, kiểm tra kỹ phêt máu ngoại vi để xác định mức độ
ban đầu của các bảt thường hinh thái học tế bảo. Sau khi xác định liêu ổn định
REVOLADE. mỗi tháng cần xét nghiệm công thức mảu toản phần (CBC) vả số lượng
từng loại bạch cầu (WBC). Nêu quan sát thấy tế bảo chưa trưởng thảnh hoặc loạn sản,
kiếm tra phết máu ngoại vi đối vởi các bắt thường hỉnh thái học mới hoặc xắu đi (ví dụ,
CONFIDENTIAL
hống cầu hinh giọt nước mắt vả có nhân, bạch cầu chưa trưởng thảnh) hoặc giảm số
lượng tế bảo máu. Nếu bệnh nhân có những bất thướng hinh thái học mới hoặc xắu đi
hoặc giảm số lượng tế bảo máu. ngừng điều trị bằng REVOLADE vả xem xét việc sinh
thiết tủy xương, bao gồm cả nhuộm để tim xơ hóa.
Bênh ác tính vè sư tiến triển của bênh ác tinh: Có mối quan ngại về mặt iý thuyết rằng
các chất chủ vận TPO-R có thể kích thich sự tiến triển của các bệnh máu ảo tính đang
tồn tại như hội chứng loạn sinh tủy (MDS). Qua cảc nghiên cứu lãm sảng về ITP (n =
493), không cho thắy có sự khảo biệt về ti iệ mắc mới cảc bệnh ảc tính hoặc bệnh máu
ác tinh giữa nhóm bệnh nhân điều trị bằng giá dược vả REVOLADE. Điều nảy cũng
nhât quán với thông tin thu được từ nghiên cứu tiền lâm sảng, mã trong các nghiên cứu
nảy không thấy bằng chứng tảng sinh tế bảo ác tính khi ủ chung REVOLADE với oảo
dòng tế bảo MDS, nhiều dòng tế bảo bệnh bạch cầu và cảc dòng tế bảo bướu đặc (đai
trảng. tuyến tiền liệt, buồng trứng vả phối).
Đuc thủv tinh mẻ.- Trong ca'c nghiên cứu độc tinh của REVOLADE ở loải gặm iưiiảm đã
quan sảt thấy tinh trang đục thủy tinh thế. Mối liên quan iâm sảng của phảt hiệh’gẾy—vẫ'rĩ
chưa được biết. Khuyến cáo nên kiếm tra thường quy tinh trạng đục thủy tinh thể cho
bệnh nhân.
TƯỜNG TÁC
Rosuvastatin: Các nghiên cứu in vitro cho thấy eltrombopag không phải là cơ chắt cho
polypeptide vặn chuyến anion hữu cơ. OATP1B1, nhưng lẻ một chắt ức chế chẳt vận
chuyển nảy. Các nghiên cứu in vitro cũng cho thấy eltrombopag lả 00 chất và chắt ức
chế protein khảng ung thư vú (BCRP = breast cancer resistance protein). Khi dùng
đồng thời REVOLADE vả rosuvastatin trong một nghiên cứu tương tảo thuốc trẻn lâm
sảng (xem Duợo động học). đã có sự tăng nồng độ rosuvastatin huyết tương. Khi dùng
đồng thời với REVOLADE. nên xem xét giảm liều rosuvastatin vả cần có sự theo dõi
chặt chẽ. Trong các nghiên cứu lâm sảng với REVOLADE, khuyến cảo giảm 50% liều
rosuvastatin khi dùng đồng thời rosuvastatin vả REVOLADE Nèn thận trọng khi dùng
đồng thời REVOLADE Với các cơ Chất OATP1B1 vả BCRP khảc.
Ca'c cation đa hóa tn' (sư tao nhức): Eltrom bopag tạo phức với các cation đa hóa trị như
nhôm, calcicaicỉ. sắt, magnesirnagnesi, seienselen vả kẽm (xem Dược động học). Nên
dùng các thuốc khảng acid, các sản phầm từ sữa vả cảc sản phẩm khác có chứa cation
đa hóa trị như các sản phẩm bổ sung khoảng chất cách thời gian dùng REVOLADE ít
nhất 4 giờ để tránh sự giảm đáng kể hắp thu eltrombopag (xem Liều lượng vả Cách
dùng).
Tương tác với thửc ăn: Dùng đơn iiều 50 mg REVOLADE vởi bữa sáng tiêu chuẩn giảu
chât bèo, giảu năng lượng bao gồm cảc sản phẩm từ sữa sẽ Iảm giảm AUCg.m
eltrombopag huyết tương khoảng 59% (90% 01: 54%. 64%) và Cmax khoảng 65% (90%
i` .x`xƠ`
CONFIDENTIAL
Cl: 59%, 70%). Thức ăn chứa hảm lượng thấp calci {<50 mg calci] bao gồm nước hoa
quả. thịt nạc, thịt bò và nước hoa quả không pha thêm (không thêm calci, magnesi,
sắt). sữa đậu nảnh không pha thêm, và ngũ cốc không pha thêm không ảnh hưởng
đáng kể đến nồng độ eltrombopag huyết tương, bất kể hảm lượng calo vả chắt béo thê
nảo (xem Liều lượng về Cách dùng).
Lopinavir/rítonavir: Dùng đồng thời REVOLADE vởi lopinavirlritonavìr (LPV/RTV) có thể
gây giảm nòng độ eltrombopag. Một nghiên cứu trên 40 người tinh nguyện khỏe mạnh
đã cho thấy dùng đồng thời liều đơn REVOLADE 100 mg với liều lặp iại LPVJRTV
400/100 mg hai lần mỗi ngảy gây giảm AUC(O-oo) huyết tương của eltrombopag 17 %
(90 % Cl: 6.6 %; 26,6 %). Do đò, nên thận trong khi dùng đồng thời REVOLADE với
LPV/RTV. Nên theo dõi chặt chẽ số iượng tiếu cầu để đảm bảo có hướng xử lý liều
REVOLADE thich hợp khi bắt đầu hoặc ngưng điều trị lopinavirlritonavir.
Thuốc ức chế vả thuốc gây cảm ứng CYP1A2 vả CYP2Cỡ: Eltrombopag được chuyến
hóa qua nhiều con đường bao gồm CYP1A2 CYPZCS UGT1A1 vả UGTậIẠS. Cảo
thuốc ức chế hoặc gây cảm ứng một enzym đơn độc ĩt có khả năng ảnh hưởng đảng
kề đền nồng độ eltrombopag trong huyết tương, trong khi cảc thuốc ức chế”hoảc*g'ẩy
cảm ứng nhiều enzym có khả năng lảm tảng nồng độ eltrombopag (ví dụ fiuvoxamin)
hoặc giảm nồng độ eltrombopag (ví dụ rifampicin).
Thuốc điều trị xuất huyêt giảm tiểu cằu miễn dịch (ITP): Các thuốc sử dụng trong điều
trị ITP kết hợp vởi eltrombopag trong các nghiên cứu lảm sảng bao gồm corticosteroid,
danazol vảlhoặc azathioprin, globulin miễn dịch tiêm tĩnh mạch (IVIG) vả globulin miễn
dịch kháng kháng nguyên D (anti-D immunoglobulin). Cần theo dõi số lượng tiếu cầu
khi kết hợp eltrombopag với các thuốc khảo điều trị ITP để tránh số lượng tiểu cầu nằm
ngoải phạm vì được khuyến cáo.
THAI KÝ vÀ cnc con BÚ
Eltrombopag không gây quải thai khi nghiên cứu trên chuột cống và thỏ mang thai
nhưng gảy ra tỉ lệ mắc thắp chứng xương sườn cố (biến dang phôi thai) vả giảm trọng
lượng thai ở liều gây độc cho mẹ (xem Thóng tin tiền lâm sảng).
Không có các nghiên cứu có đối chứng tốt vả đầy đủ của REVOLADE trẻn phụ nữ có
thai. Ảnh hướng oủa REVOLADE trẻn thai người ohưa được biết. Chỉ nên dùng
REVOLADE trong thời kì mang thai nêu lợi ích mang lại vượt trội nguy cơ có thể xảy ra
đối với thai nhi.
Vẫn chưa biết liệu eltrombopag có bải tiêt vảo sữa mẹ hay không. Không nên dùng
REVOLADE cho cảc bả mẹ đang cho oon bú trừ khi lợi ích mang lại vượt trội nguy cơ
có thể xảy ra đối với nhũ nhi.
k .
L
CONFIDENTIAL
ẢNH HƯỞNG LÊN KHẢ NÃNG LÁI xe vÀ VẬN HÀNH MÁY Móc
Chưa có nghiên cứu đánh giá ảnh hướng cùa REVOLADE lên khả năng lái xe hoặc vận
hảnh máy móc. Dược lý học cúa eltrombopag không dự báo trước ảnh hưởng bảt lợi
lên cảc hoạt động như thẻ. Cần chú ỷghi nhớ tình trạng lãm sảng của bệnh nhân vả hồ
sơ tác dụng không mong muốn của REVOLADE khi xem xét khả nảng thực hiện cảc
cỏng việc đòi hỏi óc phán đoán, các kỹ nảng vặn động và nhặn thức cùa bệnh nhân
TÁC DỤNG KHÔNG MONG MUÔN
Tinh an toản vả hiệu quả của REVOLADE được chứng minh trong hai nghiên cứu ngẫu
nhiên, mù đôi, CÓ đối chứng vởi giả dược (TRA102537 RAISE Vả TRA1007Ỹ3B) ở
người lớn bị xuất huyết giảm tiếu cầu vô căn mạn tính đã được điếu trị trước đó. Trong
nghiên cứu RAISE 197 đối tượng được chia ngẫu nhiên 2:1, REVOLADE (l'F/lỗẵ) vả
giả dược (n=62). Các đối tượng dùng thuốc nghiên cứu đến 6 tháng. Trong nghiêp__cúm
TRA10077SB, 114 đối tượng được chia ngẫu nhiên và được điều trị đến 42 ngảy với
hoặc giả dược (n=38) hoặc REVOLADE (n=76).
Hầu hết các phản ứng không mong muốn liên quan đến REVOLADE là nhẹ đến trung
binh, xuất hiện sớm và hiềm khi hạn chế việc điều trị.
Các tảo dụng không mong muốn được liệt kê bên dưới theo phân loại hệ thống cơ quan
cùa cơ thể MedDRA vả theo tần suất. Phân Ioại tần suất như sau:
Rất phổ biến 2 1110
Phố biển 211100 vả < 1110
Khỏng phổ biến .>.111.000 vả < 11100
Hiếm 2 1110000 vả < 111.000
Cảc tảc dụng không mong muốn xảc định được ở cảc đối tượng điêu trị bằng
REVOLADE được thế hiện bên dưới:
Nhiễm khuẩn vả nhiễm ký sinh trùng
Phổ biển Viêm họng, Nhiễm khuẩn đường niệu
Rối Ioạn hệ tiêu hỏa
Rắt phổ biến Buồn nôn, Tiêu chảy
Phổ biến Khô miệng, Nôn
Rối Ioạn gan mật
Phổ biến Tảng aspartate aminotransferase, Tảng alanine aminotransferase
Rối Ioạn da và mô dưới da
I”
CONFIDENTIAL
Phổ biển Rụng tóc, Phảt ban
Rối Ioạn cơ xương và mô liên kểt
Phổ bt'ến Đau lưng. Đau cơ xương vùng ngực, Đau cơ xương, Chứng đau
cơ
Dữ liệu sau khi lưu hảnh thuốc
Hiện chưa có dữ liệu sau iưu hảnh thuốc.
Thông báo cho bảc sỹ những tác dụng không mong muốn gặp phải khi sử dụng
thuốc.
QUÁ LIÊU
Triệu chửng vả Dấu hiệu
Trong cảc nghiên cứu lảm sảng, có một bảo cảo quá Iiẻu trong đó đối tượng uống 5000
mg REVOLADE. Cảo tảo dụng không mong muốn được báo các bao gồm phát ban
nhẹ, nhịp tim chậm thoáng qua, mệt mỏi vả tảng transaminase. Các men 9fiỤ đo từ
Ngảy 2 vả 18 sau khi dùng thuốc đạt nồng độ đỉnh ở 1,6 lần ULN với AST, 3,Ể lần LẶJJ
với ALT, và 2.4 lần ULN với bilirubin toản phần. 86 lượng tiểu cầu lả 672.0001pf6'hgảy
18 sau khi dùng thuốc vả số lượng tiểu cầu tối đa lả 929.000/ụ1. Tảt cả cảc biến cố đều
được giải quyết mả không có di chứng sau khi điều trị.
Điều trị
Trong trường hợp quá liềuị số lượng tiểu cầu có thể tăng quá mức vả gây cảc biên
chứng huyết khối/huyết khối thuyên tắc mạch. Trong trường hợp quá Iiẻu. cân nhắc
Á Ă X I | . . . . A `. , ; .
uong che pham co chưa cation km1 ioạ1, như caici, nhom hoạc cac che phẩm magneSi
để tạo phức với eltrombopag vả do đó hạn chế hắp thu. Theo dõi chặt chẽ số lượng tiểu
cầu. Khởi đầu điều trị lại với REVOLADE theo khuyến cáo liều dùng vả cảch dùng (xem
Liều iượng và Cách ơùng).
Do eitrombopag bải tiết không đảng kể qua thận và gắn kết nhiều với protein huyêt
tương, thầm tảch mául loc thận khó có thể đem lại hiệu quả trong việc tăng thải trừ
eltrombopag.
ĐẶC TÍNH oược LÝ
Dược lực học
Cơ chế tác dụng
Thrombopoietin (TPO) lả cytokine chính |iên quan đến sự điều hòa việc sản xuất mẫu
tiểu cầu (megakaryopoiesis) và sản xuất tiểu cầu. vả iả phối tử (ligand) nội sinh cho thụ
thể thrombopoietin (TPO-R). Eltrombopag tương tác VÓ'i vùng xuyên mảng của TPO-R
CONFIDENTIAL
ở người vả khởi phát truyền đạt tin hiệu tương tự nhưng không giống hệt với sự truyền
đạt tín hiệu của thrombopoietin nội sinh (TPO), mả điều nảy kich thich sự tăng sinh vả
biệt hóa của các mẫu tiếu cầu (megakaryocyte) từ cảc tế bảo tiền thân của tủy xương.
Tảo dụng dược lực học
REVOLADE khảo với TPO về tác dụng trên sự kêt tập tiếu cầu. Không giống như TPO,
điều trị tiểu cầu người binh thường bằng REVOLADE không lảm tăng sự két tập gây ra
bởi adenosine diphospate (ADP) h0ặc gây ra biểu hiện P—selectin. REVOLADE không
đối khảng với sư kềt tập tiều cầu gây ra bởi ADP hay collagen.
Dược động học
Các thông số dược động học oủa eltrombopag sau khi dùng REVOLADE cho bệnh
nhân ITP được thế hiện trong Bảng 1.
Bảng 1: Trung binh nhân (95% Ci) các thông số dược động học cùa Eltrombopag
huyết tương giai đoạn ổn định ở người lởn xuất huyết giảm tiều oầu vô oăn
cné độ liều oủa REVOLADE c,… AUC…
(uslmli iuc-0ỉờfmli
50 mg một lần hảng ngảy (n=34) 8.01 108
(6,73; 9,53) (88; 134)
75 mg một lần hảng ngảy (n=26) 127 168
(11,0; 14,5) (143; 198)
Hấp thu va“ Sinh khả dụng
Eltrombopag được hảp thu với nổng độ đỉnh đạt được 2 đến 6 giờ sau khi uống. Dùng
REVOLADE đồng thời với thuốc khảng acid vả cảc sản phầm khảo oó chứa cảo.pạtion
đa hóa trị như sản phẩm từ sữa vả sản phấm bổ sung khoảng chắt lảm giảm đéng kể
nồng độ eitrombopag (xem Liều lượng và Cách dùng, Tương tác). Chưa xảo Iặp'được
sinh khả dụng tuyệt đối của eitrombopag trên người sau khi uống. Dựa trện sự bải tiểt
qua nước tiểu và các chắt chuyến hóa được thải trừ qua phân, ước tinh hắp thu đường
uống của cảc chắt liện quan đến thuốc sau khi dùng liều đơn 75 mg dung dịch
eltrombopag it nhảt là 52%.
Phân bố
Eltrombopag gắn kêt cao với protein huyêt tương người (> 99,9%). EltrombOpag lả cơ
chảt cho BCRP, nhưng không lả cơ ohất cho P-glycoprotein hay OATP1B1.
10
CONFIDENTIAL
Chuyển hóa
Eltrombopag được chuyển hóa chủ yếu qua sự phân cắt, oxy hóa vả liên hợp với acid
glucuronic, glutathione, hoặc cysteine. Trong nghiên cứu gắn đồng vị phóng xa ở
người, eltrombopag chiêm khoảng 64% AUCủ oủa carbon phóng xạ trong huyết tương.
Các chắt chuyển hóa chiếm số lượng nhỏ, mỗi chắt chiếm < 10% hoạt tinh phóng xạ
trong huyết tương, sinh ra do sự glucuronid hóa vả oxy hóa cũng được phảt hiện. Dựa
trên nghiên cứu eltrombopag gắn đồng vị phóng xa ở người, ước tĩnh khoảng 20% liều
được chuyển hóa bằng cảch oxy hóa. Các nghiên cứu in vitro xảo định CYP1A2 vả
CYP208 lá các isoenzyme chịu trảch nhiệm chuyển hóa oxy hóa. uridine
diphosphoglucuronyl transferase UGT1A1 vả UGT1A3 lá các isozyme chịu trách nhiệm
glucuronid hóa, vả vi khuẩn trong đường tiêu hóa dưới có thể có tảo dụng đối với con
đường phân cắt.
Thảỉ trừ
Lượng eitrombopag hắp thu được chuyển hóa rộng răi. Con đường thải trừ chinh của
eltrombopag lả qua phân (59%) và 31% liều dùng được tim thẩy trong nước tiểu dưới
dạng chất chuyền hỏa. Không phảt hiện thắy ohất gốc chưa biến đỗi (eltrombopag)
trong nước tiếu. Eltrombopag dạng không biến đổi bải tiết qua phân chiếm khoảng 20%
liều dùng. Thời gian bán thải trong huyết tương của eltrombopag xấp xỉ21-32 giờ.
Ca'c tương tác dược động học
Dựa vảo môt nghiên cứu trên người với eltrombopag được gắn đồng vị phóng xạ, sự
glucuronid hóa đóng vai trò nhỏ trong sự chuyến hóa của eltrombopag. Các nghiện cứu
trên microsome cùa tế bảo gan người xảo nhận UGT1A1 vả UGT1A3 iả các enzyme_ _
chịu trảch nhiệm glucuronid hóa eitrombopag. Eitrombopag là chắt ức chế một số
enzyme UGT in vítro. Về mặt lâm sảng, không tiên đoản được trước các tương tảo
thuốc đáng kể liên quan đén sự glucuronid hóa do sự đóng góp hạn ohế cũa từng
enzyme UGT riêng lẻ trong sự glucuronid hóa eltrombopag vả cảc thuốc dùng đồng thời
có khả năng tương tác.
Dựa vảo nghiên cứu trện người với eltrombopag được gắn đồng vị phóng xạ, khoảng
21 % liều eltrombopag có thể được chuyền hóa bằng cảch oxy hóa. Ca'c nghiên cứu trện
microsome tế bảo gan người xảo định được CYP1A2 vả CYP2Cỡ lả cảc enzyme oó vai
trò oxy hóa eltrombopag. Trong cảc nghiên cứu sử dụng microsome tế bèo gan người,
eltrombopag (lên tới 100 ịJM) không cho thấy tác dụng ức chế in vitro nhóm enzyme
CYP4SO như 1A2, 2A6, 2019, 2D6, 2E1, 3A4/5, vả 4A9/11 và là chắt ức chế CYPZCỡ
vả CYP2C9 được đo khi sử dụng paclitaxel vả diclofenac Iảm cảc cơ chắt thảm dò, với
|Cso tương ứng lả 24,8 ụM (11pglml) vả 20,2 ụM (8,9 ugfmi). Dùng REVOLADE 75 mg
một lần mỗi ngảy trong 7 ngảy oho 24 nam giới khỏe mạnh không gây ức chế hoặc gảy
ra chuyển hóa các cơ ohất thảm dò đối với 1A2 (caffeine), 2019 (omeprazole), 209
11
CONFIDENTIAL
(flurbiprofen), hay 3A4 (midazoiam) ở người. Không oó tương tảo đáng kể trên Iảm
sảng được dự bảo khi dùng đồng thời REVOLADE với oảo cơ chắt, các chắt cảm ứng
hay ức chế CYP4SO.
Cảo nghiên cữu in w'tro chững minh rằng eltrombopag lả ohất ức chế chất vận chuyến
OATP1B1, với giá trị lo50 lả 2,7 ụM (1,2 pg/mi) và lá ohât ức chế chắt vận chuyển
BCRP vời giá trị ICSO lả 2,7 ụM (1,2 ụglml). Dùng REVOLADE 75 mg một lần mỗi ngảy
trong 5 ngảy với lièu đơn 10 mg rosuvastatin là cơ chảt của OATP1B1 vả BCRP cho 39
đối tượng người lởn khỏe mạnh lảm tăng rosuvastatin huyêt tương Cmax 103% (90% CI:
82%. 126%) và AUCọ.eo 55% (90 % CI: 42%, 69%) (xem Tương táo).
Dùng liều đơn REVOLADE 75 mg với cảc thuốc kháng acid chứa cation đa hòa trị
(1524 mg nhôm hydroxide vả 1425 mg magnesi carbonate) lảm giảm AUC…
eltrombopag huyết tương khoảng 70% (90% CI: 64%, 76%) và Cmax khoảng 70% (90%
CI: 62%, 76%) (xem Liêu tượng va“ Cách dùng, Tương tác).
Dùng Iièu đơn REVOLADE 50 mg với bữa sảng tiêu chuẩn giảu ohất béo vả giảu năng
lượng bao gồm oác sản phẫm từ sữa Iảm giảm AUCọ…c eltrombopag huyết tương
khoảng 59% (90% CI: 54%, 64%) vả Cmax khoảng 65% (90% CI: 59%, 70%). Tịan khi
đỏ, thức ăn it calci [< 50 mg calci] không ảnh hưởng đáng kể đến nồng độ eltrdmboga_g_
trong huyêt tương, bắt kế hảm lượng chảt béo vả oalo như thế nảo (xem Liều iưỆhg vả
Cáoh dùng, Tương táo).
Ca'c nhóm đối tưọng bệnh nhân đặc biệt
Suv thân
Dược động học của eltrombopag đã được nghiên cứu sau khi dùng REVOLADE cho
bệnh nhân người lớn bị suy thận. Sau khi dùng Iièu đơn 50 mg, AUC… của
eltrombopag giảm 32% (90% CI: -63%, +26%) ở bệnh nhản suy thận nhẹ, giảm 36%
(90% CI: -66%. +19%) ở bệnh nhân suy thận trung binh, vả giảm 60% (90% CI: -18%, -
80%) ở bệnh nhân suy thận nặng so với người tinh nguyện khỏe mạnh. Có xu hướng
giảm nồng độ eltrombopag trong huyết tương ở bệnh nhản suy thận, nhưng có sự trùng
lắp vả biến thiên đáng kể về nồng độ giữa bệnh nhân suy thận và người tinh nguyện
khỏe mạnh. Nên sử dụng REVOLADE thận trọng vả giám sảt ohặt chẽ ở bệnh nhân suy
thân.
Su ản
Dược động học của eltrombopag đã được nghiên cứu sau khi dùng REVOLADE cho
đối tượng người lớn bị xơ gan (suy gan), Sau khi dùng liều đợn 50 mg, AUCo.Ủ của
eltrombopag tăng khoảng 41% (90% CI: -13%. +128%) ở những đối tượng suy gan
nhẹ, 93% (90% CI: 19%, 213%) ở những đối tượng suy gan trung bình, vả 80% (90%
CI: 11%, 192%) ở những đối tượng suy gan nặng so với người tinh nguyện khỏe mạnh.
12
vJ,-
CONFIDENTIAL
Có sự trùng lắp vả biến thiên đảng kể về nồng độ giữa cảc đối tượng suy gan vả người
tinh nguyện khỏe mạnh.
Ảnh hưởng cùa suy gan trện dược động học của eltrombopag sau khi dùng lặp lại đã
được đảnh giả qua phân tích dược động hoc quần thể ở 28 người lớn khỏe mạnh và 79
bệnh nhân mắc bệnh gan mạn tính. Dựa trên những ước tính từ phân tich dược động
học quần thế, bệnh nhân xơ gan (suy gan) có giá trị AUC…) eltrombopag huyết tương
cao hơn so với người tình nguyện khỏe mạnh. và AUC 200.000101 được xem là bệnh nhân Có đáp ứng, những
bệnh nhân ngừng điều trị vì bảt kì lý do nảo khảo được xem lá không đáp ứng bắt kể số
lượng tiểu cầu thế nảo. Tổng số 114 đối tượng bị ITP mạn tính được điêu trị trưởc đó
đã được chia ngắn nhiên 2:1 vảo nghiên cứu, với 76 đổi tượng ngầu nhiên dùng
REVOLADE và 38 đối tượng ngẫu nhiên dùng giả dược.
59% đối tượng dùng REVOLADE có đáp ứng, so với 16% đối tượng dùng giả dược.
Khả năng đa'p ứng ở các đối tượng điều trị bằng REVOLADE lớn hơn 9 lần so với giả
dược (tỉ số chênh (Odds Ratio): 9,6 [95 % CI: 3.31; 27,86] p<0,001). Lúđ bắt đầu
nghiên cứu, 61% đối tượng trong nhóm REVOLADE vả 66% đối tượng trong rJJIhjậịĩlg1ả
dược đã báo cảo oó chảy mảu (Cắp độ 1-4). Ở ngảy 43, 39% đối tượng trong nhỏm
REVOLADE có chảy mảu so với 60% đối tượng trong nhóm giả dược. Phân tich qua
giai đoạn điều trị sử dụng mô hình đo lường lặp lại đối với dữ liệu nhị phân xảo nhận
rằng tỉ lệ đối tượng dùng REVOLADE có chảy mảu (Cắp độ 1-4) ở bảt ki thời điểm nảo
trong đợt điều trị (Ngảy 8 đến Ngảy 43) thảp hơn so với các đối tượng ở nhóm giả dược
(OR=O,49; 95% Cl=[O,2ô; 0,89], p = 0,021). Hai đối tượng nhóm giả dược vả một đối
tượng nhóm REVOLADE có it nhắt 1 thủ thuật phải có oầm mảu trong thời gian nghiên
cưu.
Trong cả hai nghiên cứu RAISE vả TRA1007738, đảp ứng với REVOLADE so với giả
dược lá như nhau bất kể sử dụng thuốc điều trị ITP nảo, tinh trạng cắt lách vả số lượng
tiểu cầu ban đầu (s 15.000lụl, > 15.000/p!) khi phản nhóm ngẫu nhiên.
Các nghiên cứu nhãn mở
TRA108057: REPEAT lả nghiên cứu nhăn mở, liều lặp lại đảnh giá hiệu quả, tính an
toản vả tinh nhất quán trong đáp ứng sau khi dùng liẻu lặp lại, ngắt quảng. liều ngắn
hạn của REVOLADE qua 3 chu kỳ điều trị ở người lớn bị ITP mạn tính đã được điêu trị
trước đó. Một chu kỳ được định nghia lả một đợt điều trị tới 6 tuần, tiếp theo đó là đợt
15
CONFiDENTIAL
không điều trị tới 4 tuần. Tiêu chí chính trong nghiên cứu REPEAT lả tỉ lệ đối tượng đạt
số lượng tiểu cầu 2 50.000101 vả it nhắt gấp 2 iần số lượng tiều cầu ban đầu trong Chu
kỳ 2 hoặc 3, vời điều kiện đạt được đáp ứng nảy trong Chu kỳ 1.
REVOLADE 50 mg
(N²66)
Có đảnh giá trong Chu kỳ 1, n 65
Số bệnh nhân đảp ứng trong Chu kỳ 1, n (%) 52 (80)
Có đảnh giả trong Chu kỳ 2 hoặc 3, n 52
Số bệnh nhân đảp ứng trong Chu kỳ 1 và trong Chu 45 (87)
kỳ 2 hoặc 3, n (%)
Tỉ lệ 0,87
95 % CI đối với Tỉ lệ (Phương pháp chinh xác) (0,74; 0,94)
Trong số 52 đồi tượng đảp ứng trong Chu kỳ 1, 33 (63%) đạt số lượng tiểu cầu 2
50.000 ui vả it nhắt gấp 2 lần số lượng tiễu cầu ban đầu vảo Ngảy 8 ở Chu kỳ 1; vảo
Ngảy 15, 37 (70%) trong số 47 đôi tượng có đảnh giả đạt được mức đáp ứng nảy.
Sự giảm về tinh trạng chảy máu bảt ký cấp độ nảo (Cầp độ 1 — 4 theo WHO) vả chảy
mảu đáng kể trèn lâm sảng (Cẩp độ 2- 4 theo WHO) trong các giai đoạn điều tị'i được
thế hiện trong mỗi chu kỳ. Ở lần thăm khám ban đầu của Chu kỳ 1,50% đối tượng đã
bảo oác có chảy máu vả 19% đối tượng đã báo cảo có chảy mảu đảng kể trện iấm
sảng. Ở lần thảm khảm vảo Ngảy 43 của Chu kỳ 1, tỉ lệ đối tượng chảy máu giảm; 12%
đối tượng đã bảo cảo chảy máu vé 0% đối tượng đã bảo cảo chảy mảu đáng kể trẻn
lâm sảng. Các kết quả lả tương tư trong cảc chu kỳ điêu trị tiếp theo.
Tảm đối tượng đã qua được thảnh công 10 thủ thuật cần có cầm mảu mả không cần
điều trị bổ sung để tăng số lượng tiếu oâu vả không có chảy mảu ngoải dự kiến nảo xảy
ra.
TRAtOS325: EXTEND lả một nghiên cứu mở rộng nhăn mở để đảnh giá tính an toản vả
hiệu quả của REVOLADE trên những đối tượng bị ITP mạn tinh mà đã được tuyển
chon vảo thử nghiệm REVOLADE trước đó. Trong nghiên cứu nảy, cảc đối tượng được
phép thay đỗi lièu dùng cùa thuốc nghiên oứu củng như giảm hoặc loại bỏ oảo thuốc
điều trị ITP dùng đòng thời.
REVOLADE đă được sử dụng cho 207 bệnh nhân; 104 bệnh nhân hoản tắt 3 tháng
điều trị, 74 bệnh nhân hoản tất 6 thảng điều trị vả 27 bệnh nhản hoản tất 1 năm điều tri.
Trung vị số lượng tiếu oầu ban đầu lả 18.00001! trước khi dùng REVOLADE. Trung vị số
Iượng tiếu oầu tại 3, 6 vả 9 thảng trong nghiên cứu tương ứng iần iượt lả 8600040,
16
Ir
CONFIDENTIAL
67.0001111 vả 92.500/ụi. Trung vị liều REVOLADE hảng ngảy sau 6 thảng điều trị lả 50
mg (n=74).
Khi bắt đầu nghiên cữu, 59% đối tượng có bắt kỳ tình trạng chảy máu nảo (Cắp độ chảy
mảu 1-4 theo WHO) và 18% có chảy máu đảng kế trên lâm sảng. Tỉ lệ đối tượng có bắt
kỳ tinh trạng chảy mảu nảo vả chảy mảu đảng kế trện lảm sảng giảm so với ban đầu
khoảng 50% trong phần lớn oảo đảnh giá tới 1 năm.
70% đối tượng đã giảm thuốc điều trị ban đầu đã ngừng vĩnh viễn hoặc có sự giảm
đáng kể thuốc điều trị ITP ban đầu vả không cần bất kỳ điêu trị cắp cứu nảo sau đó.
65% đối tượng nảy duy trì được sự ngừng điều trị hoặc giảm điêu trị trong ít nhất 24
tuần. 61% đối tượng hoản toản ngừng dùng it nhắt một thuốc điều trị ITP ban đầu, vả
55% đối tượng ngừng vĩnh viễn tắt cả các thuốc điều trị ITP ban đầu, mà không phải
điêu trị cần thiết khảo sau đó.
24 đối tượng đã trải qua ỉt nhắt một thủ thuật oần oỏ cầm mảu trong suốt nghiên cữu.
Không có đối tượng nảo có biến chứng chảy máu ngoải dự kiến Iiẻn quan đến thủ thuật
trong thời gian nghiên cứu.
Dữ liệu an toản tiền Iám sảng
Eltrombopag không gây ung thư trên chuột nhắt ở liều lên tới 75 mglkg/ngảy hoặc
chuột cống ở liều iên tới 40 mg/kgỉngảy (phơi nhiễm tương ứng iẻn tới 4 vả 5 lần phơi
nhiễm trên lãm sảng ở người dựa trên AUC). Eltrombopag không gây đột biện` hoặc
phá vỡ nhiễm sắc thể trong thử nghiệm phân tích đột biến vi khuẩn hoặc trong' hai thị
nghiệm phân tích in vivo ở chuột cống (micronucleus và tổng hợp DNA khổng Ĩheo
chương trình, gấp 10 lằn phơi nhiễm trện iâm sảng ở người dựa trèn Cmax). Trong thử
nghiệm phân tich ung thư bạch huyêt in vitro trên chuột, eltrombopag gần dương tinh
(tần suất đột biến tăng < 3 iần). Những phát hiện in vitro và in vivo nảy gợi ý rằng
REVOLADE không gây nguy cơ độc tinh gen trên con người.
Eitrombopag không gây quải thai ở chuột cống hay thỏ. Eltrombopag không ảnh hướng
đến khả nảng sinh sản của con cải, sự phảt triến phội thời kì sớm hoặc sự phát triẻn
oủa phôi thai ở ohuột cống ở iiều lên tới 20 mglkg/ngảy (2 lần phơi nhiễm trên iâm sảng
ở người dựa trên AUC). Ngoải ra củng không có tảo động lên sự phát triễn phôi thai ở
thỏ ở liều iên tới 150 mglkgỉngảy, liều cao nhất được thử (0,5 lần phơi nhiễm lâm sảng
ở người dựa trên AUC). Tuy nhiện, ở liều độc cho chuột cống mẹ 60 mglkg/ngảy (6 lần
phơi nhiễm lâm sảng ở người dựa trẻn AUC), điều trị bằng eitrombopag có liên quan
đên tinh trang chét phỏi (tảng mất phôi trước hoặc sau khi Iảm tố) trong nghiên cứu về
khả nảng sinh sản oủa chuột cải, tỉ lệ thẳp bị ohứng xương sườn cổ (một biến dạng thai
không phải quải thai) trong nghiên cứu về sự phải triẻn của phỏi thai và giảm trọng
lượng thai trong cả hai nghiên cữu. Eltrombopag khỏng ảnh hướng đên khả năng sinh
17
CONFIDENTIAL
sản oùa chuột cồng đực ở lièu lện tới 40 mg/kglngảy, liêu thử cao nhắt (3 lần phơi
nhiễm iâm sảng ở người dựa trện AUC).
Trong nghiên cứu in vitro, eltrombopag có gây nhiễm độc ánh sảng và phá vỡ nhiễm
sắc thể do ảnh sáng. Tuy nhiên, trện in vitro, tác dụng gây phá vỡ nhiễm sẳc thế do ảnh
sáng chỉ quan sát thầy ở nồng độ thuốc gây độc tế bảo (2 15 pglml) khi tiếp xúc với ánh
sáng từ ngoại cường độ mạnh (30 MED, liều tối thiểu gây ban đỏ). Khỏng có bằng
chứng về khả năng gây nhiễm độc da do ánh sảng trong nghiên cứu in vivo ở chuột
nhắt khi tiếp xúc Vởi liêu lên tới 10 lần phơi nhiễm trèn lâm sảng ở người dựa trên AUC
hoặc nhiễm độc mắt do ánh sảng ở chuột nhắt hoặc chuột cồng khi tiêp xúc với liều
tương ứng lần lượt lẻn tới 11 vả 6,0 lần phơi nhiễm trên Iảm sảng ở người dựa trên
AUC. Hơn nữa, nghiên cứu dược lý lâm sảng ở 36 đối tượng không cho thắy bằng
chững tảng nhay cảm ánh sáng sau khi dùng REVOLADE 75 mg một lần mỗi ngảy
trong 6 ngảy. Điều nảy được đo bởi chỉ số nhiễm độc ảnh sảng chậm.
Đục thủy tinh thể |iên quan đến điều trị đã được phát hiện ở Ioái gặm nhẩm vả oó phụ
thuộc lièu và thời gian. Ở liều 2 6 lần phơi nhiễm lâm sảng ở người dựa trên AUC, quan
sát thắy đục thủy tinh thể ở ohuột nhắt sau 6 tuần vả chuột cống sau 28 tuần dùng
thuốc. Ở liều z 4 lằn phơi nhiễm lâm sảng ở người dựa trên AUC, quan sảt thấy đục
thùy tinh thể ở chuột nhắt sau 13 tuần vả ở chuột cống sau 39 tuần dùng thuốc. Chưa
quan sảt thắy đục thủy tinh thể ở chó sau 52 tuần dùng thuốc ở liều gấp 2 lần phơi
nhiễm lâm sảng ở người dựa trên AUC. Ý nghĩa lâm sảng của những phảt hiện nảy vẫn
chưa được biết (xem Cảnh báo vá Thận trong).
Đã quan sát thấy độc tinh trẻn ống thận trong cảc nghiện cữu kéo dải tới 14 ngảy trẻn
chuột nhắt vả chuột cống ở các mức phơi nhiễm nói chung liên quan đền tinh trạng
thương tật vả tử vong. Độc tính trèn ống thận cũng được quan sảt thắy trong nghiện-
cứu về khả năng gây ung thư theo đường uống kéo dải 2 năm trên chuột nhắt'ỡbảc
lièu 25, 75 vả 150 mglkg/ngảy. Cảo ta'c dụng nảy it nghiêm trọng hơn ở liều thấp hơn vả
đặc trưng bởi một loạt thay đỗi có thể hồi phục. Phơi nhiễm ở liều thấp nhất lả 1,2 lần
phơi nhiễm lâm sảng ở người dựa trẻn AUC. Cảo ảnh hướng trện thận không quan sát
thấy ở chuột cống sau 28 tuần hay ở chó sau 52 tuần ở mức phơi nhiễm tương ứng lả
4 vả 2 lần phơi nhiễm lâm sảng ở người dựa trên AUC. Ý nghĩa lâm sảng của những
phảt hiện nảy vẫn chưa được biềt.
HẠN DÙNG
24 thảng kể từ ngảy sản xuất.
BẨO QUÀN
Bảo quản dưới 30°C.
18
CONFIDENTIAL
ĐỀ XA TẦM TAY TRẺ EM
ĐỌC KỸ HƯỞNG DĂN sữ DỤNG TRƯỞC KHI DÙNG
NỂU CẦN THÊM THÔNG TIN x… HỎI Ý KIỂN BÁC SỸ
SẢN XUẤT BỜI
Glaxo Operations UK Limited,
Priory Street, Ware, .
Hertfordshire, SG12 ODJ, GlaxoSmithKline
United Kingdom
ĐÓNG GÓI VÀ qur xướuc BỞI
Glaxo Wellcome 9.A.,
Avenida ExtremaiỢin/rgfa/
09400 Aranda de Duero,
Burgos, Spain
O /
ONis
REVOLADE lả nhản hiệu thương mại đã đảng kỷ của GlaxoSmithKline group 021
companies. ~'
/
Dựa trên IPI 04; ngảy ban hảnh: 04 tháng 7 năm 2012
REVTAB 0313-04I040712
TUQ. cục TRUỘNG
P.TRUỜNG PHONG
.,fiỆzuyẫn —'ll`uợ JỔìạqy
19
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng