













m poimwm
J uassueí
` sieiqez PGỊBOO~UJIỊỊ 1.
(azeuuoons apudogeomơ 6… zygz ot tuelelụnbe) apuơqeomd 6… ; suựewoo tqqex pemoo-mn; ươea
JOỊOSâẸ dS
mmz .Joìosag
“sz
11
2
zn'sxaiqu, |_
… swu Mz …m`ĩs >IGS
Mu … Bum m= »… nu h… 01 usu nu hâm
iqenquoumidxa 1… %" nuch unneu mu xsows
un luu ' … lltiio~ler -ỵem
Bunno u…e uun ano u…a xnwvnwm ĩ)INNCI
; 'Wisn 'uww
ws ems move uuwtr :› UA "V'đ’t ơnnNassuvr … m…vs
ua ;… AV]. un vx u
Đde mu aomu. sunu m uyu omnu pi n
mo oan uy: :omu
uq uw» 'o,pt un o» mun mu ơ ỹD Huwg :uunb uọl
6… «M lunn t.… Up đun…
Ja …u uu '!H’l uu Hum Ju « wb .… Bu…đ mm uan 'wln wa
wuideu uọu …; 1 … don
dqumd Bui ; ư» BuMp Dum) !… zpợz cpumns cpuđmnrud
6… : ưo1osau...
epụdoieomd
Sielqei peiBOO-UJIỊJ
% ,Joìosag…
[810 em ~eoipem uọgoduoemd obq mueA ~soụgu sq ep aouetne pp em aseôuezuaw 'pepeum q ep JOÔG!OJd
'o,oe e ›0uedns eme.ơaơwes e .re›xmuoa oN ~oiuntpe onedso›d p asew ’osn ap seoomrmso.» ered
519109) 810 'ĐUDiDGU N00 uoudmffld 'UGJDIUO 10 *43981 101n0 dan
mmspom mon me;on o,,ge enoqe aJOIS tou og ~uasui eõaped pesqoue ees 'esn Jo; suonaụg ›og
.;.z
uoqu
uww'um
nim›mM
WWW
\
'“ResoLo r“° m:
comprimidos recubiertos con pelicula
Prucaloprida
Cada comprimido recubneno con pelicula contlene 2 mg de prucalopride (equwalenle a 2.642 mg de succinato
de prucalopride)
7 comprimidos recubnertos con pelucula
Janssen '
Zioz ôeuo-uessuer o
Eiiew^ieu °euun 'aiauOiw 's oõme omvo 'uessuer ':› aA "vd's Beno-uessuer
:JOd oppnqựzsqp K opesenue ’opeopqeg
:Aq paseqa pue paõexoed 'paxmoemuew
YH
nò :)le
EIL A 08
’ICEIHV1
lv
nểP uẵ'ĩ
v
ẸHd
oOnơ À'I NV
r
v
LẳĂHG
Jl'zỡỉ`l'Ịỹm'l'ỹzf’
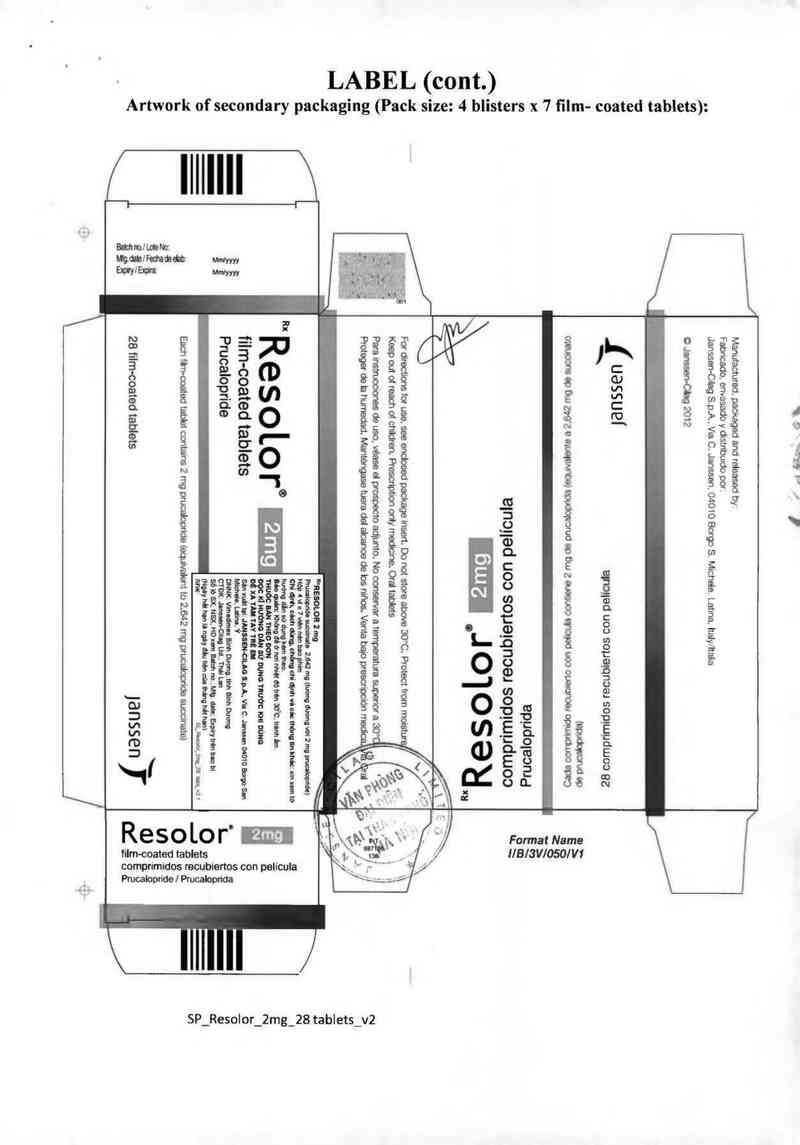
(slalqm pamoa -uqụ L x .msuq [ :azgs ›pnă) ãugãmpud Ẩ.mpuoaas go ›ụomav
09/11 07
LABEL (cont.)
Artwork of secondary packaging (Pack size: 4 blisters x 7 film- coated tablets)
2_ 111111
ỉmễỡQEẵ. umoẫoẵ mẳ ìommẵ ơ<
nươzoẵo. oẫmmmno < Q…ỉơcõo o9.
ụẵw…ẵòỡn mb.>. S… 0. ụẫoa. oỗỗ moõo m. ỉ…nẵỡ. E…Ểm. .…mĩâmỉ
O.ỂỔỄ uoỗ
tN cm……cm…
mtõ:mc coo mot9oễE mẵỄẵEoo mm
'
…ẵỗ oc
o…ễẫ 8 8 mỗd …… o.ẵễ… ễễuên 8 9: … oco:c8 ẹ39.8 ỗu oẳ oQỄỄồo ễ
muẵo.moẽơ
m.:o:ẵ coo motoE:o9 moEEỄEoo
Wn ã ... o..Ommmễ
C {| ....i. . ../
Format Name
IIB|3VIOSOI V1
.…o4 nỗQẵ Ể cỗ. mom mao.88 ễ …:8? 00 ao… …õỡ mơQỗ uoổ. võỡQ ỉẫ 3oẾE… n0 .. . v ., ỷ
x$o 8… o… 38: g gỡỄ. 38828 oẳ ẵưẫ. oì Ễẫ xủ0 … .… . . .…. _, …2
Vấn .:…ỄoQoẫ no cwo. ốmom m. oõ…uooổ 8…ẵo. zo ooaẳ .… Ổaooẵca Ễ m wo…ỡ . Ý .t ..\ 1 m\… . .…
Po.8ũ % .… :ẵỄ. zẵỄ …ễmẵẫ % 6… ẳ8. dỉdb65 tuổi)
Liều khởi đầu với viên ] mg một lần mỗi ngảy (xem Tính chất dược đọng học); nểu cần thiểt
liễu có thể tăng lên 2 mg một lần mỗi ngảy.
Trẻ em và thiếu niên
RESOLOR® được khuyến cảo không sử dụng cho trẻ em và thiếu niên dưới 18 tuồi (xem
mục Bệnh nhản nhi và Nghiên cứu lâm sâng).
Bệnh nhân suy thận
Liều dùng cho bệnh nhân suy thận nặng (GFR<3O mL/phútfl, 73m2 ) lặ l mg một lần mỗi
ngảy (xem Chống chỉ định và Đặc tính dược động học). Không cần điểu chình liều ở bệnh
nhân suy thận nhẹ vả trung bình.
Bệnh nhân suy gan
Liều dùng cho bệnh nhân suy gan nặng (Child- Pugh nhóm C): khởi đầu 1 mg một lần mỗi
ngảy, có thể tăng lên 2 mg nêu cân để tăng hiệu quả điều trị và nểu như liều 1 m được dung
nạp tốt (xem Cánh bảo và thận irọng vả Đặc tỉnh dược động học). Không cằn đieu chinh liều
ở bệnh nhân suy gan nhẹ và trung bình.
Trong các thử nghiệm lâm sảng, liều gấp hai lần liều dùng hảng ngảy (lên tới 4 mg) không
lảm tăng hiệu quả điều trị.
PI_Resolor_CCDS 06N0v2013_v2 1l9
',
\
'.
Nếu uống, RESOLOR® không đạt hiệu quả sau 4 tuần điều trị, bệnh nhân cần được tái khảm
và cân nhắc lại ích lợi của việc tiếp tục điều trị.
Nếu điều trị kéo dải hơn 3 tháng cần phải đánh giá đều đặn lợi ích của điều trị.
Cảch sử dung
RESOLOR® viên bao phim dùng bằng đường uống và có thể dùng trước hay sau bữa ăn.
Chống chỉ định
- Nhạy cảm với hoạt chất hay bất kỳ tả dược nảo.
- Bệnh nhân suy thận đang chạy thận nhân tạo. Iẵẳ lẻ
11² g cua thanh ruọt, tảc hòi trang,
- Thủng ruột hay tắc ruột do cối loạn thực thể hay ch'
tình trạng viêm đưộng ruột trâm trọng như bệnh Crohn, viêm loét đại trảng vả phình đại
trảng/trực trảng nhiêm độc.
Cảnh báo và thận trọng
Bải tiết ở thận lả con đường chính thải trừ prucaloprid (xem Đặc tính dược động học). Liều
dùng 1 mg được khuyên sử dụng ở bệnh nhân suy thận nặng (xem Liều dùng vả cách dùng).
Đối với bệnh nhân suy gan nặng (Child- -Pugh nhóm C), liều khuyến cảo ban đầu là 1 mg một
lần mỗi ngảy, có thể tăng tới 2 mg neu cân để tăng cường hiệu quả và nếu dung nạp tốt ở liều
l mg (xem Liều dùng vả cách dùng).
Bệnh nhân với bệnh lý kèm theo trầm trọng và lâm sảng không ổn định (như bệnh gan, bệnh
tim mạch hay bệnh phối, bệnh thần kinh hay rối loạn tâm thần, ung thư hay bệnh suy giảm
miễn dịch măc phải và các rối loạn nội tiết khác) chưa được nghiên cứu. Cần lưu ý khi thực
hiện kê đơn RESOLOR® cho các bệnh nhân trong những tình trạng nảy. Cẩn lưu ý đặc biệt
khi sử dụng RESOLOR® ở cảc bệnh nhân có tiền sử bệnh loạn nhịp tim hay bệnh thiểu mảu
cơ tim.
Trong trường hợp tiêu chảy nặng, hiệu quả cùa thuốc ngừa thai đường uống có thế bị giảm, vì
vậy nên sử dụng thêm phương phảp ngừa thai hỗ trợ để tăng hiệu quả ngừa thai (xem thông
tin kê toa của thuốc tránh thai đường uống).
Nam giới: Tính an toản và hiệu quả của RESOLOR® khi sử dụng ở nam giới chưa được cùng
cố trong cảc nghiên cứu lâm sảng có đối chứng, do đó, RESOLOR“D chưa được khuyến cáo
sử dụng cho nam giới cho tới khi có thêm dữ liệu nghiên cứu.
Viên nén có chứa lactose monohydrat. Những bệnh nhân có bệnh lý di truyền hiếm gặp
không dung nạp galactose, thiếu hụt Lapp lactase hOặc kém hấp thu giucose - galactose
không được dùng thuốc nảy.
Tương tảc thuốc
Prucaloprid ít có khả năng tương tảc thuốc về dược động học. RESOLOR® được bải tiết ở
đạng không đổi qua đường niệu (khoảng 60% cùa liều dùng) và trên in vitro sự chuyến hóa
rất chậm. Mặc dù có 8 chất chuyến hóa khảc nhau được tìm thấy, hầu hết là dẫn xuất của acid
carboxylic (lả sán phẩm của quá trình oxy hóa-khử methyl nhánh bên ortho) hiện diện thấp
hơn 4% liều dùng.
Pucaloprid không ức chế hoạt động đặc hiệu của CYP4SO trong cảc nghiên cứu in vitro trong
cảc tiếu thế gan người ở cảc nông độ điều trị.
Pl_Resolor_CCDS OGNOVZO1B_VZ 219
Mặc đủ prucaloprid có thể iả chất nền yếu đối với P-glycoprotein (P—gp), song nó không phải
là chât ức chế P-gp ở cảc nông độ điêu trị trên lâm sảng.
Ẩnh hưởng của prucaloprid trên dược động học của các thuốc khác
Prucaloprid lảm tăng 40% Cmax và 28% diện tích dưới đường cong sau 24 giờ (AUC…) của
erythromycin khi dùng đổng thời.
Prucaloprid không có ảnh hưởng trên lâm sảng về dược động học của warfarin, dìgoxin, cồn,
paroxetin hay các thuốc tránh thai đường uông.
Ảnh hưởng của các thuốc lên dược động bọc cũa prucaloprid LẨ^ý
Ketoconazol (200 mg ngảy hai lần) - một chất ức chế mạnh CYP3A ` -gp - lảm tãng nồng
độ toản thân của prucaloprid khoảng 40%. Ảnh hưởng nảy là quả nhỏ trên lâm sảng. Tương
tảc giống như vậy ở ketoconazol có thể xảy ra với cảc chẳt ức chế mạnh P—gp khảo như
verapamil, cyclosporin A và quinidin.
Liều điếu trị của probeneciđ, cimetidin, erythromycin vả paroxetin không ảnh hưởng đển
dược động học cùa prucaloprid.
RESOLOR® nên được 1… ý khi dùng trên cảc bệnh nhân đang điều trị đồng thời với cảc
thuốc được biết lả gây kéo dải khoảng QTc.
Do cơ chế tác động, việc sử dụng cảc chất giống atropin có thể gây giảm tảc động qua trung
gian thụ thể 5 HT4 của prucaloprid.
Ảnh hưởng của thức ăn
Tương tảc với thức ăn không được quan sảt thẩy.
Phụ nữ có thai, cho con bú và khả năng sinh sản
Trong thời gian mang thai
Kinh nghiệm sử dụng RESOLOR® trên phụ nữ đang mang thai gỉới hạn. Cảc trường hợp sấy
thai tự nhiên đã được ghi nhận trong suốt các nghiên cứu lâm sảng, mặc dù có sự hiện diện
cảc yếu tố nguy cơ khác, nhưng sự liên quan của RẸSOLOR® không dược biết rõ. Nghiên
cứu trên động vật không thấy hậu quả gây hại trực tiểp hay gián tiểp đối với thai kỳ, sự phảt
triển phôi/thai, quá trình sinh đẻ hay sự phát triến sau khi sinh (xem Thông tin an toản tiền
lâm sảng). RESOLOR® không được khuyến cảo trong suốt thai kỳ. Phụ nữ ở tuối sinh đẻ nên
sử dụng biện phảp ngừa thai hiệu quả trong suốt quá trình điểu trị với RESOLORỂ
Trong thời kỳ cho con bú
Prucaloprid được bải tiết qua sữa mẹ. Tuy vậy với liều điều trị cùa RESOLOR“D được dự
đoản không ảnh hưởng đến trẻ sơ sinh/ trẻ em bú sữa mẹ. Do thiểu các dữ liệu trên người nên
không khuyến cảo sử dụng RESOLOR® trong thời gian cho con bú.
Khả năng sinh sản
Nghiên cứu trên động vật chỉ ra rằng thuốc không có ảnh hưởng đến khả năng sinh sản của
con đực hay con cái.
Pl_Resoior_CCDS OôNov2013_v2 3/9
Tác động trên khả năng lái xe và vận hânh máy mỏc
Không có nghiên cứu về tác động cùa prucaloprid trên khả năng lải xe và vận hảnh máy móc.
RESOLOR® có thể gây chóng mặt và mệt, đặc biệt là ngảy sử dụng đầu tiên, do đó có thể ảnh
hướng đến khả nãng lái xe và vận hảnh máy mỏc (xem Tác dụng không mong muốn).
Tác dụng không mong muốn I’YXÍl/f
Trong một chương trình phảt triến lâm sảng ban đằu gồm 14 nghẾnw' mù đôi, có đối
chứng vởi giả dược, RESOLORLịJ đã được sử dụng bằng đường uống“Ểen oảng 2700 bệnh
nhân táo bón mạn tính. Khoảng 1000 bệnh nhân uông RESOLOR® vởi liều 2 mg mỗi ngảy,
trong khi đó có khoảng 1300 bệnh nhân uống liều 4 mg mỗi ngảy. Tống số bệnh nhân dùng
thuốc trong kế hoạch phát triến lâm sảng vượt quá 2600 bệnh nhân-nãm (patient-yearsỵ Cảo
báo cáo tảo dụng ngoại ý được ghi nhận thường xuyên nhất liên quan với điều trị
RESOLOR® lả đau đẩu và các triệu chứng tiêu hóa (đau bụng, buồn nôn hay tiêu chảy) xảy
ra khoảng 20% bệnh nhân. Cảc tác dụng ngoại ỷ xảy ra chủ yếu ở thời điểm bắt đầu điều trị
và thường mắt sau vâí ngảy điều trị. Đôi khi có các tảc dụng ngoại ý khác. Hầu hết cảc tác
dụng ngoại ỷ thường nhẹ và trung bình.
Cảc tác dụng ngoại ý được báo cảo trong cảc nghiên cửu lâm sảng có đối chứng ở mủc liều
khuyến cảo 2 mg vởi cảc tằn suất tương ửng như sau: rất thường xuyên (_ 11’10), thường
xuyên (> 1/100 đến < 1/10), không thường xuyên (_ 1I1.000 đến < 11100). Trong mỗi nhóm
tần xuất, cảc tác dụng ngoại ỷ hiện diện theo mửc độ nặng giảm dần. Tần suât được tính dựa
trên các dữ liệu nghiên cứu lâm sảng có đối chứng với giả dược.
Rối loạn chuyển hỏa và dinh dưỡng
Không thường xuyên: Chém ãn.
Rối loạn hệ thống thẫn kinh
Rất thường xuyên: Đau đẳu.
Thường xuyên: Chóng mặt.
Không thường xuyên: Run.
Rối loạn tim mạch
Không thường xuyên: Tim đập nhanh.
Rối loạn tiêu hóa
Rất thường xuyên: Buồn nôn, tiêu chảy, đau bụng.
Thường xuyên: Nôn, khó tiêu, chảy máu trực trảng, đầy hơi, sôi ruột.
Rối loạn ở thận và tiết niệu
Thường xuyên: Tiểu rắt.
Rối loạn tổng quát
Thường xuyên: Mệt mỏi.
Không thường xuyên: Sốt, khó chịu.
Sau ngảy điểu trị đầu tiên, phản ứng bất lợi phổ biến nhất đã được bảo cảo với tần suất giống
nhau (tỷ lệ 8)mắc phải khảc nhau dưới 1% giữa prucaloprid và giả dược) trong khi điều trị
RESOLORỦ so vởi điều trị vởì giả dược, với ngoại trừ tác dụng buồn nôn vả tỉêu chảy lả vẫn
xảy ra thương xuyên hơn trong điều trị bằng RESOLORỀ nhưng it được bảo cáo (sự khảo
nhau vê tần xuất giữa prucaloprìd và giả dược lả l vả 3%).
PI_Resoior_CCDS 06N0v2013_v2 419
\! __ ..,j_
il
J <…
Tim đập nhanh được bảo cảo khoảng 0,7% ở nhóm bệnh nhân dùng giả dược, 1% ở nhóm
bệnh nhân dùng liều 1 mg RESOLOR®, 0,7% ở nhóm bệnh nhân dùng liều 2 mg RESOLOR®
và 1 ,`9% 0 nhóm bệnh nhân dùng liều 4 mg RESOLOR® Phần lởn các bệnh nhân vẫn tiếp tục
sử dụng RẸSOLORQ Như vởi bất cứ triệu chứng mới nảo, bệnh nhân nên thảo luận với bảc
sĩ của họ về sự mới xưất hiện triệu chứng tim đập nhanh.
Thông báo cho bảc sỹ những tảc dụng không mong muổn gặp phải khi sử dụng thuốc.
Quá iiều _JẸỚ
Trong nghiên cứu ở những người khỏe mạnh, việc điều trị với RESOLOR:jtj vân dung nạp tốt
khi sử dụng đến mức liều 20 mg/ngảy (gấp 10 lần liều điều trị được khuyến cáo). Quả liều có
thể dẫn đến cảc triệu chứng do tảc dụng quá mức được lực học đã biết cùa thước điều trị và
bao gồm đau đầu, buồn nôn vả tìêu chảy. Không có đíễu trị đặc hiệu trong trường hợp quá
liều của RESOLORỂ Khi xảy ra quá liều sử dụng, bệnh nhân sẽ được điều trị triệu chứng vả
các bỉện phảp hỗ trợ nếu cân Mắt nước trầm trọng do tiêu chảy hay nôn có thể cân điều
chỉnh rối loạn nước và điện giải.
TỈNH CHẨT DƯỢC LÝ HỌC
Đặc tính dược lực học
Nhóm thưốc điều trị: Nhóm thuốc điếu trị tảo bón, mã ATC: AOóAXOS.
Cơ chế tác động
Prucaloprid là một dihydrobcnzofurancarboxarnid với cảc hoạt động kích thích tăng vận động
như động ruột.
Prucaloprid là chất đồng vặn chọn lọc, ái lực cao trên thụ thể serotonin (5 HT4), mà giúp giải
thích cho cảc tác động tăng như động ruột của nó. Trong nghiên cứu in vitro, ái lực của thưốc
vởi các thụ thể khác chỉ được phải hiện ở các nồng độ mà gây vượt quá ít nhất 150 lần ái lực
với thụ thể 5 HT4. Prucaloprid thực nghiệm trên chuột vởi lỉếu trên 5 mg/kg (trên 30- 70 lần
liền lâm sảng) dẫn tới tình trạng tảng prolactin máu do nguyên nhân tảo động đối vận trên thụ
thê D2.
Trên chó, prucaloprid tác động trên nhu động đại trảng qua kich thích thụ thể serotonin
5 HT4: kích thích vận động đại trảng ở đầu gần, tảng cường vận động dạ dảy tá trảng vả thủc
đẩy nhanh sự lảm trống dạ dảy. Hơn nữa, prucaloprid còn gây ra các co thắt đẳy tởi thật
mạnh. Những hiện tượng nảy tương đương với sự di chuyến khối của đại trảng trên người, và
cung câp lực đẩy chính cho sự thoát phân. Trên chó, cảc tảc động quan sảt được trên đường
tiêu hóa dễ dảng bị ảnh hướng bởi sự phong tòa của cảc chất đối vận chọn lọc trên thụ thể
5 HT4 đă mỉnh họa được rằng hoạt động chọn lọc trên cảc thụ thể 5 HT4 đã gây ra cảc tác
động quan sảt được.
Nghiên cứu lám sảng
Hiệu quả của RESOLOR® đã được thiết lập trên 3 nghiên cứu đa trung tâm, ngẫu nhiên, mù
đôi, có đối chưng vởi gỉả dược trong 12 tuần trên cảc bệnh nhân bị táo bón mạn tính (n=1279
bệnh nhân dùng RESOLOR®, 1124 nữ, 155 nam). Liều RESOLOR® trong 3 nghiến cứu nảy
bao gồm liếu 2 mg vả 4 mg một lần mỗi ngảy. Tiêu chí nghiên cứu chính về hiệu quả là tỷ lệ
(%) các bệnh nhân đạt được bình thường hóa nhu động ruột nghĩa là trung bình 3 hay nhiếu
hơn số lần đại tiện tự phát hoản toản (SCBM) trong 1 tuần trong suốt thời gian điều trị 12
tuần. Cả hai liều đều cho kết quả vượt trội hơn có ý nghĩa thống kê so với giả dược (p
<0 ,001) về tiêu chí chính trong mỗi ba nghiên cứu, với lợi ích của iiều 4 mg không lớn hơn
liểu 2 mg Tỷ lệ bệnh nhân điều trị với liền 2 mg RESOLỐR® đạt trung bình > 3 SCBM! tuần
PI_Resoior_CCDS OôNov201 3_v2 519
II
’1
là 27,8% (tuần 4) và 23,6% (tuần 12) so với 10,5% (tuần 4) và 1 1,3% (tuần 12) cùa giả dược.
Sự cải thiện có ý nghĩa trên lâm sảng lả 2 1 SCBM/ tuần, đây là tiêu chí nghiên cửu phụ quan
trọng nhất về hiệu quả đã đạt được 48,1% (tuần 4) và 43,1% (tuần 12) ở nhóm bệnh nhân
điều trị với 2 mg RESOLOR® so với 23,4% (tuần 4) và 24,6% (tuần 12) ở nhóm bệnh nhân
dùng giả dược.
Trong tất cả ba nghiên cứu trên, việc điếu trị với RESOLOR® cũng đã đem lại sự cải thiện rõ
rệt chỉ số đánh giá cùa bệnh nhân Về cảc ttiệu chứng táo bòn (PAC SYM- Patient Assessment
of Constipation Symtoms), đây là một tập hợp các tiêu chuẩn đảnh giả triệu chứng đặc hiệu
cho bệnh đã được phê chuẩn, bao gồm các triệu chứng về bụng, phân và trực trảng, được xác
định ở tuần thứ 4 và 12 Tại thời điếm đánh gìá ở tuần thứ 4 và 12, có sự cải thiện rõ rệt `ở
chỉ số chắt lượng sống cũng được ghi nhận, chẳng hạn như mức độ hải lòng với điếu tr `
thói quen đại tiện, những khó chịu về thể chất và tâm lý xã hội và lo lắng và băn khoăn về các
ttiệu chửng táo bón. Cảc nghiên cứu cũng chỉ ra rằng pruca10prid không có hiện tượng dội
ngược hay gây ra lệ thuộc thuốc.
Trong một nghíên cứu khảo sát thắn đảo về khoảng QT có® đối chứng vởi giả dược (N=120)
đã được thực hiện để đảnh giả ảnh hưởng của RESOLOR® trên khoảng QT ở cảc mức liều
điều trị (2 mg) và mức liều trên điều trị (10 mg) Nghiên cứu nảy đã không ghi nhận sự khác
bìệt có ý nghĩa giữa RESOLORỆì và giả dược ở cả 2 mức liều, dựa trên sô đo trung bình của
khoảng QTC (sự thay đối gia tăng lớn nhất cúa khoảng QT trung bình so với ban đầu [có
hiệu chinh đặc hiệu theo từng cá thế] là 3, 83 mili giây với mức liếu 2 mg và 3,03 mili giây
với mức liều 10 mg) và phân tích các dữ liệu bên ngoải khác. Điều nảy cũng được khẳng định
trong 2 nghiên cửu lâm sảng đầu tiên có đối chứng với giả dược trong việc đảnh giá khoảng
QT. Ba nghiên cứu nảy đã xác nhận rằng tỷ lệ tác dụng ngoại ý liên quan đến khoảng QT vả
loạn nhịp thất là thấp vả tương đương vởi giả dược.
Tính hiệu qụả, an toản và dung nạp của prucaloprid trên bệnh nhân nhi (từ 6 tháng đến 18
tnổi) với chẳn đoản xác định bị táo bỏn chức nảng, được đánh giá trong một nghiên cứu đa
trung tâm, mù đôi, ngẫu nhiến, đối chứng với giả dược trong 8 tuần (N=213), tiếp theo đó là
một giai đoạn nghiên cứu nhãn mở kéo dải 16 tuần đối chứng vói chất so sánh (Polyethylene
glycol 4000) để đảnh giá sự an toản và dung nạp cho đến 24 tuần (N=197). Liều khới đầu là
0 04 mg/kg/ngảy được điều chinh liếu giữa 0, 02 và 0, 06 mg/kg/ngảy (tối đa 2 mg/ngảy) cho
trẻ em cân nặng_ < 50 kg được cho dưới dạng prucaloprid dung dịch uống hoặc giả dược dạng
phù họp. Trẻ em cân nặng > 50 kg được điều trị vói 2 mg/ngảy viên nén prucaloprid hoặc giả
dược dạng phù hợp. Tiêu chí nghiên cứu chính về hiệu quả là so sánh tỷ lệ đáp ửng điếu trị
giữa hai nhánh prucaloprid và giả dược trong khoảng thời gian từ tuần 5 đến tuần 8 cùa giai
đoạn điều trị mù đôi. Đáp úng vói điều trị được định nghĩa là có trung bình > 3 số lẩn đại tiện
tự phảt (SBMS) trong một tuần và số lần trung bình đi phân ngoải không tự chủ <1 trong 2
tuần. Nghiên cứu đã không đạt được tiêu chí chính (tỷ lệ đảp ứng prucaloprid là 17% so với
17,8% của giá dược, p=O, 9002). Cảo phân tích về tính an toản cho thấy prucaloprid nhìn
chung được dung nạp tốt. Nói chung, tỷ lệ bệnh nhân có ít nhất một biến cố bất lợi xuất hiện
khi đang điều trị (TEAE) là tương đương giũa nhỏm điều trị với prucaloprid (69,8%) và
nhóm giả dược (60,7%). Các TEAEs phổ biến nhất xảy ra với tần xuất cao hơn sau khi điều
trị với prucaloprid (đau đầu, buồn nôn, nôn, sốt) được biết tới là tảc dụng ngoại ý có lỉên
quan với việc sử dụng prucaloprid ơ người lớn. Cảc loại và tần xuất khảo của TEAEs, các xét
nghiệm bất thường cận lâm sảng, vả cảc thông số an toản khác trong nhóm điều trị với
prucaloprid lả tương đương với giả dược vả polyethylene glycol Nhìn chung, dữ liệu an toản
trên trẻ em là tương tự vởi dữ liệu an toản của người lớn.
Dữ liệu từ những nghiên cứu nhãn mở kéo dải đến 2,6 nãrn đưa ra một số chứng có cho tinh
hiệu quả và an toản lâu dải; tuy nhiên, chưa có dữ liệu về hiệu quả được đối chúng với giả
dược cho thời gian điều trị lâu dải hơn 12 tuần.
Pi_Resoior_CCDS OỂiNOVZOi 3_v2 619
Đặc tính dược động học
Hấp thu
Prucaloprid được hấp thu nhanh; sau liều uống duy nhất 2 mg Cmax đạt được trong 2- 3 giờ.
Sinh khả dụng tuyệt đối đường uống lả >90%. Uống chung trong bữa ăn không ảnh hưởng
đến sinh khả dụng của prucaloprid
Phân bố
Prucaloprid được phân bố rộng rãi và có thể tích phân bố ở trạng thái hằng định (Vdss) lả 567
lít. Sự gắn kết với protein huyết tương của prucaloprid khoảng 30%.
Chuyen hoa GgÝ
Chuyền hóa không phải là con đường chính để thải trừ prucaloprid. Trong phòng thi
thuốc được chuyến hóa qua gan ở người là rất chậm và chỉ có một lượng nhỏ các chất chuyến
hóa được tìm thấy. Trong một nghiên cứu thuốc đường uống của prucaloprid có đánh dấu
phóng xạ ở người, một sô lượng nhỏ 8 chất chuyến hóa được ghi nhận ở nước tiếu và phân.
Chất chuyển hóa chính (R107504, hình thảnh từ phản ứng khử Q-methyl vả oxy hóa nhóm
chức năng alcol tạo thảnh acid carboxylic) chiếm ít hơn 4% của liều dùng. Hoạt chất có hoạt
tính không chuyến hóa chiếm khoảng 85% tổng số hoạt chất đánh dấu phóng xạ trong huyết
tương và chỉ có chất chuyến hóa R107504 chiếm lượng nhỏ trong huyết tương.
T hái trừ
Trên người khỏe mạnh, một lượng lởn hoạt chất có hoạt tính được bảì tiết dưới dạng khôn
thay đôi (khoảng 60% liều điếu trị qua đường tiều vả khoảng 6% qua phân). Sự bải tiêt
prucaloprỉd qua thận liên quan đến cả sự lọc thụ động và bải tiêt chủ động. Hệ số thanh thải
huyết tương cùa prucaloprid trung bình 317 mL/phút. Thời gian bán hùy khoảng 1 ngảy.
Trạng thải hẳng định đạt được trong vòng 3- 4 ngảy. Với liều điều trị 2 mg/ngảy nồng độ
prucaloprid trong huyết tương dao động giữa giá trị đảy và đỉnh tương ứng 2, 5 và 7 ng/mL.
Tỷ lệ tích lũy sau liều dùng hảng ngảy từ 1, 9 đến 2, 3. Dược động học của prucaloprid là tỷ lệ
với liều dùng cả trong vòng và bên ngoải khoảng liếu điếu trị (thử nghiệm liếu lện tới 20 mg).
Prucaloprid mỗi ngảy một lần thế hiện động học độc lập vởi thời gian trong suốt điếu mị kéo
dải
Sử dụng ở đối tượng đặc biệt
Dược động học quần thể
Phân tích dược động học quần thể dựa trên dữ liệu tổng hợp từ các nghiên cứu Pha 1, n và 111
đã cho thấy tổng độ thanh thải biếu kiến của prucaloprid có tương quan với độ thanh thải
creatinin, nhưng không tương quan với tuôi, cân nặng, giới tính hay chủng tộc.
Người lớn tuối
Sau liều 1 mg một lần mỗi ngảy, nồng độ đinh huyết tương và AUC của prucaloprid ở bệnh
nhân lớn tuổi cao hơn 26% -28% so với người trẻ tuôi. Anh hưởng nảy có thế là do chức
năng thận bị suy giảm ở người lớn tuổi.
Suy thận
So sảnh với cảc cả thế có chức nãng thận binh thường, nồng độ huyết tương cùa prucaloprid
sau liều đơn 2 mg cao hơn trung bình 25% và 51% tương ứng ở cảc bệnh nhân suy2 thận nhẹ
(CICR 50- 79 mL/phút/I ,73 m 2) và suy thận trung bình (CICR 25-49 mL/phút/l ,73 m ².) Ở cảc
P1_Resolor_CCDS OGNOVZO1B_V2 7l9
. /^ư
bệnhnhân suy thận nặng (CICR S 24 mỤphút/ 1,73 m2), nổng độ trong huyết tương gấp 2,3
lân nông độ ở người khỏe mạnh (xem Liêu dùng và ca'ch dùng và Cảnh băo vò Thận trọng).
Suy gan
Sự đóng góp trong việc thải trừ prucaloprid ngoải thặn lẽn tói khoảng 35%. Trong một nghiện
cứu dược động học nhỏ, Cmax vả AUC của prucaloprid trên bệnh nhân suy gan trung bình đến
nặng cao hơn trung bình 10- 20% so với ngườikhòe mạnh (xem Liều dùng vả cách dùng và
Cânh báo và Thận trọng).
Bệnh nhân nhi
Sau một liễu uống đơn 0,03 mg/kg ờ cảc bệnh nhân nhi tuổi từ 4 đến 12 tuối, Cmax của
prucaloprid là tương đương với C,… ở người lớn sau liều đơn 2 mg Mặt khác, AUC là thấp
hơn 30-40% sau liều 2 mg ở người lớn. Nồng độ thuốc 1ả tương tự nhau trong cả khoảng tuôi
(4— 12 tuối). Thời gian bán hủy trung bình ở bệnh nhân nhì là khoảng 19 giờ (trong khoảng
11,6 đến 26,8 giờ).
Tính an toản và hiệu quả của prucaloprid trên bệnh nhân nhi được đánh giá tro t nghiên
cứu mù đôi có đối chứng giả dược Kểt quả về hiệu quả của n gh1en cửu không hỗ trợ cho việc
sử dụng RESOLOR® trên bệnh nhân nhi vả do đó RESOLOR® không được khuyến cảo dùng
cho đối tượng bệnh nhân nảy (xem Líểu dùng vả ca'ch dùng và Nghiên cứu lâm sảng).
Thông tin tiền lâm sâng
Các dữ liệu phi lâm sảng cho thẳy không có tác hại đặc biệt nảo cho người dựa trên những
nghiên cứu quy ước của an toản dược, độc tính cùa liều lập lại, độc tính trên di truyền, khả
năng gây ung thư, và độc tính trên sự phảt triến và sinh sản. Sự mở rộng các nghiên cứu an
toản dược với sự quan tâm đặc biệt trên cảc thông số tim mạch cho thấy không có những thay
đổi liên quan trên huyết động học và trên cảc thông số của ECG (QTc) ngoại trù: có sự gỉa
tãng vùa phải nhịp tim và huyết ảp quan sảt thẩy trên lợn đă được gây mê sau khi dùng thuốc
dạng tiêm tĩnh mạch vả tăng huyết' ap ở chớ không được gây mê sau khi tiêm thuốc tĩnh mạch
nhanh, điều nảy không thấy trên cả chó được gây mê hoặc ở chó sau khi sử dụng thuốc bằng
đường uống mả đạt được cùng nỗng độ trong huyết tương.
THÔNG TIN CỦA THUỐC
Thânh phẩn tá dược
Lactose monohydrat
Microcrystallin cellulose
Colloidal silicon dioxid
Magnesi stearat
Mảng bao:
Viên 1 mg: Viên 2 mg:
Hypromcllose 6 cP Hypromellose 6 cP
Titanium dioxid Oxit sẳt đò
MacrogolỉPEG 3000 Titanium dioxid
Triacetin/Giyccrol triacetat MacrogolfPEG 3 000
Lactose monohydrat Trỉacetin/Glyccrol triacetat
Lactose monohydrat
FD&C BLUE#2
Oxit sắt vỉmg
Pi_Resolor_CCDS OõNov201 3_v2 8|9
Tính tương kị
Không có
Hạn sử dụng
36 thảng kể từ ngảy sản xuất.
Xem hạn dùng trên bao bì ngoải hộp thuốc.
Lưu ý về bảo quãn
Không để ở nơi nhiệt độ trên 30°C, trả.nh ấm.
Đế xa tầm nhìn và tầm tay của trẻ em.
Đóng gỏi
Đỏng gói trong các vi nhôm/nhôm, mỗi vi chứa 7 viên.
Resolor 2 mg: Hộp 4 vì x 7 viên. Hộp 2 ví x 7 viên. Hộp 1 ví x 7 viên.
Resolor 1 mg: Hộp 4 ví x 7 viên. Hộp 2 ví x 7 viên.
Hướng dẫn sử dụng] Xử lý vâ Huỷ bõ
Không có yêu cầu đặc biệt
Hưởng dẫn huỷ bỏ [7 1
Sản phẩm không sử dụng hoặc bao bì vứt bỏ nên được huỷ bỏ theo đ’ yêu cầu của địa
phương.
Sản xuất và xuất xưởng tại: JANSSEN-CILAG S.p.A.,
Via C. J anssen 04010 Borgo San Michele, Latina, Ý
Công ty đăng ký: JANSSEN-CILAG Ltd., Thái Lan
Mọi câu hõi/Báo cáo tác dụng ngoại ý/ Than phiền chất lượng sản phẫm xin liên hệ:
VPĐD Janssen - Cilag Ltd., TP Hô Chí Minh.
ĐT: +84 8 38214828
E-mail: [email protected]
Phíên bản: CCDS 06N0v2013, số 2 0.
PJ_Resoior_ccos OóNov20]3_v2
Ngảy sửa đôi: 30 Dec2014.
TUQ. cuc TRUỜNG
P.TRLỦNG PHÒNG
'J’1ịỹlfỷfể n intấ chìny
PI_Resoior_CCDS OôNov201 3_v2 9l9
.…
U;
QW-
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng