











ZA'SuJ8 ua'lÁUỊwau“ds
J uassueí
`
… SE… ae
zmz bnovmutr o
WMWWWWWIỦWIWM
WHWWW
Em 0 _IÃIIILUĐUỂ
Pan am-ntsưacm ocaJ - Sga bs mủracơ-es de su mécuzo
Mamngase hm ud alranue us los nims Corsewav a lem…er #… : 30'C
Mmưuclueu uy Jmssen-Cllaq SpA, -V.C. Janssen
Borgo S Abcnme - cuon Lanre — Italy
Fov .:anssen Phamzemu NV ~ ỉumhulseueg ao
sm Beerse- Flelgơn
n. ual
6… o Muụunu
……
WIWE
WWW
%hmimumgmnydmbrmrlamuw
"REMINVL' : mg
T…0c BAN INEOM
g REMỈHW 8 mg À^Ảwễmfcrlẵzs nụ cum… maan mm g……
Nbpld x`lvúnnugglù Mde
cnmm. …dủug
humg dhn lù mm nèm meo
Bbqulnũ mmaumạaưc
ae n uu nv mé en
aọc KỸ … DAN sử oụue mươc mc nùue
su: nui Mn mm pnả… cù: na lmẻc gù mom mm. m
28 oral capsules
JỒI'ÌSSEI'ÌT
Jlnnnm NV. \. 55 Oten` 5254 I
M…qu luleủthdlhuócnú phommala
Jun… Phnưmmu NV Tunhoan an …. B-2340
BI. Dôm mm. oOng nôn w ơb vá Iu'l dp, kiếm rụmem va xuli
tuôm … mah mlm lai Jlnl…iag sạA. VnC Ja…
Bơm 5 Mnchee) - 04100 Uch ~ Ý '
sd » sx nsx ND mm Bam … mg um, Enguy Mn um
tNgly MI nm It nffly OI cút mâm hũ hnnl
DM… Wmoơmn Blnn Duma. lim Btnh 0qu
cm JmlmCdag Lu .Tht Lm
SĐK VN-un-u su_ Rơnlnyt_Pũ
rụủthvIdclhômnnlưúc Xlnxunlb
Fa ad adlmdmtnr - Use as drocbed by your physocian
Keeaom d teach otct-«úen › Do mlsloơe above 30"C
°JĨOZfĩlĩẽwm
/
v
XI NVftò ar'm
|
DOna
.LEIÃHG HHcI V(I
n.
EILÀÒH
v
lv
ãugãmpad ùupuooas Jo ›pomụv
ơ
o
’2tq
DNI'I'IEIHV']
g6/ ỡểV
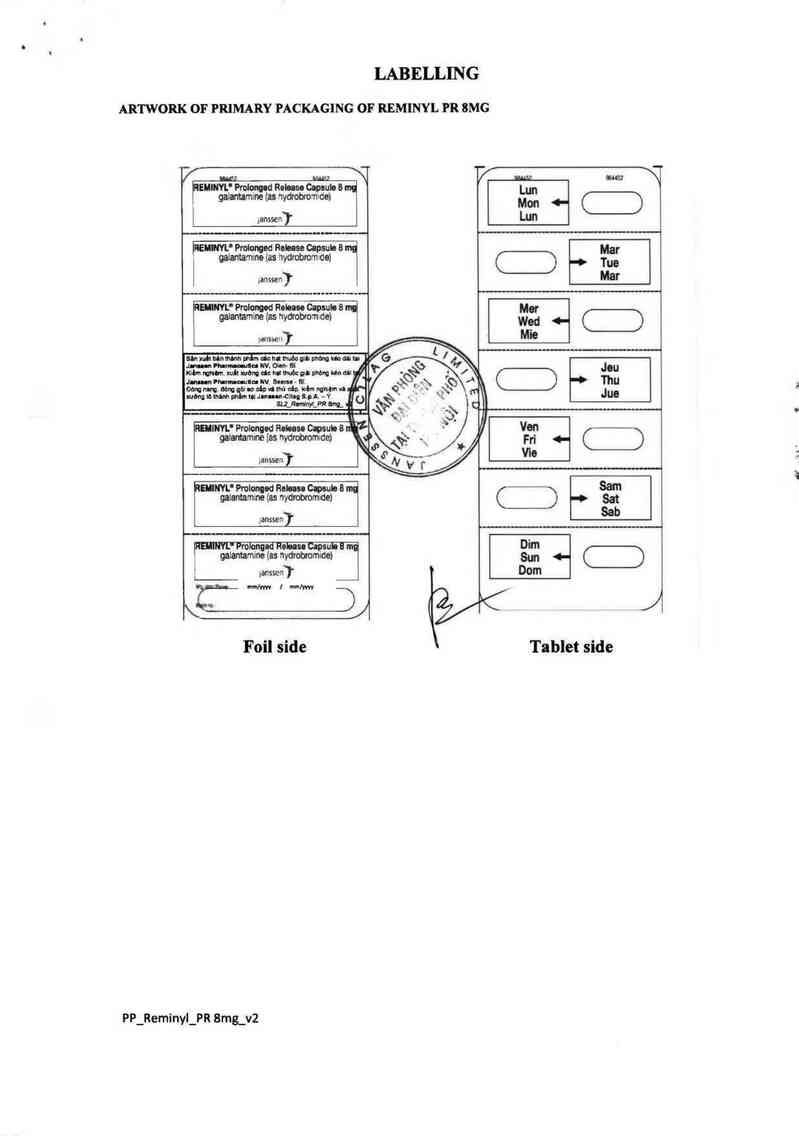
LABELLING
ARTWORK OF PRIMARY PACKAGING OF REMINYL PR 8MG
galmtamim (as nyơobromrde)
|ih$Sên !
`7 , . \“T
GIAIIIYL' Prolonnod Ro… CỤWb B
REIIIIYL° Prolonged Rebuse Gapoule &
galantamme (as Nydrobmmee)
ị pnmnÌ’
aauvư Prolomod Rolaỉ sub e ỉi
galantamine (as nyơobrocẵde)
|dllssen
shaủunmnmỉmnc…mnụnmmaum
WF… IN.OIcn-Bl
«
Wlm min. xuhwủnudcthếcpũ ph0mmml
J… IM…In NV, Bunn ~ 81
M nm. dhng & uu dpn lhú dn luba wh_em ui
mòng : ml… m lù JunuhCltoq In A - Y.
SLZ_W_PR m
lNYL’ Prolonuod Robnu Cọsuh B
galarưamine (es nydrobrơmde)
tansszn7
O
EIINVL° Prulơued R ba Cqmb B
galanmmme (as neydroỂfomnde)
)30352 n
ro o c m pin …
galantarnine (es nydrobmmide)
JanssenÌ’
xỆ——ÌW '… z
Foil side
PP_Reminyl_PR 8mg_v2
Lun
Mon <-
… ©
Mar
C) —
Mar
Mu
… « C)
Mia
L
9 l;
. Ễ° .” Jou
Q~zệzịồ Ị®í^ C) " 332
Ăẹổ— ”ở
. -" Ven
a “Kè " » Fri " C)
,s~ … Vic
^l vr
Sam
CD -> Sat
Sab
ga… C)
n 4-
Dom
Tablet side
®
REMINYL
Thuốc nây chỉ dùng theo đơn của bảc sỹ.
Đọc kỹ hưởng dẫn sử dụng trưởc khi dùng.
Nếu cần thêm thông tin xin hỏi ý kiến bảc sỹ.
THÀNH PHẦN \Jv\jụ
REMINYL viên nang giải phóng kéo dâi chứa galantamin hydrobromid tương uì':…-/oi 8 mg
galantam'm.
Danh sách tảctáduợc
Diethyl phthalat, cthylcellulose, gelatin, hypromellose, macrogol (poiycthylene glycol), tinh bột ngô,
sucrose, titan dioxỉd (El 7 l ).
DẠNG BÀO CHẾ
Viến nang giãi phóng kéo dâi
Viên nang 8mg
Mảu trắng mờ, vò gelatìn cứng cỡ số 4 có in chữ “G 8”, chứa cảc hạt mảu trắng đển trắng nhạt. Mỗi
viên nang có chứa galantamin hydrobromid tương đương vởi 8 mg galantamin.
CHỈ ĐỊNH
REMINYL được chỉ định điều trị sa sút trí tuệ do bệnh Alzheimer mức độ nhẹ đến vừa.
LIÊU DÙNG VÀ CÁCH DÙNG
Liều dùng - Người lởn
Phải đảm bảo uống đủ nước trong quá trinh điều trị.
Liều khởi đầu
Liều khởi đầu khuyến cáo của REMINYL viên nang giải phóng kéo dải là 8 mg/ngảy trong 4 tuần.
Sự chuyển đỗi Iừ dạng giăi phóng tửc [hì sang viên nang giãi phóng kéo dùi
Bệnh nhân đang được điếu trị với REMINYL dạng giải phóng tức thì (viên nén hoặc dung dịch uống)
có thế chuyến sang dùng viên nang REMINYL giải phóng kéo dải bằng cách uống liếu cuối cùng
viến nén giải phóng tức thì hoặc dung dịch uổng REMINYL vảo buối tối vả bắt đầu với liệu trình
một iần mỗi ngảy viên nang REMINYL giải phóng kéo dải vảo sáng kế tiếp. Khi chuyền từ
REMINYL dạng giải phóng tức thì hai lần mỗi ngảy sang viến nang REMINYL giải phóng kéo dải
một lần mỗi ngảy thì tống liều uống hâng ngảy nên như nhau.
Liều duy trì
Liều duy trì khởi đầu là 16 mg một lần mỗi ngảy và bệnh nhân nên được duy trì với liếu 16 mg mỗi
ngảy trong ít nhất 4 tuần.
Tăng đến liều duy trì tối đa 24 mg một lần mỗi ngảy cần phải được cân nhắc sau khi đã có nhũng
dảnh giá đúng đẳn về lợi ích lâm sảng và độ dung nạp.
PI_Reminyl_PR 8mg_CCDS 29Apr2014_v1 1116
.ẵSEI:
Sự ngừng thuốc
Không có hiệu ứng dội ngược sau khi ngừng điều trị đột ngột (ví dụ: chuẩn bị phẫu thuật).
Dân số đặc biệt
T rẻ em
Việc sử dụng REMINYL cho trẻ em không được khuyến cảo. Chưa có dữ liệu về việc sử dụng
REMINYL cho bệnh nhi.
Suy Ihận
Nồng độ galantamin trong_huyết tương có thể tăng ở những bệnh nhân bị suy thậnịmức độ trung bình
(độ thanh thải creatinin = 52-104 mL/phủt) tới nặng (độ thanh thải creatinin = 9 — 51 mL/phút).
Không cần chỉnh liều đối với những bệnh nhân có độ thanh thải creatinin a 9 mL /phút (xem Đặc
tính dược động học — Dán số đặc biệt).
Việc sử dụng REMINYL cho những bệnh nhân có độ thanh thải creatinin dưới 9 mL/phủt không
được khuyến cáo vì chưa có đầy đủ dữ liệu.
Suy gan
Nồng độ galantamin trong huyết tương có thể tăng ở những bệnh nhân bị suy gan hoặc thận mức độ
trung bình tới nặng.
Ở những bệnh nhân bị suy gan mức độ trung binh (thang đỉếm Child—Pugh 7-9), dựa vảo mô hinh
dược động học, nến khởi đầu với liều 8 mg cảch một ngảy trong ít nhẩt 1 tuần, tốt nhất vảo buổi
sáng. Sau đó, bệnh nhân nên tiểp tục với 8 mg một lần mỗi ngảy với viên nang giải phóng kéo dải
trong ít nhẩt 4 tuần Ở những bệnh nhân nảy, tổng liếu mỗi ngảy không nên vượt quá 16 mg.
Việc sử dụng REMINYL cho những bệnh nhân bị suy gan nặng (thang điếm Child—Pugh > 9), không
được khuyến cáo /
Đíều trị đồng thời
Cần xem xét giảm liếu ở những bệnh nhân được điểu trị bằng những thuốc ức chế CYP2D6 hoặc
CYP3A4 mạnh (xem phần T ương tăc với những thuốc khác vả các dạng tương tác — Các thuốc ánh
hưởng tới sự chuyển hoá galantamin).
Cách dùng
REMINYL được dùng đường uống.
Nên uống viên nang giải phóng kéo dải REMINYL ngảy 1 iần vảo buổi sảng, tốt nhất là trong bữa
an.
CHỐNG CHỈ ĐỊNH
Không được sử dụng REMINYL cho những bệnh nhân đã được biết quá mẫn với galantamin
hydrobromid hoặc bất cứ tả dược nảo của thuốc.
Pl_Reminyl_PR 8mg_CCDS 29Apl2014_V1 2|16
II:. /'.
CẢNH BÁO vÀ THẬN TRỌNG
Các thế sa sút trí tuệ khác với sa sút trí tuệ của bệnh Alzheimcr
REMINYL được chỉ định điều trị sa sủt trí tuệ do bệnh Alzheimer mức độ nhọ đến vừa. Lợi ích cùa
REMINYL ở bệnh nhân sa sút trí tuệ các thế khác hoặc các thế cùa suy giảm trí nhớ khác chưa được
chứng mỉnh.
Các phản ứng da nghỉêm trọng
Các phản ứng da nghỉêm trọng (hội chửng Stevens-Johnson và bệnh ngoại ban mụn mủ cẳp tính) đã
được báo cảo trên những bệnh nhân sử dụng REMINYL (xem Tác dụng không mong muốn). Bệnh
nhân nên được thông báo về cảc dấu hiệu cùa cảc phản ứng da nghỉếm trọng và ngừng sử dụng
REMINYL khi xuất hiện dấu hiệu phát ban da đầu tiến.
Theo dõi cân nặng
Bệnh nhân bị bệnh Alzheimer bị sụt cân. Việc điểu trị cảc bệnh nhân nảy bằng nhũng thuốc ức chế
mcn cholincsterase, kể cả gaiantamỉn, đều có liên quan đến tình trạng sụt cân. Do đó cần phải theo
dõi thề trỌng bệnh nhân trong quá trình điếu trị.
Những trường hợp cần thận trọng
Cũng như những thuốc tảc dụng gỉống choiin khác, cần thận trọng khi sử dụng REMINYL trong
những trường hợp sau:
Tim mạch: Do tác dụng dược lý, các thuốc tác dụng giống cholin có thế có những tác động cùa
trương lực thẳn kinh đối giao câm lên nhịp tim (ví dụ: nhịp tim chậm). Điếu nảy có thể đặc biệt quan
trọng đối vởi những bệnh nhân bị “hội chứng suy nút xoang” hoặc có các dạng rối loạn dẫn truyền
trên thất hoặc ở những người dang dồng thời sử dụng thuốc lảm giảm nhịp tim đảng kế như digoxin
vả các thuốc ửc chế thụ thể beta. Trong các thử nghiệm lâm sảng, vìệc sử dụng REMINYL có lỉẽn
quan tới ngắt và hiếm khi có lỉên quan đến tỉnh trạng nhịp tim rất chậm.
Tiẻu hóa: Đối với những bệnh nhân có nguy cơ khởi phảt bệnh lý loét đường tiếu hóa, ví dụ như
những bệnh nhân có tiền sử bị loét hoặc có các yếu tố thuận lợi để gây loét bao gồm những bệnh
nhân đang sử dụng đồng thời các thuốc chống vỉếm không steroid (NSAIDS), thỉ cẩn phải theo dõi
chặt chẽ để tỉm cảc triệu chứng. Tuy nhiến, các nghiên cứu lâm sảng cho thẫy REMINYL không lảm
tăng tần suất loét hoặc xuất huyết tiêu hóa (so Với giả dược). Không nên sử dụng REMINYL cho
những bệnh nhân bị tắc nghẽn dường tiêu hóa hoặc những bệnh nhân đang hồi phục sau phẫu thuật
đường tiêu hóa.
Thần kinh: Cảc cơn co giật đă được báo cáo trên bệnh nhân sư dụng REMINYL (xem Tác dụng
khỏng mong muốn — Dữ liệu hậu mãi). Con co giật cũng có thể là một biếu hiện của bệnh Alzhcìmcr.
Bệnh phối: Do những hoạt động giống như cholin nến các thuốc nhóm nảy cần được sử dụng thận
trọng ở những bệnh nhân có tiến sử hen phế quản nặng hoặc bệnh phổi tắc nghẽn.
T iết niệu-sinh dục: Không nến sử dụng REMINYL cho những bệnh nhân bị tắc nghẽn đường niệu
hoặc đang hồi phục sau phẫu thuật bảng quang.
An toản trên bệnh nhân bị suy giảm nhận thức mức độ nhẹ (MCI)
REMINYL không được chỉ định cho những bệnh nhãn bị suy giảm nhận thức mức độ nhẹ (MCI), ví
dụ như nhũng nguời cỏ biếu hỉện suy giảm trí nhớ biệt lập nhiều hơn mong đợi so với tuồi vả kiến
thức của họ, nhưng không thỏa mãn cảc tiêu chí của bệnh Alzhcỉmcr.
Pl_Reminyl_PR 8mg_CCDS 29Apr2014_v1 3/16
Các đối tượng nghiên cứu thế MCI trong hai thử nghiệm có kiếm chứng, trong hai năm, không thòa
mãn cảc kết quả hiệu quả kép ban đầu. Mặc dù tỷ lệ tử vong ở hai nhóm điều trị thấp, cảc trường hợp
tử vong khác đã được ghi nhận đầu tiên ở các đối tượng ngẫu nhiên dùng galantamin nhiều hơn so
với giả dược, nhưng tỷ lệ cảc biến cố bất iợi nghiêm trọng lả giống nhau giữa hai nhóm điều trị. Tử
vong do rất nhiếu nguyên nhân không dự đoản được ở nhóm dân số cao tuổi. Khi bao gồm cả dữ liệu
thu được từ một số lượng lớn bệnh nhân đã ngừng đìều trị trước khi kểt thúc thời gian mù đôi, không
thấy bằng chứng về việc tăng nguy cơ tử vong ở những đối tượng được điều trị với REMINYL trong
thời gian nảy. Cảc đối tượng ở nhóm giả dược ngừng điều trị trưởc khi tử vong nhiếu hơn nhóm
galanta_min, có thế là nguyên nhân dẫn đến sự khảo biệt về từ lệ tử vong cùa cảc ghi nhận ban đầu.
Cảc kết quả của nghiên cứu MCI không nhất quán với kết quả được quan sảt trong cảc nghiên cứu
cùa bệnh Alzheimer. Trong các nghiên cứu tổng hợp về bệnh Alzheimer (N=4614), tỷ lệ tử vong ở
nhóm giả dược có số lượng cao hơn ở nhóm REMINYL.
TƯỢNG TÁC VỚI CÁC THUỐC KHÁC VÀ cÁc LOẠI TƯỚNG TÁC KHÁC
Các tương tác dược lực học
Do cơ chế tảc dụng, không nên sử dụng đồng thời glantamin vởi các thuốc có tảc dụng giống choiin
khác. Galantamin đối kháng với tảc dụng của cảc thuốc kháng cholinergic. Thông thường ở cảc
thuốc tảc dụng giống cholin, tương tảc dược lực học có thể xảy ra với cảc thuốc lảm giảm đáng kể
nhịp tim (ví dụ digoxin và các thuốc ức chế thụ thể beta). Galantamin, như một thuốc tảc dụng giống
choiin, có thể tảo động mạnh lên sự giăn cơ kiếu succinylcholin trong khi gây mê.
Ca'c tương ta'c dược động học
Galantamỉn chuyến hóa qua nhiều con đường và được thải qua thận.
Dựa trên các nghiên cứu in vitro, nhận thấy 2 men chủ yếu tham gia vảo quá trình chuyển hóa của
galantamin lả CYP2D6 vả CYP3A4.
Sự hấp thu của galantamin không bị giảm khi sự bải tiết acid dịch vị bị ức chế.
Các th uốc khảc ãnh hưởng lên ch uyển hóa của galantamin
Những thuốc ức chế mạnh men CYP2D6 vả CYP3A4 có thế lảm tăng (AUC) của galantamin.
Nhiều nghiên cứu về dược động đa liều cho thấy khi được uống cùng với ketoconazol vả paroxetin
thì AUC của galantamin tãng theo thứ tự là 30% và 40%. Còn khi được uống cùng với erythromycin-
một thuốc ức chế men CYP3A4 khác- thì AUC của galantamin chỉ tăng khoảng 10%. Phân tích dược
động học trên nhóm dân số bị bệnh Aizheimer cho thấy độ thanh thải của galantamin giảm khoảng
25-33% khi nó được uống chung với amitriptylin, fiuoxetin, fluvoxamin, paxoxetin vả quinidin, lả
những thuốc ức chế men CYP2D6.
Vì vậy, trong giai đoạn khởi đầu điểu trị với cảc thuốc ức chế mạnh men CYP2D6 vả CYP3A4, bệnh
nhân có thể tăng tần suất cảc tác dụng phụ cholinergic, chủ yếu là buồn nôn vả nôn. Trong những
trường hợp như vậy, cần dựa vảo khả năng dung nạp để cân nhắc giảm liều duy trì của galantamin.
(Xem Liều dùng và cảch dùng- Dân số đặc biệt).
Pl_Remỉnyl_PR 8mg_CCDS 29Apf2014_v1 4|16
ị\t` [“
lẻ
ụ
Memantin, một đối kháng thụ thể N-methyl-D-aspartat (NMDA), ở liếu 10 mg/ngảy trong 2 ngảy,
tiếp theo sau đó là liếu 10 mg 2 lần một ngảy trong 12 ngảy không thấy có tác động trên dược động
học cùa galantamin 16 mg/ngảy ở trạng thải hằng định.
Ấnh hưởng của galantamin lẽn chuyển hóa của các thuốc khác
Liều điếu trị của gaiantamin (12 mg x 2 lần/ngây) không ảnh hướng lên động học cùa digoxin vả
warfarin. Galantamin không ảnh hưởng đến tảc dụng kéo dải thời gian prothrombin gây ra bởi
warfarĩn.
Cảc nghíên cứu in vitro c_ho thấy tiếm nãng gây ức chế cùa galantamin đối với cậc dạng chủ yếu của
men cytochrom P450 ở người là rất thấp.
PHỤ NỮ có THAI, CHO CON BỦ
Phụ nữ có thai
Những nghiên cứu về sinh sản được tiến hảnh ở chuột cống mang thai với liếu lên đến 16 mg/kg (gấp
khoảng 25 lần liếu điếu trị ở người) vả ớ thỏ mang thai với liều lên đến 40 mg/kg (gấp khoảng 63 lần
liều điều trị ở người) đã không cho thấy bất kỳ bằng chímg nảo vế tiếm năng gây quải thai. Cỏ ghi
nhận được sự gia tăng không có ý nghĩa thống kê về tần suất gây bất thường ở cảc xưong nhỏ với
liếu 16 mg/kg ở chuột cống.
Chưa có nghiến cứu sử dụng REMINYL ở phụ nữ mang thai. Chi sữ dụng REMINYL trong thời kỳ
mang thai khi mà lợi ích do thuốc mang lại cho bả mẹ quan trọng hơn nguy cơ đối với bảo thai.
Phụ nữ cho con bú
REMINYL hiện chưa được biết là có bải tiết qua sữa mẹ hay không và chưa có nghiên cứu nảo ở phụ
nữ đang cho con bủ. Vì vậy, những phụ nữ đang uống REMINYL không nên cho con bủ.
ẢNH HƯỚNG TRÊN KHẢ NĂNG LÁI XE VÀ VẶN HÀNH MÁY MÓC @
Bệnh Alzheimer có thể gây giảm dần khả nảng lái xe và vận hảnh mảy móc. Hơn nữa, giỗ g như cảc
thuốc dạng cholin khảc, REMINYL có thể gây cảc phản ửng bất lợi (như choáng váng và ngủ gả),
điều nảy gây ảnh hưởng đển khả nãng lái xe và vận hảnh mảy móc, đặc biệt trong những tuần đầu
tiên sau khi bắt đầu điều trị (xem Tác dụng khỏng mong muốn).
TÁC DỤNG KHÔNG MONG MUÔN
Cảo phản ứng bất lợi sẽ được trinh bảy trong phần nảy. Những phản ứng bất lợi được xem lá có liên
quan dến việc sử dụng gaiantamin hydrobromid dựa trên việc đảnh giá toản điện những thông tin về
bỉến cố bất lợi sẵn cỏ. Mối quan hệ nhân quả với galantamin hydrobromid không thể xảo định chẳc
chẳn ở từng trường hợp riếng lẻ. Hơn nữa, những thử nghiệm lâm sảng nảy được thực hiện trong
những điếu kiện khác nhau, tỷ lệ cảc phản ứng bẩt lợi được ghi nhận trong những thử nghiệm lâm
sảng cùa một thuốc không thể so sánh trực tiếp với tỷ lệ trong cảc thử nghiệm lâm sảng của các
thuốc khác và có thế nó cũng không phản ảnh tỷ lệ ghi nhận được trong thực hảnh lâm sảng.
Dữ lỉệu thử ngh ỉệ`m lâm sảng
PI_Reminyl_PR Brng_OCDS 29Apr2014_v1 sne
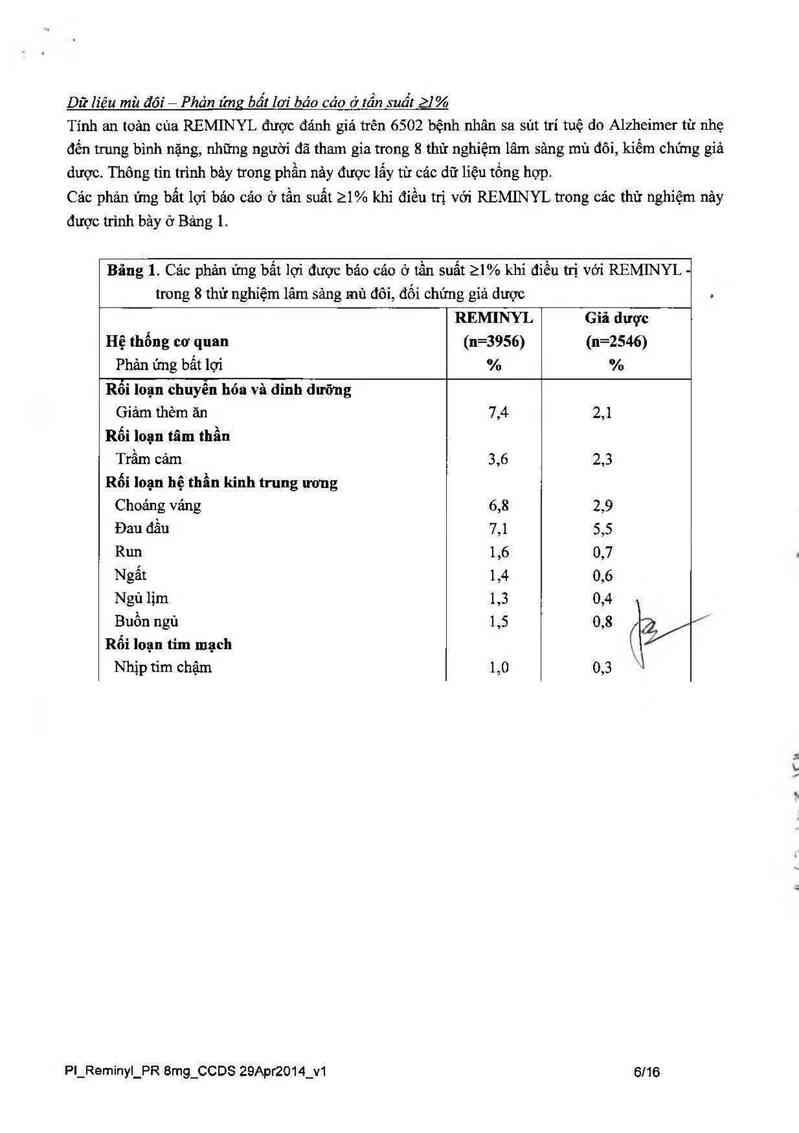
Dữ liêu mù đôi — Phản ứng bất lơi báo cáo ở tồn suốt 21%
Tính an toản cùa REMINYL được đánh giá trên 6502 bệnh nhân sa sủt trí tuệ do Alzheimer từ nhẹ
đến trung bình nặng, những người đã tham gia trong 8 thử nghiệm lâm sảng mù đôi, kiềm chứng giả
dược. Thông tin trình bảy trong phần nảy được lắy từ cảc dữ liệu tổng hợp.
Cảc phản ứng bất lợi bảo cảo ớ tẩn suất 21% khi điếu trị với REMINYL trong cảc thử nghiệm nảy
được trình bảy ở Bảng 1.
Bãng 1. Cảc phản ứng bất lợi được bảo cảo ờ tần suất 21% khi điều trị vởi REMINYL -
trong 8 thứ nghỉệm lâm sảng mù đôi, đối chứng giả dược
REMINYL Giả dược
Hệ thống cơ quan (n=3956) (n=2546)
Phản ứng bất lợi % %
Rối loạn chuyến hóa và dinh dưỡng
Gíảm thèm ăn 7,4 2,1
Rối loạn tãm thần
Trầm cảm 3,6 2,3
Rối loạn hệ thần kinh trung ương
Choáng vảng 6,8 2,9
Đau đằu 7,1 5,5
Run 1,6 0,7
Ngất 1,4 0,6
Ngủ lịm 1,3 0›4
Buồn ngủ 1,5 0,8
Rối loạn tim mạch
Nhịp tim chậm 1,0 0,3
PI_Reminyl_PR 8mg_CCDS 29Api2014_V1 6/16
n’n
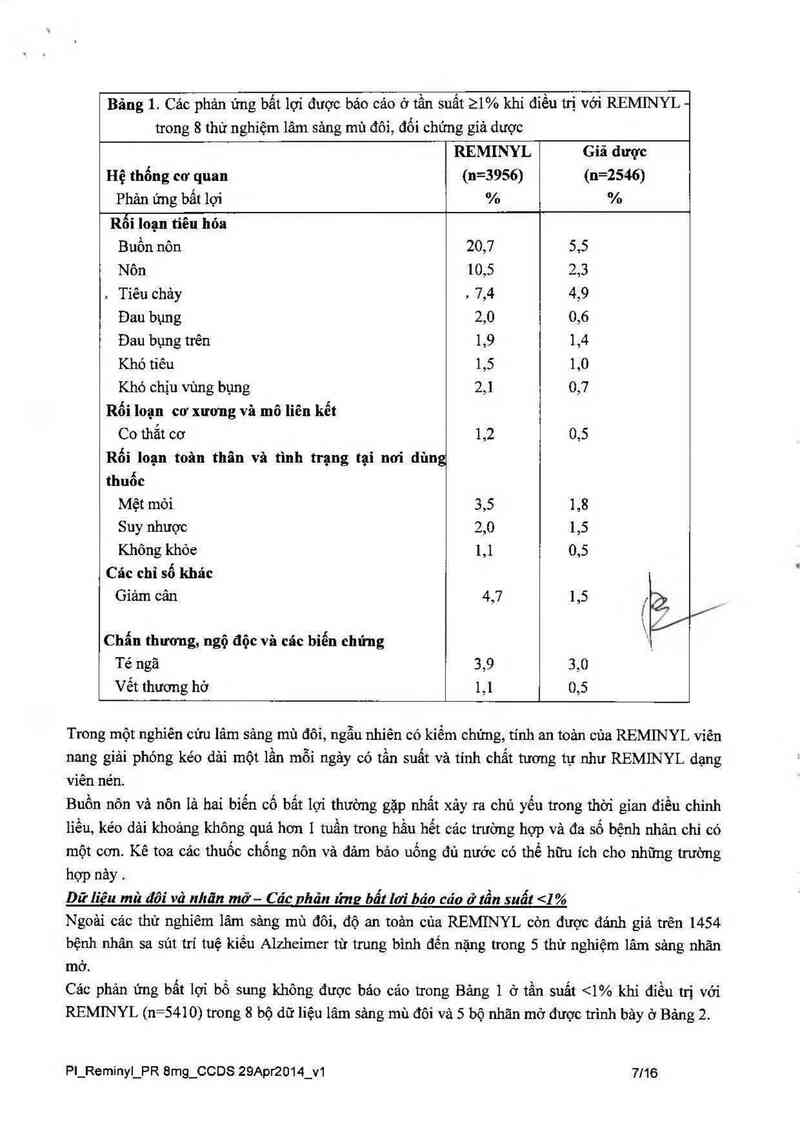
Bảng 1. Các phản ứng bất lợi được báo cảo ở tần suất 21% khi điều từ với REMINYL -
trong 8 thử nghiệm lâm sảng mù đôi, đối chứng giả dược
REMINYL Giã được
Hệ thống cơ quan (n=3956) (n=2546)
Phản ứng bất lợi % %
Rối loạn tiếu hỏa
Buồn nôn 20,7 5,5
Nôn 10,5 2,3
. Tiêu chảy , 7,4 4,9
Đau bụng 2,0 0,6
Đau bụng trên 1,9 1,4
Khó tiêu 1,5 1,0
Khó chịu vùng bụng 2,1 0,7
Rối loạn cơ xương và mô liên kết
Co thẳt cơ 1,2 0,5
Rối loạn toân thân và tình trạng tại nơi dùng
thuốc
Mệt mỏi 3,5 1,8
Suy nhược 2,0 1,5
Không khỏe 1,1 0,5
Các chỉ số khác
Giảm cân 4,7 1,5 /
( J /
Chẩn thương, ngộ độc và các biến chứng \
Tê ngã 3,9 3,0
Vết thương hở 1,1 0,5
Trong một nghiên cứu lâm sảng mù đôi, ngẫu nhiến có kiếm chứng, tính an toản cùa REMINYL viên
nang giải phỏng kéo dải một lần mỗi ngảy có tần suất và tính chắt tương tự như REMINYL dạng
viên nén.
Buồn nôn vả nôn là hai biến cố bất lợi thường gặp nhất xảy ra chủ yếu trong thời gian điều chỉnh
lìều, kéo dải khoảng không quả hơn 1 tuần trong hầu hết các trường hợp và đa số bệnh nhân chi có
một cơn. Kê toa cảc thuốc chống nôn vả dảm bảo uống đủ nước có thể hữu ích cho những trường
hợp nảy .
Dữ liêu mù đôi vã nhãn mở— Ca'c nha’n ứng bẩt lơi báo cáo ở tẩu suất <1%
Ngoài các thủ nghiêm lâm sảng mù đôi, độ an toản của REMINYL còn được đảnh giả trên 1454
bệnh nhân sa sút trí tuệ kiều Alzhcimcr từ trung bình đến nặng trong 5 thử nghiệm lâm sảng nhãn
mờ.
Các phản ứng bất lợi bổ sung không được bảo cảo trong Bảng 1 ở tần suất <1% khi điếu trị với
REMINYL (n=5410) trong 8 bộ dữ liệu lâm sảng mù đôi và 5 bộ nhãn mở được trình bảy ở Bảng 2.
Pl_Reminyl_PR emg_ccos 29Apr2014_v1 7116
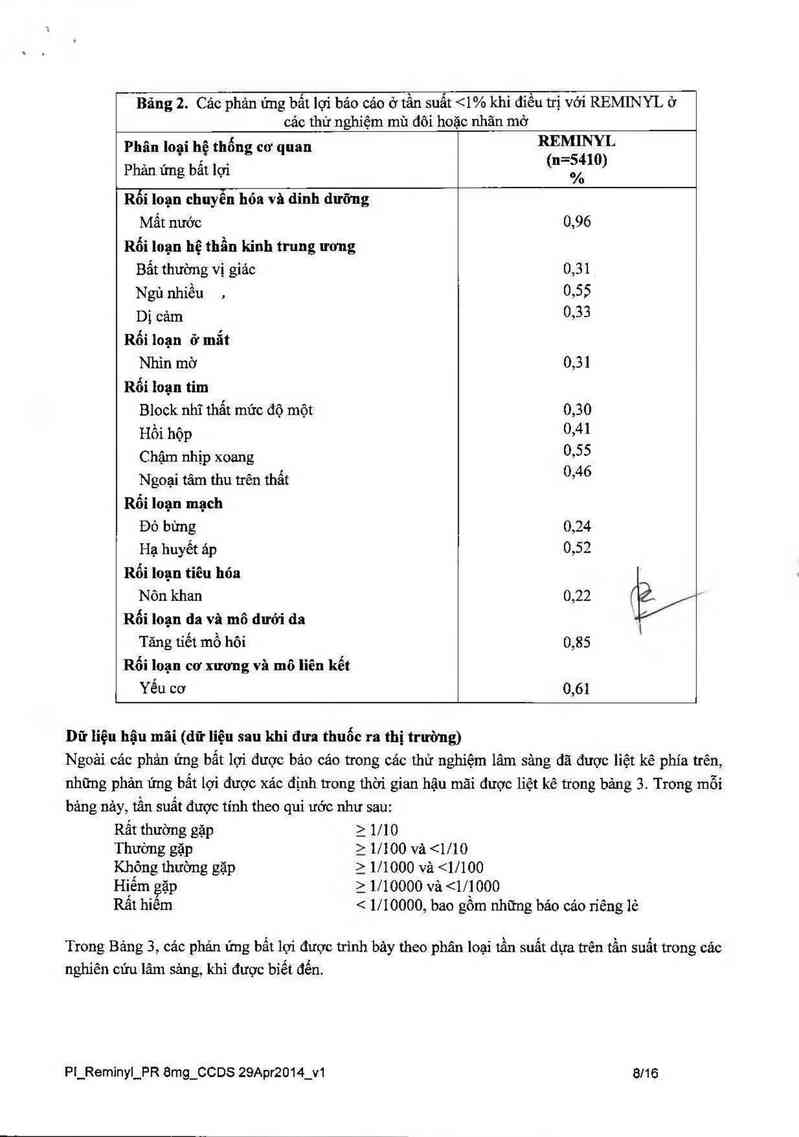
Bãng 2. Các phản ứng bất lợi bảo cảo ở tần suất <1% khi điều trị với REMINYL ở
các thử nghiệm mù đôi hoặc nhãn mở
Phân loại hệ thống cơ quan REMINYL
Phản ứng bất lợi (“=Ể/Ím)
Rối loạn chuyến hóa và dinh dưỡng
Mắt nước 0,96
Rối loạn hệ thần kinh trung ương
Bắt thường vị giảc 0,31
Ngủ nhiều . 0,55
Dị càm 0,33
Rối loạn ởmẵt
Nhìn mờ 0,31
Rối loạn tim
Block nhĩ thất mức độ một 0,30
Hổi hộp 0›41
Chậm nhịp xoang 0955
Ngoại tâm thu trên thất 0’46
Rối loạn mạch
Đò bừng 0,24
Hạ huyết áp 0,52
Rối loạn tiêu hóa
Nõn khan 0,22 42/
Rối loạn da và mô dưới da "
Tăng tiêt mô hôi 0,85
Rối loạn cơ xương và mô liên kết
Yếu cơ 0,61
Dữ liệu hậu mãi (dữ liệu sau khi đưa thuốc ra thị trường)
Ngoài các phản ứng bất lọi được bản cáo trong cảc thử nghiệm lâm sảng đã được liệt kê phía trên,
những phản ứng bẳt lợi được xác định trong thời gian hậu mãi được liệt kê trong bảng 3. TrOng mỗi
bảng nảy, tần suất được tinh theo qui ước như sau:
Rất thnờng gặp a 1110
Thường gặp 2 1/100 vả <1/10
Không thường gặp 2 111000 vả <1/100
Hiểm gặp z 1l10000 vả <1/1000
Rât hiêm < 1/ 10000, bao gồm những báo cáo riêng lẻ
Trong Bảng 3, các phản ứng bất lợi được trình bảy theo phân loại tần suất dựa trên tần suất trong các
nghiên cứu lâm sảng, khi được biết đến.
Pt_Remỉnyl_PR 8mg_CCDS 29Apr2014_v1 8116
Bảng 3. Các tác phản ứng bât lợi được xác định trong giai đoạn hậu mãi cùa
REMINYL theo tần suất ước tính dựa trên các thử nghiệm lâm sảng
Hệ thống cơ quan
Phản ứng bất lợi
Rối loạn hệ miễn dịch
Khỏng thường gặp — Quá mẫn cảm
Rối loạn tâm thần
Thường gặp — Ào giác
Khóng thường gặp - Ào thị, Ào thanh
Rối loạn hệ thống thần kinh
Khóng thường gặp — Co giật
Rối loạn tai và mê đạo
Khóng thường gặp — Ù tai
Rối loạn mạch
Thường gặp — Tăng huyết áp
Rối loạn hệ gan - mật
Hiếm gặp — Viêm gan
Rối loạn da và mô dưới da
Khỏng được bíết — Hội chứng Steven - Johnson, Bệnh ngoại ban mụn
mủ cẩp tính, Hồng ban đa dạng
Các chỉ số khác
Khỏng thường gặp - Tăng men gan
Thông băo cho bác sĩ những tác dụng không mong muốn gặp phăi khi dùng Ihuổc.
QUÁ LIÊU
Triệu chứng và dấu hỉệu
Cảo dấu hiệu và triệu chứng quá liều có ý nghĩa của galantamin có thể xảy ra tương tự như quá liếu
của cảc thuốc tác dụng giống cholin khác. Những tảo dụng nảy thường ảnh hưởng lên hệ thần kinh
trung ương, hệ phó giao cảm và chỗ nối thần kinh cơ. Ngoài triệu chứng yếu cơ và rung cơ cục bộ,
một số hay tất cả những biếu hỉện của cơn cholinergic có thể khởi phát: buồn nôn dữ dội, nôn, co thắt
ống tiêu hóa, tăng tiết nước bọt, chảy nước mắt, tiếu tiện, đại tiện, toát mồ hôi, nhịp tim chậm, hạ
huyết áp, ngã qụy và co giật. Tăng yếu cơ cùng với tăng tiết khí quản và co thắt phế quản có thể dẫn
tởi nguy hiểm tính mạng do ngạt thớ.
Có các báo cáo hậu mãi về xoắn đỉnh (Torsade de Pointes), kéo dải khoảng QT, nhịp tim chậm, nhịp
nhanh thất vả mất ý thức ngắn có iiên quan đến việc quá liều galantamin do vô ỷ. Trong một trường
hợp đã biết được liều, 8 viên nén hảm lưọng 4 mg (tổng 32 mg) đã được uống trong một ngảy.
Hai trường hợp nữa do vô tình uống 32 mg (buồn nôn, nôn và khô miệng; buồn nôn, nôn và đau
ngực vùng dướixương ức) và một trường hợp uống 40 mg (buồn nôn) phải nằm viện một thời gian
ngắn dề theo dỏi vả hổi phục hoản toản. Một bệnh nhân, người đã được kê đơn 24 mglngảy vả có
PI_Reminyl_PR 8mg_CCDS 29Apr2014_v1 9116
tiền sử bị ảo giảc trong 2 nãm trước, đã uống nhầm 24 mg hai lần/ngảy trong 34 ngảy và phát triền
ảo giảc cần phải nhập viện. Một bệnh nhân khảc được kê đơn 16 mg/ngảy dung dịch uống, đã vô tình
uống 160 mg (40 mL) đã vã mồ hôi, nôn, nhịp tim chậm và gần như ngất một giờ sau đó, cần phải
nhập viện điều tri. Các triệu chứng của bệnh nhân nảy đã được giải quyết trong vòng 24 giờ.
Điều trị
Các biện phảp hỗ trợ thông thường nên được sử dụng trong mọi trường hợp quá iiếu. Đối với những
trường hợp nặng, thuốc kháng cholinergic như atropin được sử dụng như thuốc giải độc cho cảc
thuốc tác dụng giống cholin. Liều khởi đầu nên là 0,5 -1 mg tiêm tĩnh mạch, các liếu kế tiếp dựa vảo
đảp (mg lâm sảng. _
Do các chiến lược kiếm soát quả lỉếu liên tục phát triến, nên liên lạc với trung tâm kiếm soát độc chất
để có được những khuyến cáo mới nhất về cảch xử trí quá liều.
ĐẶC TỈNH DƯỢC LỰC HỌC
Nhóm dược lý trị liệu: Thuốc chống sa sút trí tuệ, mã ATC: NOóDAO4.
Cơ chế tác dụng
Galantamin, một alkaloid bậc 3, là một thuốc ức chế cạnh tranh, chọn lọc và có thể đảo ngược đối
với acetylcholỉnesterase. Ngoài ra, galantamin lảm gia tãng tác động nội tại của acetylcholin lên thụ
thể nicotin, có lẽ thông qua việc gắn kết vảo một vị trí allosteric cùa thụ thế. Do vậy, một sự gia tăng
hoạt tính của hệ cholinergic liên quan tới việc cải thiện chức năng nhận thức có thể đạt được ở những
bệnh nhân sa sút trí tuệ do Alzheimer.
Các nghiến cứu lâm sâng /
Các liều dùng của REMINYL có hiệu quả trong cảc thử nghiệm lâm sảng có đối chứng iả 16, 24 và
32 mg/ngảy. Trong cảc lỉều nảy, liều 16 và 24 mg/ngảy được xác định là có mổi tương quan giữa
hiệu quả1nguy cơ tốt nhất và được coi như lá cảc liếu dùng khuyến cảo. Hiệu quả cùa galantamin đã
được nghiên cứu bằng cảch sử dụng 4 cách đảnh giá kết quả đặc trưng lả: ADAS-Cog (đảnh giả nhận
thức dựa trên hoạt động), CIBIC-Plus (lượng giá toản bộ bởi cảc bảo sĩ độc lập dựa trên phỏng vấn
lâm sảng với người bệnh và người chảm sóc), một số đánh giá về các hoạt động cùa cuộc sống hảng
ngảy và bản đánh giá tâm thần kinh (NPI, thang đo lường cảc rối loạn hảnh vi).
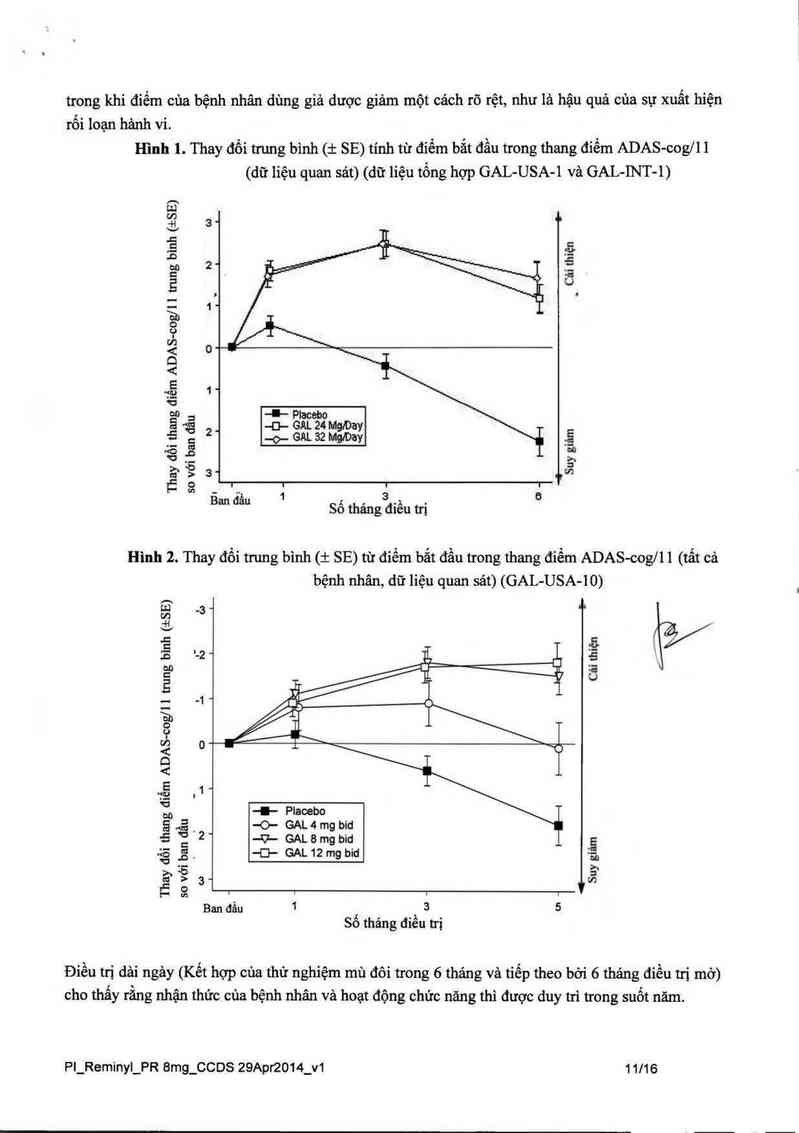
Trong cảc nghiên cứu lâm sảng, hoạt động của các bệnh nhân điều trị bằng galantamin đảnh giả bằng
ADAS-cog (xem hình) và CIBIC-plus tốt hơn một cảch thống nhất và có ý nghĩa thống kế so với cảc
bệnh nhân dùng giả dược. Cảc bệnh nhân được điều trị trong 6 thảng bằng gaiantamin có điếm
ADAS—Cog cải thiện một cảch đáng kể so với đỉếm ban đầu cùa họ. So với cảc bệnh nhân không
được điều m, có một lợi ích đáng kế và duy tri liên tục trên chức năng nhận thức. Điều trị bằng
galantamin cũng đã duy trì các hoạt động của cuộc sống hảng ngảy nhưmặc quần áo, vệ sinh, chuẩn
bị bữa ản. Nhũng điều nảy được lượng giá bằng Đảnh giá sự tản phế trong sa sút trí tuệ (DAD) vả
Họp tác nghiên cửu bệnh Alzheimer (ADCS)-Bán đảnh giá ADL, lượng giá liên quan tới người chăm
sỏc. Các liếu 16 và 24 mg galantamin mỗi ngảy duy trì điếm NPI trong suốt giai đoạn nghiên cứu
PI_Reminyl_PR 8mg_CCDS 29Apr2014_v1 10116
trong khi điếm của bệnh nhân dùng giả dược giảm một cảch rõ rệt, như 13 hậu quả của sự xuất hiện
rối ioạn hảnh vi.
Hình 1. Thay đối trung bình (:1: SE) tính từ điếm bắt đầu trong thang điểm ADAS-cog/ll
(dữ liệu quan sát) (dữ liệu tổng hợp GAL-USA-l vả GAL-INT—l)
@
cn J ủ
LH, 3
Ể ổ
_D .-
un 2“ .Ể
Ế u
: 1…
ìt
0
v
Ê 0
D
<
…ẫ 1~
G
on _ +Ptaceho
ẵg 2_ —D-GRL24MgtDay
Ế ã …ọ.enaztttgoay .ẳ
“8 -° °“
18 ?
Ề > 31 vm
ff 8 , ',-,, ' ; a
"" Sốthángđiểutri
Hình 2. Thay đối trung bình (i SE) từ điếm bắt đầu trong thang điếm ADAS-cogll 1 (tất cả
bệnh nhân, dữ liệu quan sảt) (GAL-USA-IO)
…, _ 11
gj -3
it
Ế .ẽ
.o '2 -5
°” 3
= U
Ê
: '1'
ì;
Ẹ i
ẫ O-I .L `Ĩ
Q
<
’fẵ J“
Ẹ, + Placebo
ã…ẵ_ -o- GAL4mgbid
-s ã ²“ -v- GALBmgbid ẵ
ịẫ f“ -ũ— GAL12mgbid 'ũ
>,~O ẫ'
u › 3— cn
15 a . . . . V
Banđầu 1 3 5
sộ tháng điều trị
Điểu trị dải ngảy (Kết hợp của thử nghiệm mù đôi trong 6 tháng và tiếp theo bời 6 thảng điếu trị mớ)
cho thấy rằng nhận thức của bệnh nhân và hoạt động chức năng thì được duy trì trong suốt năm.
Pl_Reminyl_PR 8mg_CCDS 29Apứ014_v1 11116
Hiệu quả của viên nang REMINYL giải phỏng kẻo dải được nghiên cứu trong một thử nghiệm có đối
chứng, ngẫu nhiến, mù đôi trên bệnh nhân Aizheimcr. Bệnh nhân uống galantamin 8 mg/ngảy trong
4 tuần, sau đó uống tiếp gaiantamin 16 mglngảy trong 4 tuần. Tại tuần thứ 8, liếu có thế tảng đến 24
mg/ngảy dựa vảo độ an toân và khả năng dung nạp, và có thế giảm đến 16 mg/ngảy vảo tuần thứ 12.
Liều lựa chọn tại tuần thứ 12 sẽ cố định cho thời gian còn lại của 6 thảng điều trị. Trong phân tích
hiệu quả bnn đầu cùa đề cương thiết kế cho 2 tiêu chí (ADAS-cog/ll vả CIBIC-plus) tại cùng tháng
6, REMINYL giải phóng kéo dải cho thấy cải thiện có ý nghĩa hơn giá dược chi trên ADAS-cog/l 1.
Thêm vảo đó, REMINYL giải phóng kéo dải cải thiện có ý nghĩa thống kê các hoạt động sống hảng
ngảy (ADCS—ADL) tốt hơn giá dược, một tiêu chuẩn thứ 2 để đảnh giá híệu quả. Cảc kết quả về _hiệu
quả là tương tự nhau ở viên nang REMINYL giải phóng kéo dải và viên nén REMINYL được coi
như hoạt chất kiếm chứng trong nghiên cứu nảy.
Tính hiệu quả và an toân dâi hạn (2 năm) trên bệnh nhân mắc bệnh Alzheimer mức độ nhẹ tới
vừa
Nghiên cứu đa trung tâm, nhóm song song, có đối chứng với giả dược, ngẫu nhiên mù đôi đã đảnh
giả tinh an toản vả hìệu quả dải hạn (2 năm) của viên nang giải phóng kéo dải galantamin trong điều
trị cảc bệnh nhân mắc bệnh Alzheimer mức độ nhẹ tới vừa. 1023 bệnh nhân được lựa chọn ngẫu
nhiên trong nhóm gỉả dược, vả 1028 bệnh nhân trong nhóm galantamin. Các đặc điềm nhân khẩu học
và ban đầu là giống nhau giữa cảc nhóm. Đa số bệnh nhân là nữ (65%) và da trắng (99,9%). Độ tuổi
trung vị in 74 tuối, vả điếm MMSE (thang điểm đảng giá tình trạng tâm thần) ban đầu iả 19.
Trong tỉêu chí chính về tính hiệu quả (được xác định như iả sự thay đối điếm MMSE so với ban đầu
tại tháng 24), đã có sự suy giảm nhận thức it hơn một cách đáng kể trong nhóm galantamin so sảnh
với nhóm giả dược trong sự thay đổi điếm MMSE so với ban đầu tại tháng 24 (-1,41 so với 2,14;
p<0,001). Trong tiếu chỉ phụ chủ yếu về tính hiệu quả (được xảo định như sự thay đối trong MMSE
tại tháng 6 và thay đối trong điếm DAD tại thảng 24), đã có sự suy giảm iởn hơn đáng kể trong sự
thay đối điềm MMSE so với ban đẫu tại thảng 6 trong nhỏm galantamin so sảnh với giả dược (trung
bình thay đối của 0,15 so với -0,28; p<0,001) và suy giảm ít hơn đảng kể trong điềm DAD tại tháng
24 trong nhóm galantamỉn so với nhóm giả dược (-8,2 so với —10,8; p=0,002).
Trong tiêu chí chính về tính an toản (tù: vong), đã có tổng số 89 ca tử vong; 56 ca tử vong (5,5%)
trong nhóm giả dược và 33 ca tử vong (3,2%) trong nhóm gniantamin. Điều nảy thế hiện tỷ lệ tử
vong cao hơn đảng kế trong nhóm giả dược so vởi nhóm galantamin [tỷ lệ nguy cơ và 95% khoảng
tin cậy cùa 0,58 (0,37-0,89) (p=0,011)].
Pl_Reminyl_PR 8mg_CCDS 29Apr2014_v1 12116
1!
Rối loạn nhận thức nhẹ (MCI)
Hai thử nghiệm lâm sảng có kiềm soát 2 năm trên đối tượng bệnh nhân rối loạn nhận thức nhẹ (MCI)
đã không đảp ứng được hai tiếu chí chính về tính hiệu quả. Mặc dù tỷ lệ tử vong là thấp (0,7%),
nhiều trường hợp tử vong được ghi nhận ở nhóm galantamin (1311026) hơn so với nhóm giả dược
(111022), nhưng tỷ 1ệ biến cố bất lợi nghiêm trọng là tương đương trên cả hai nhóm điều trị (19%).
Phân tích ITT (intent—to—treat) trong 24 tháng ghi nhận 20 trường hợp tử vong trong nhóm giả dược
so với 34 trường hợp từ vong trong nhóm galantamin (nguy cơ tương đối [95% cu = 1,70 [1,00;
2,90]; p = 0,051. Cảo đổi tượng tử vong trong khoảng thời gian 30 ngảy ngùng thuốc của nghiến cứu
mù đôi theo đề cương, có 14 trường hợp trong nhóm galantamin vả 3 trường hợp trong nhóm giả
dược (nguy cơ tương đối [95% Cl] = 4,08 [],57; 10,57]; p = 0,004). 13 trường hợp tử vong trong
nhóm giả dược và 20 trường hợp trong nhóm galantamin được cho là có liên quan trực tiếp đến cảc
biến cố bất lợi xảy ra trong khi cảc đối tượng nảy bị phơi nhiễm trong nghiên cứu mù đôi (nguy cơ
tương đối [95% cu = 1,54 (0,78; 3,04»; p = 0,218.
Nhiều đối tượng trong nhóm giả được ngừng thuốc trước khi tử vong hơn so với nhóm galantamin,
có thể giải thích nguyên nhân của sự khảc biệt trong tỷ lệ tử vong ghi nhận ban đầu. Khi thu thập dữ
liệu từ tỷ lệ lớn các bệnh nhân trong cả hai nhóm điều trị, bao gồm số lượng bệnh nhân ngừng thuốc
trước khi kết thủc giai đoạn nghiên cứu mù đôi (GAL-COG-3002), tổng 102 trường hợp tử vong, 56
trường hợp trong nhóm galantamin và 46 trường hợp trong nhóm giả dược (nguy cơ tương đối
95%C1) = 1,24 [0,84; 1,83]; p = 0,274).
Cảc trường hợp tử vong nảy là do các nguyên nhân khảo nhau, không chỉ bởi do trên đối tượng bệnh
nhân cao tuổi, mả một nứa trong số nảy iả do nguyên nhân mạch máu trên cả hai nhóm.
ĐẶC TÍNH DƯỢC ĐỘNG HỌC
Hấp thu 1
Sau khi uống ] liếu duy nhất viên nén 8mg galantamin, sự hấp thu xảy ra nhanh chóng với nồng độ
đinh huyết tương là 43 i13 ng1mL, đạt được sau 1,2 giờ vả AUC… trung bình iả 427 1102
ng.giờ1mL. Sinh khả dụng tuyệt đối của galantamin đường uống lả 88,5%. Uống galantamin chung
với thức ăn sẽ lảm giảm tốc độ hấp thu (Cmax giảm khoảng 25%), nhưng không ảnh hưởng đến mức
độ galantamin được hấp thu (AUC).
Sau khi uống liều lặp lại viên nén 12 mg galantamin 2 lẩn/ngảy, trung bình của nồng độ đảy — đinh
dao động giữa 30 vả 90 ng/mL. Dược động học của galantamin tuyến tính trong khoảng liều từ 4-16
mg 2 lần/ngảy.
So sánh sinh khả dụng cũa dạng gỉải phóng tức thì vởi dạng giải phỏng kéo dải
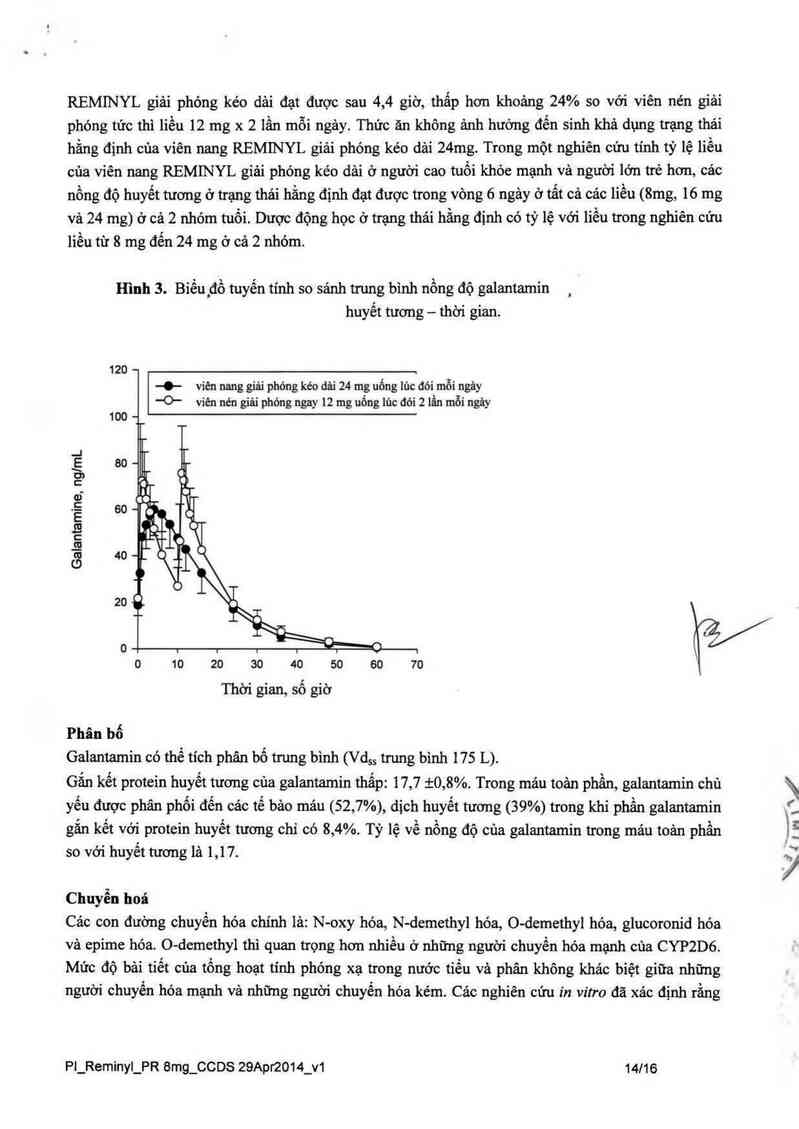
Trong một nghiên cứu sinh khả dụng ở trạng thải hằng định, viên nang REMINYL giải phỏng kéo
dải, 24 mg x 1 lần mỗi ngảy, cho thấy tương đương sinh học với viên nén giải phóng tức thì 12 mg x
2 lần mỗi ngảy về giá trị AUC… vả Cmm Giá trị 0… của liều 24 mg ngảy một lần viên nang
Pl_Reminyl_PR 8mg_CCDS 29Apr014_v1 13116
REMINYL giải phóng kéo dải đạt được sau 4,4 giờ, thẩp hơn khoảng 24% so với viên nén giải
phóng tức thi liều 12 mg x 2 iần mỗi ngảy. Thức ăn không ảnh hưởng đến sinh khả dụng trạng thải
hẳng định của viên nang REMINYL giải phóng kéo dải 24mg. Trong một nghiến cứu tính tỷ lệ lỉểu
cùa viên nang REMINYL giải phóng kéo dải ở người cao tuổi khỏe mạnh và người lớn trẻ hơn, cảc
nồng độ huyết tương ở trạng thải hằng định đạt được trong vòng 6 ngảy ở tất cả các lìếu (8mg, 16 mg
và 24 mg) ở cả 2 nhóm tuổi. Dược động học ở trạng thải hằng định có tỷ lệ với liền trong nghiên cứu
liếư từ 8 mg đến 24 mg ở cả 2 nhóm.
Hình 3. Biếuịđồ tuyến tinh so sánh trung bình nồng độ galantamin
huyết tương — thời gian.
120
+ viẻn nang giải phóng kẻo dải 24 mg uống lủc đói mỗi ngây
“Ô- viên nén giâi phóng ngay 12 mg uống lủc đói 21ần mỗi ngây
_!
E
\
m
:
o“
5
E
8
1:
E
m
0
0 10 20 30 40 50 60 70
Thời gian, số giờ
Phân bố
Galantamin có thể tích phân bố trung bình (Vciss tnmg bình 175 L).
Gắn kết protein huyết tương cùa galantamin thấp: 17,7 i0,8%. Trong mảu toân phần, galantamin chủ
yếu được phân phối đến cảc tế bảo mảu (52,7%), dịch huyết tương (39%) trong khi phần galantamin
gắn kết với protein huyết tương chi có 8,4%. Tỷ lệ về nồng độ cùa galantamin trong máu toản phần
so với huyết tương lả 1,17.
Chuyến hoá
Cảo con đường chuyến hóa chính lả: N-oxy hóa, N-demethyl hóa, O—demethyl hóa, glucoronid hóa
và cpime hóa. O-demcthyl thi quan trọng hơn nhiến 6 những người chuyến hóa mạnh cùa CYP2D6.
Mức độ bải tiết oủa tổng hoạt tính phóng xạ trong nước tiếu và phân không khảo biệt giữa những
người chuyển hóa mạnh vả những người chuyến hóa kém. Cảo nghiên cứu ìn vitro đã xảo định rằng
Pl_Remỉnyl_PR 8mg_CC DS 29Ap12014_v1 14116
\GỂ J `ỈĨAĨỂ "/
cytochrom P450 2D6 vả 3A4 là những iso enzym cytochrom P450 chính tham gia vảo sự chuyển hóa
galantamin.
Trong huyết tương cùa những người chuyến hóa mạnh và kém, dạng galantamin không đổi và cảc
glucoronid cùa nó đại diện cho phần lởn hoạt tính phóng xạ của mẫn. Trong huyết tương oủa những
ngưòi chuyến hóa mạnh, glucoronid oùa O-demethyi- Galantamin thì cũng quan trọng.
Không có chất ohuyển hỏa có hoạt tính nảo của galantamin (nor galantamin, O-desmethylgalantamin
vả O-dcsmethyl-norgalantamin) được phảt hiện dưới dạng không kết hợp trong huyết tương của
những người ohuyển hóa mạnh và chuyến hóa kém sau 1 liều duy nhất. Norgalantamin có thế được
phảt hiện trong huyết tương ở những bệnh nhân sau khi sử đụng nhiều lần, nhưng không vượt quá
10% nồng độ galantamin.
Thải trừ
Galantamin lá thuốc có độ thanh thải thấp (độ thanh thải huyết ttttmg vảo khoảng 300 mL/phút). Thải
trừ cùa galantamin theo hảm số mũ bặc 2, với thời gìan bán thải tận cùng khoảng 7—8 giờ.
7 ngảy sau khi uống 1 liều duy nhắt 4 mg 3H-galantamin, 90-97% hoạt tính phóng xạ được tim thấy
trong nước tỉếu vả 2,2-6,3% trong phân. Sau khi tiêm tĩnh mạch hoặc uống, 18-22% liến dùng được
bải tiểt qua nước tiếu dưới dạng galantamìn không đổi trong vòng 24 giờ, với thanh thải qua thận
khoảng 65 mL/phút, tương đương với 20-25% tồng lượng thanh thải huyết tương.
Dân số đặc biệt ( /
Suy thận '
Sự phân bố của gaiantamin dược nghiến cứu trên những người trẻ oó chức năng thận khác nhau. Thải
trừ của galantamin giảm cùng với sự giảm thanh thải oreatinin. Nồng độ galantamin trong huyết
tương gia tăng 38% ở những người suy chức năng thận trung bình (độ thanh thải oroatinỉn = 52-104
mL/phủt) và tăng 67% ở những người suy thận nặng (độ thanh thải creatinin = 9-51 lephút) so với
những người khoẻ mạnh cùng độ tuối và cân nặng (độ thanh thải creatinin 2 121 mL/phút). Phân tích
vả mô phỏng dược động học trên dân số thống kê oho thấy rằng không oần điếu chinh liếu ở những
bệnh nhân Alzheimer có suy thặn miễn là độ thanh thải creatinin tối thiếu là 9 mL/phút (xem phần
Liều dùng và cách dùng — Dán số đặc biệt) bời vì thanh thải của gaiantamin thẳp hơn ớ những bệnh
nhân Alzheimer.
Suy gan
Dược động học cùa galantamin ở những người suy chức năng gan nhẹ (thang điếm Chíld-Pugh 5-6)
thì tương tự như ở người khoẻ mạnh. Ở những bệnh nhân bị suy chức năng gan trung binh (thang
điếm Child-Pugh 7-9), AUC và thời gian bản thải oủa galantamin tăng khoảng 30% (xem phần Liều
dùng và cách dùng— Dân số đặc biệt).
Đặc điếm trên bệnh nhân Alzheimer
Dữ liệu từ oác thử nghiệm lâm sảng trên bệnh nhân cho rằng nồng độ galnntamin trong huyết tương
ở những bệnh nhân Alzheimer cao hơn 30—40% so với người trẻ khoẻ mạnh.
PI_Reminyl_PR 8mg_CC DS 29Ap12014_v1 15116
THÔNG TIN TIỀN LÃM SÀNG
Tất cả cảc dữ liệu an toân tiền lâm sảng khảo liên quan đến việc kế toa đều có trong các mục tương
ứng.
TỈNH TƯỢNG KY
Không có.
HẠN DÙNG _
24 thảng kể từ ngảy sản xuất cho tất cả cảc vùng khí hậu.
Không dùng thuốc đã quá hạn sử dụng ghi trên nhãn.
ĐIỀU KIỆN BẢO QUẢN
Bảo quản ở nhiệt độ không quá 30°C.
Đế xa tầm nhìn và tầm tay trẻ em.
QUY CÁCH ĐÓNG GÓI
Viên nang giải phóng kéo dâi 8mg: được đóng gói trong vi PVC-PE-PVDC/nhôm chứa 7 viên. Cảo
vỉ được đóng trong hộp giấy carton. Mỗi hộp chứa 4 vi.
NHÀ MÁY SÁN XUẤT
Sản xuất bán thảnh phấm cảc hạt thuốc giải phóng kéo dải tại: /
Janssen Pharmaceutica NV , Lammerdries 55, Oien, B-2250, Bỉ.
Kiếm nghiệm, xuất xưởng các hạt thuốc gỉải phóng kéo dải tại:
Janssen Pharmaceutỉca NV, Tumhoutseweg 30, Beerse, B-2340, Bỉ.
Đóng nang, đóng gói sơ cấp và thứ cấp, kiếm nghiệm vả xuất xưởng lô thảnh phẩm tại:
Janssen-Cilag S.p.A., Via C. Janssen (loc. Borgo S. Michele)- 04100 Latina - Ý
Công ty đăng kỷ: JANSSEN-CILAG Ltd., Thái Lan
Mọi câu hỏilBảo oáo tác dụng ngoại ý] Than phiền ohất lượng sản phẩm xỉn liên hệ:
VPĐD Jansscn-Ciiag Ltd., TP Hồ Chí Minh.
ĐT: +84 8 38214828
E-mail: iacvndruesafetv@itsịnị.com
Phiên bản: C CDS 29Apr2014, version 011
PI_Reminyl_PR 8mg_CCDS 29Apr2014_v1
Ngảy sửa đồi: 02/06/2015
Q. C_ỤC TRUỦNG
P.TRLbei DiifNG
—/1Ể1111131017(111 71"
J % / ' ””ý
Pl_Remỉnyl_PR 8mg_CCDS 29Apr2014_v1 16116
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng