












Each tablet contains: Keep out d ruach of chian '
Telmisartan 80mg Piease read carefull the 1…
. Hydrod:lorothiazido 12.5…0 paper hefore use. y
Indication, oontraìndioation, dosage and
Adninlstrution. sido-elfects:
Please see me mn paper" ỂASANdJỄỀtỄiỂL/E'inhễẫnlỉgrlẩ
Storage: Store at mom temperatưe belt… 30°C.
gỗ Prdm fmm "ghì and humuity' Ễ:ẹrỵasahư Dog-ỄmỀỀỄn—èio L m Ẹ
ĐA PHE DUYẸTm“WUI SBlistersxitlTab
lần đẩu' ổ *" °2.« Í.Ả.£Ẹ ...:mử Wu: mmg Đồ UWỔc nnơằi tẩm tay ừẻ em
4 … …… … HWf°diơdfidde 12,5m Đọc kỹ hưởng dẩn sử dụng ưưởc khl dùng
Ễ'ễiẵ'ẵỀm ỂỄỄẮỄỈỂẺỂ' “ … .….. Packed byJĐónu nỏi bởi:
PHARMAKING CO., LTD
Xem tò hướng dấn sử dung dLo đầy dù mm in muót.
_ 363 Ogung—ri Gamgok—myeon. Eumsung-gun,
BỔ° quử² Ở "“… “ phm dW wc- W" M Sửg Và “ Ẩm Chungchengbuk—do. 369-852 Korea (Hèn Quôc )
Tiiuchuẩn:USP 34. JẸIỉJ"
, ".Jhi
ĨỸfể
& Thuoc ban theo đơn
Pretension plus sonz.smg.
s; cớnc Lv \
o, , rncumeunmẾ
* 1HUÚNGMAIHÔiCHVU 1² 1
ÁNHSANG '
Telmisartan 80mg
Hydrochlorothiazide 12.5 mg
UBỤBSỊLLI|3_L
-6… swos sn|d UOỊSUGỊGJd
6… su apizemiomluompm
6…os
QJiẵffll~ Dasan medichem Co.,Ltd.
3V1x10Wên
ẵ Pretension plus 80|12.5mg. Pretension plus 80I12.5mg. Pretension pius 80I12.5mg.
Tuuiunu Im h…n m m- n….
WIW 115n Wth 121q Wh ium
W ỰNG 00. m _ ị
'— 0 < L. .~v.'c . ~ -— 3 l. . :
EM. .::.:s: “ W……… W .:.ưzzffl ,
plus 80112.5mg. Pretension plus 80/12.5mg. Pretension pius 80/12.5mg. Pretensi
_ lùng 'I'ubhlhn m Vu… Uno
uthbn illmg W |zlu Whhlhh 1L\n
: " …». ›… ur
z.'ủt… .::mcw- ………:sẹm Lm-
Pretension plus BOI12.5mg. Pretension plus 80112.5mg. Pretension pius 80|12.5m
%… m 1… M h…n “
m……tum Mu…íllmg Wíum
—. … M: …b
A:… nt-IhưuĨr. uc. MWGCO.JIE ìLu~ 'mnnt Ca . J,
mu ffl Kn— (Hht M] u. pu. @
Pbs 80112.5mg. Pmtension pius 40112.5mg. Pretension plus 80112.5mg. Pretensi pi i : ’
n hu hu… IM Tnbnhm IM … ' /Cặế
uutmua 1Iẵln m…… il!m W… tsz /
Rx lhuổc bán lheo đơn
PRETENSION PLUS
(Viên nén TELMISARTAN vả HYDROCLOROTHIAZID
40/12.5mg, 80/12.5mg)
THÀNH PHÂN:
Mỗi viên Pretension Plus 40/12.5mg chứa:
Hoạt chẩt: Teimisartan 40 mg
Hydroclorothiazid 12,5mg
Tá dược: D-sorbitol, meglumin, povidon (PVP K-30), natri hydroxid, magnesi stearat, isomait, lactose khan, natri bicarbonat,
acid citrỉc khan, sắt oxid (đỏ).
Mỗi viên Pretension Plus 80l12.5mg chứa:
Hoạt chất: Telmisattan 80 mg
Hydrociorothiazid 12,5mg
Tá dược: D-sorbitoi, meglumin, povidon (PVP K-30), natri hydroxid, magnesi stearat, isomalt, lactose khan, natri bicarbonat,
acid citrỉc khan, sắt oxid (đỏ).
DƯỢC LỰC HỌC
Hydroclorothiazid:
Hydrociorothiazid vả các thuốc lợi tiều thiazid iảm tăng bải tìết natri ciorid vả nước kèm theo do cơ chế ức chế tải hấp thu
các ion natri và clorid ở ống lượn xa. Sự bải tỉết cảc chất điện giải khác cũng tăng đặc biệt là kali vả magnesi, còn calci thì
giảm.
Hydroclorothiazid cũng lảm giảm hoạt tính carbonic anhydrase nên lảm tăng bải tiết bicarbonat nhưng tác dụng nảy thường
nhỏ so với tảo dụng bải tiết cr và không lảm thay đổi đảng kể pH nước tiểu. Các thiazid có tác dựng lợi tiểu mức độ vừa
phải, vì khoảng 90% ion natri đã được tái hấp thu trước khi đến ống lượn xa iả vị trí chủ yếu thuốc có tảo dụng.
Hydroclorothiazỉd có tác dụng hạ huyết áp, trước tiên có 1ẽ do giảm thề tich huyết tương và dịch ngoải bảo iiên quan đến sự
bải tiết natri. Sau đó trong quá trình dùng thuốc, tảc dụng hạ huyết ảp tuỳ thuộc vảo sự giảm sức cản ngoại vi, thông qua sự
thích nghi dần của các mạch máu trước tình trạng giảm nồng độ Na+. Vì vậy, tác dụng hạ huyết áp cùa hydroclorothiazid thế
hiện chậm sau 1-2 tuần, còn tảo dụng lợi tiều xảy ra nhanh có thể thấy ngay sau vải giờ. Hydroclorothiazid lảm tăng tảo dụng
cùa các thuốc hạ huyết ảp khác.
Telmisartan
Tennisartan lả một chắt đối kháng đặc hiệu của thụ thể angiotensin 11 (týp ATL) ở cơ trơn thảnh mạch và tuyến thượng thặn.
Trong hệ thống renin—angiotensin, angiotensin 11 đựơc tạo thânh tù angiotensin 1 nhờ xúc tác của enzynm chưyến angiotensin |
(ACE). Angiotensin 11 là chắt gây co mạch, kích thích vỏ thượng thận tổng hợp và giải phóng aldosteron, kích thích tim.
Aldosteron iảm giảm bải tiết natri và tăng bải tiết kaii ở thận.
Telmisartan ngăn cản gắn chủ yếu angiotensin II vảo thụ thể ATI ở cở trơn mạch máu và tuyến thượng thận, gây giãn mạch
và giảm tác dụng cùa aldosteron. Thự thế AT; cũng tìm thấy ở nhiều mô, nhưng không rõ thụ thể nảy có iiên quan gì đến sự \
ổn định tim mạch hay không. Teimisartan có ái lực mạnh với thụ thể ATI, gấp 3000 lẩn so với thụ thể ATz
Không giống như các thuốc ức chế men chuyến angiotensin-nhớm thuốc được dùng rộng rãi để điều trị tăng huyết ảp, cảc
chất đối khảng thụ thể angiotensin 11 không ức chế giáng hoá bradykinin, do đó không gây ho khan dai dẳng - một tảc dụng
không mong muốn thường gặp khi điếu trị bắng các thuốc ức chế ACE. Vì vậy các ohất đối khảng thụ thể angiotensin II được
dùng cho những ngưới phải ngừng sử dụng thuốc ức chế ACE vì ho dai dằng.
Ở người, 1iếu 80mg telmisartan ức chế hầu như hoản toản tăng huyết ảp do angiotensin 11. Tác dụng ức chế (hạ huyết ảp)
được duy tri trong 24 giờ và vẫn oòn đo được 48 gỉờ sau khi uống. Sau khi uống liều đầu tiên, tác dụng giảm huyết áp biểu
@
hiện từ từ trong vòng 3 giờ đầu. Thông thường, huyết áp động mạch giảm tối đa đạt đựợc 4-8 tuần sau khi bắt đầu điều trị.
Tác dụng kéo dải khi điều trị lâu dải. Ở người tăng huyết áp, Telmìsartan iảm giảm huyết áp tâm thu vả tâm trương mà không
thay đổi tần số tim. Tảo dụng chống tăng huyết ảp oủa telmiseưtan cũng tương đương với cảc thuốc chống tăng huyết áp loại
khảo.
Khi ngừng điều trị telmisartan đột ngột, huyết áp trở lại dần dần trong vải ngảy như khi ohưa đỉều trị, nhưng không có hiện
tượng tãng mạnh trở lại.
DƯỢC ĐỌNG HỌC
Hydroclorothiazid:
Sau khi uống, hyđroclorothiazid hấp thu tương đối nhanh, khoảng 65-75% liều sử dụng, tuy nhiên tỳ 1ệ nảy có thể giảm ở
người suy tim. Hydroclorothiazid tich luỹ trong hồng cẩu. Thuốc thải trừ chủ yếu qua thận, phần lớn dưới đạng không chuyến
hoả. Nửa đời oùa hydroclorothiazid khoảng 9,5 — 13 giờ, nhưng có thể kéo dải trong trường hợp suy thận nên cần điều chinh
liều. Hydrociorothiazid đi qua hảng rảo nhau thai, phân bố và dạt nổng độ cao trong thai nhi.
Tảo dụng lợi tiểu xuất hiện sau khi uống 2 giờ, đạt tối đa sau 4 giờ và kéo dải khoảng 12 giờ.
Tác dụng chống tăng huyết áp xảy ra chậm hơn tác dụng lợi tiều nhìếu vả chi có thể đạt được tác dụng đầy đủ sau 2 tuần,
ngay cả với liếư tối ưu giữa 12,5 -25 mg/ngảy. Điều quan trỌng cần biết là tảo dụng chống tăng huyết áp của
hydroclorothiazid thường đạt được tối ưu ở liều 12,5 mg (nửa viên 25mg) Các hướng dẫn điểu trị và thử nghiệm lâm sảng
hiện đại đều nhấn mạnh cần sử dụng liếư thấp nhất và tối ưu, điều đó ]ảm giảm được nguy cơ tảo dụng có hại. Vấn đề quan
trọng 1ả phải chờ đủ thời gian để đánh gìá sự đáp ứng của cơ thể đối với tác dụng hạ huyết ảp của hydroclorothiazid, vi tảc
dụng trên sức cản ngoại vì cần phải có thời gỉan mới thể hiện rõ.
Teimisartan:
Telmisartan được hẩp thu nhanh qua đường tiêu hoá. Sinh khả đụng tuyệt đối đường uống phụ thuộc liều dùng: Khoảng 42%
sau khi uống iiếu 40mg và 58% sau khi uống liều lóOmg. Sự có mặt cùa thức ăn1ảm giảm nhẹ sinh khả. dụng cùa telmisartan
(giảm khoảng 6% khi dùng liều 40mg). Sau khi uống, nồng độ thuốc cao nhất trong huyết tương đạt được sau 0,5 -1 giờ.
Hơn 99% telmisartan gắn vảo protein huyết tương chủ yếu vảo albumin vả ợL—acid glycoprotein. Sự gắn vảo protein 1ả hằng
định, không bị ảnh hưởng bới sự thay đổi liếu. Thế tich phân bổ khoảng 500 iit.
Sau khi tiêm tĩnh mạch hoặc uổng teimisartan, hầu hết liều đã cho (hơn 97%) được thải trừ dưới dạng không đối theo đường
mật vảo phân, chi lượng rất ít (dưới 1%) thải qua nước tiếu. Nửa đời thải trừ cùa teimisartan khoảng 24 giờ, tỳ 1ệ đáy đỉnh
của telmisartan vảo khoảng 15-20%. Telmisartan dược chuyến hoá thảnh dạng liên hợp acylglucuronid không hoạt tinh, duy
nhất thẩy trong huyết tương và nước tiểu. Uống telmisartan với lỉều khuyến cáo không gây tich Iuỹ đáng kể về iâm sảng.
Dược động học cùa teimỉsartan ở trẻ em dưới 18 tuổi chưa được nghiên cứu. Không có sự khảo nhau về dược động học ở
người cao tuối và người dưới 65 tuổi. Nồng độ telmisartan trong huyết tương ở nữ thường cao hơn ở nam 2-3 iẩn, nhưng
không thắy tăng có ý nghĩa về đáp ưng huyết ảp hoặc hạ huyết áp thế đứng ở nữ. Do vậy không cần điều chinh lỉểu.
Suy thận nhẹ và trung bình: Không cẩn phải điều chinh liều. Lọc máu không có tác dụng thải trừ teimisaftan.
Suy gan: Nồng độ teimisartan trong máu tăng vả sinh khả dụng tuyệt đối đạt gần 100%.
CHỈ ĐỊNH:
Pretension Pius được chỉ định đề điếu trị cao huyết ảp.
Dạng kết hợp nảy không được chỉ định cho trị liệu ban đầu (xem phần Liều lượng vả cảch dùng)
LIÊU LƯỢNG VÀ cÁcn DÙNG:
Trị iiệu thay thế
Dạng kết hợp nảy có thế được thay thế cho những thảnh phần đã được chuẩn độ.
Chuẩn liễu theo hiệu quả lâm sảng:
Viên Pretension Plus là viên chứa cả teimisanan 40mg vả hydroclorothiazid 12,5mg; h0ặc telmisartan 80mg vả
hydroclorothiazid 12,5mg. Một bệnh nhân mà huyết ảp không kiểm soát đầy đủ với trị liệu đơn độc telmisartan 80mg có thể
được chuyến sang viên Pretension Plus chứa teimisartan 80mg vả hydroclorothiazid 12,5mg một lần mỗi ngảy, và cuối cùng
tăng iiều tới 160/25mg, nểu cần.
Bệnh nhân mà huyết ảp không kiểm soát đầy đủ với 25mg một iần mỗi ngảy với hydroclorothiazid có thể chuyến sang viên
teimisartan vả hydroclorothiazid (teimisartan 80mg/hydroclorothiazid 12,5mg), ngảy 1 lần. Sự đảp ứng iâm sảng với viên
teimisanan vả hydroclorothiazid nên được đánh giả và nếu huyết áp vẫn không được kiềm soát sau 2-4 tuần trị lỉệu, liền có
thể điều ohỉnh tới 160/25mg nếu cần. Những bệnh nhân được kiềm soát bởi 25mg hydroclorothiazid nhưng 1ại bị hạ kali
huyết với chế độ iiều nảy, có thế được chuyển sang viên telmisartan vả hydroclorothiazid (telmisartan
80mg/hydroclorothiazid 12,5mg), một iần mỗi ngảy, gíảm liều hydroclorothiazid mà không giảm sự đảp ứng hạ huyết ảp
mong đợi.
Bệnh nhân suy thận:
Chế độ liều thông thường với viên telmisartan vả hydroclorothiazid cho bệnh nhân có độ thanh thải creatinine > 30mL/phút.
Ở bệnh nhân suy thận nặng, lợi tiếu quai thích hợp hơn thiazid bới vậy Viên teimisartan vả hydroclorothiazid không được
khuyến cảo.
Bệnh nhân suy gan:
Viên telmisartan vả hydroclorothiazid không được khuyến cảo cho bệnh nhân suy gan nặng. Bệnh nhân bị rối loạn tắc mật
hoặc suy gan nên có trị liệu được bắt đầu dưới sự kiếm soát chặt chẽ cùa y tế với liếư kết hợp 40/12,5 (xem phần Thận trợng).
CHỐNG CHỈ ĐỊNH:
Viên telmisartan vả hydroclorothiazid được chống ohi định ở bệnh nhân mẫn cảm với bẩt kỳ thảnh phần nâo cùa thuốc
Vì thuốc có thảnh phần hydroclorothiazid nên được chống chỉ định ở bệnh nhân bí tiểu hoặc mẫn cảm với dẫn xuất
sulfonamide khác.
Phụ nữ có thai (3 tháng giữa vả cuối thai kỳ); suy gan nặng, suy thận (<30mlphút).
CẢNH BÁO
Tỷ lệ tửvong và tỷ lệ mắc bệnh của trẻ sơ sinh và thai nhi:
Thưốc hoạt động trực tiểp trên hệ rennin-angiotensin có thể gây mắc bệnh và tử vong ở trẻ sơ sinh vả thai nhi khi sử dụng cho
phụ nữ mang thai. Một vải chục trường hợp đã được bảo các trong các tải iiệu thế gíới ở bệnh nhân đang dùng thuốc ức chế
men chuyền. Khi phảt hiện mang thai, ngừng sử dựng teimisartan vả hydroclorothiazid ngay khi oó thế.
Sử dụng thuốc mà hoạt động trực tỉếp trên hệ rennin-angiotensin trong suốt kỳ thứ 2 vả 3 cùa thai kỳ được cho là 1iên quan
tới những tốn thương của thai nhi và trẻ sơ sinh, gồm hạ ảp, giảm sản xương sọ trẻ sơ sinh, bi tiểu, suy thận có phục hồi hoặc
không phục hồi và tử vong. Ít nước ối cũng đã được báo cáo, có lẽ là kết quả giảm chức năng thặn của thai nhi; it nước ối
trong trường hợp nảy cũng được cho 1ả liên quan tới sự co rút chân tay của thai nhi, sự biến dạng cùa sợ và mặt, giảm sự phát
triến cùa phồi.
Sinh non, chậm phảt triến trong tử cung, và ống động mạch cũng đã được bảo các mặc dù không rõ liệu những triệu chứng
nảy có phải là do phơi nhíễm với thuốc.
Đổi với kỳ thứ nhẩt cùa thai kỳ, những tảo dụng phụ nảy không xuất hiện do sự phơi nhiễm của thuốc trong tử cung nhưng sự
phơi nhiễm nảy cũng nên được hạn chế. Người mẹ có phôi thai vả bảo thai được phơi nhiễm với chẳt đối kháng thụ thể
angiotensin 11 trong suốt kỳ đầu của thai kỳ nên được thông bảo. Tuy nhiên, khi bệnh nhân mang thai, bảo sỹ nên ngừng sử
dụng telmisartan vả hydroclorothiazid ngay tức thời.
@
Hiểm (có lẽ dưới m,ooo phụ nữ mang thai), sẽ không tìm thắy chất thay thể chất đối kháng thụ thể angiotensin 11. Trong
những trường hợp hiếm nảy, người mẹ nên được thông bảo về các nguy hại tiềm tảng đối với thai nhi cùa họ, và kiểm tra
bằng siêu âm liên tth đế đảnh giá môi trường nước ối.
Nếu quan sát thấy thiếu nước ối, Viên telmisartan vả hydroclorothiazid nên được ngừng trừ khi thuốc được xem là sự sống
còn đối với người mẹ. Kiếm tra cử động cùa thai nhi (CST), đo sức khỏe thai nhi (NST) hoặc trắc nghiệm sinh học (BPP) có
thể 1ả thich hợp, phụ thuộc vảo tuần cùa thai nhi. Bệnh nhân vả bảo sỹ nên lưu ý, mặc dù, thiểu ối có thể không xuất hiện cho
tới sau khi thai nhi đã có những tốn thương không hồi phục được.
Trẻ sơ sinh với tiến sứ phơi nhiễm tử cung vởi ohất đối kháng thụ thể angiotensin 11 nên được kiếm soát chặt chẽ về hạ áp,
thiểu niệu, tăng kali huyết. Nếu thiếu niệu xuất hiện, chủ ý cảc biện phảp hỗ trợ về huyết áp và tưới máu thận. Thay mảư hoặc
thẩm tảch có thể được yêu cầu như 1â một biện pháp đề đảo ngược hạ ảp vả/hoặc thay thế đối với chức năng thận bị rối loạn.
Một nghiên cứu độc tính tiến triến đã được thực hiện trên chuột nhắt với telmisartan/hydroclorothiazid ở liều 3,2/1.0; 15/4,7;
50/ 15,6; vả 0l15,6 mglkglngảy. Mặc dù dạng kết hợp ở liếư cao gấp đôi xuất hiện độc tố nhiều hơn (giảm sự tăng trọng lượng
đáng kề) đối với việc sử dụng từng thuốc, nhưng không thấy sự tăng độc tính đối với sự phát triền cùa phôi.
Không quan sát thấy tác dụng gây quải thai khi telmisartan được sử dụng cho chuột nhắt mang thai ớ 1iếu uống tới
50mg/kg/ngảy vả thỏ mang thai ớ liếư uống tới 4Smg/kg/ngảy. Ở thỏ, phôi thai chết liên quan tới độc tinh cùa thỏ mẹ (bị
giảm sự tãng trọng lượng cơ thế và sự tiêu hao dinh đường) đã được quan sảt ở liều 45mg/kg/ngây [khoảng 12 lần liếu 80mg
lả khuyến cảo tổi đa ở người (MRHD) dựa trên cơ sở mglm²l.
Trên chuột nhắt, liều telmisartan gây độc tinh chuột mẹ (giảm sự tăng trọng lượng cơ thể và sự tiêu hao năng lượng) 121
15mg/kg/ngảy (khoảng 1,9 lần iiều khuyến cáo tối đa ớ người (MRHD) dựa trên cơ sớ mg/m²), sử dụng thuốc trong thời kỳ
thai kỳ muộn và cho con bú, đã quan sảt thẳy cảc tác đụng phụ trên trẻ sơ sinh gồm giảm khả năng sống sót, cân nặng khi
sinh thấp, chậm trướng thảnh và giảm sự tăng cân. Đã thấy telmisartan trong thai nhi chuột trong suốt thai kỳ muộn và trong
sữa mẹ. Không quan sát thấy tác dụng của độc tính tiến triển trên chuột nhắt và thỏ ở liều tương ứng 5 và lSmg/kg/ngảy,
khoảng 0,64 và 3,7 lần dựa trên mg/m2 so với liếư khuyến cáo tối đa trên người cùa telmisartan (80mg/ngảy).
Các nghiên cửu trên hydroclorothiazid đã được tiến hảnh với chuột đổng và chuột nhắt mang thai trong giai đoạn phát sinh cơ …
quan chủ yếu ở liểu tương ứng tới 3000 và 1000mg/kg/ngảy, cho thấy không có bằng chứng về tốn thương với thai nhi.
Thiazid qua được hảng rảo nhau thai và xuất hiện trong máu dây rốn. Bảo thai hoặc trẻ sơ sinh có nguy cơ vảng da, giảm tiểu '
cầu, và các phân ứng bẩt iợi khảo đã xuất hiện ở người lớn.
Hạ huyết áp ở bệnh nhân giãm thể tích:
Bắt đầu trị iiệu chống tăng huyết áp ở bệnh nhân mả hệ rennin-angiotensin được kich hoạt như bệnh nhân bị hạ natri hoặc hạ
thể tích nội mạch, ví dụ bệnh nhân được trị liệu với thuốc lợi tiều mạnh, nên được sử dụng một cảch thận trọng. Những t1nh
trạng nảy nên được điều chinh trước khi sử dụng viên telmisartan vả hydroclorothiazid. Trị liệu nên được bắt đầu dưới sự
giám sảt chặt chẽ cùa bác sỹ (xem Liều lượng và Cảch dùng). Nếu hạ áp xuất híện, bệnh nhân nên đặt trong tư thế nằm ngừa
vả, nếu cần thiết, truyền tĩnh mạch nước muối sinh lý. Không chống chỉ định tiếp tục sử dụng khi có sự hạ ảp thoảng qua,
những trường hợp nảy thường có thể tiếp tục trị iiệu mả không có khó khản gi một khi huyết áp được ổn định.
Hyd roclorothiazid :
Suy gan: Thuốc lợi tiều thiazid nên được sử dụng thận trọng ở bệnh nhân bị suy chức năng gan hoặc bệnh gan tiến triển, vì
sự thay đối nhớ về sự cân bằng điện giải và thể dịch có thể dẫn tới hôn mê gan.
Z
/
Phản ứng mẫn cám: Phản ứng mẫn cảm đối với hydroclorothiazid có thể xuất hiện ở bệnh nhân có hoặc không có tiến sứ đi
ứng hoặc hen phế quản, những phổ biến hơn ở bệnh nhân có tiến sử như vậy.
Lupus ban đỏ hệ thống: Thuốc iợi tiếu thiazide được báo cáo là gây trấm trọng hợn hoặc kich hoạt lupus ban đỏ hệ thống.
Tương tác lithi: Nói ohung không nên dùng lithi với thiazid (xem phần Thận trọng, Tương tác thuốc, hydroclorothiazid,
lithi).
Cận thị cấp và glaucom góc đóng thứ phát: Hydrociorothiazid, một sulfonamid, oó thể gây phản ứng đặc ứng, đẫn tới cận
thị thoáng qua cẳp tinh và giaucoma góc đóng cấp. Triệu chứng gồm sự khời phảt cẩp tinh của giảm thị lực hoặc đau mắt và
điển hình xuất hiện trong vòng vải giờ tới vải tuần sau khi bắt đầu trị iiệu. Không trị iiệu glaucoma góc đóng có thể dẫn tới
mất thị lực vĩnh vỉễn. Trị liệu chủ yếu là ngừng sử dụng hyđroclorothiazid cảng nhanh cảng tốt. Vỉệc sẵn sảng trị iiệu bằng
phẫu thuật hoặc thuốc có thế cần được xem xét nếu nhãn áp không kiểm soát được. Nhân tố nguy oơ đối với sự phát triến cùa
giaucoma góc đớng cấp tính có thể gồm người có tiển sứ dị ứng với sulfonamid hoặc penicillin.
THẬN TRỌNG
Các chất điện giải huyết thanh:
Telmisartan vù hydroclorothiazid:
Trong các cuộc thử nghiệm có kiếm soát sử dụng trị liệu kết hợp telmisartan/hydroclorothiazid, không có bệnh nhân nảo sử
dụng iiều 40/12,5mg; 80/12,5mg hoặc 80/25mg có sự giảm kali 2 1,4 mEq/L, và không có bệnh nhân nảo bị tăng ka1i huyết.
Không ngừng sử dụng thuốc vi lý do hạ kaii huyết xuất hiện trong quá trình sư dụng dạng kết hợp
telmisartarưhydroclorothiazid. Sự vắng dẳu hiện thay đối nồng độ ka1i huyết thanh có thế lả do cơ chế đối nghịch hoạt động
cùa teimisartan vả hydroclorothiazid trên sự bải tiết cùa kali ờ thận.
Hydroclorothỉazỉd:
Đinh kỳ xảo định cảc chất điện giải huyết thanh đề phảt hiện sự mất cân bằng chất điện giải có thể nên được thực hiện ở các
khoảng thời gían thich hợp. Tất cả cảc bệnh nhân dùng trị liệu thiazid nên được theo dõi cảc dấu hiện lâm sảng cùa sự mất
cân bằng điện giải: hạ natri, hạ ciorua huyết, nhiễm kiềm vả hạ kali huyết. Xác định cảc chất điện giải trong nước tiếu vả
huyết thanh lả đặc biệt quan trọng khi bệnh nhân nôn mừa quá mức hoặc truyền thể dịch. Cảo đấu hiệu và triệu chứng cảnh
bảo oùa mất cân bằng thể dịch vả điện giải, không phân biệt nguyên nhân, gổm khô miệng, khảt, yếu, thờ ơ, buồn ngủ, bồn
ohồn, iú lẫn, co giật, đau cơ hoặc chuột rút, mỏi cơ, hạ áp, giảm niệu, nhịp tim nhanh vả rối loạn tiêu hóa như buồn nôn vả
non.
Sự can thiệp với việc uống đủ chất điện giải cũng sẽ góp phần hạ kali huyết. Hạ kali huyết có thể gây loạn nhịp tim và cũng
có thế lảm dễ nhạy cảm hoặc lảm tăng quá mức sự đáp ứng cùa tim đối với oác phản ứng độc hại cùa digitalis (Ví dụ, iảm
tăng sự kích thich tâm thất ).
Mặc dù, sự thiếu hụt clorid ở thế nhẹ và thường không cần điều trị đặc biệt, ngoại trừ trong trường hợp đặc biệt đưới đây
(như trong trường hợp người bị bệnh gian hoặc bệnh thận), sự thay thế clorid có thể được yêu cấu trong trị liệu nhiễm kiểm
ohuyển hóa.
Hạ natri-huyết có thể xảy ra ở những bệnh nhân bị phủ trong thời tiết nóng, trị liệu thích hợp là hạn chế nước chứ không phải
kiềm soát muối, ngoại trừ một số truờng hợp hiếm khi hạ natri huyết có đe doạ đến tinh mạng. Trong thực tế mất muối, biện
phảp thay thể thích hợp là iiệu pháp lựa chỌn.
Tăng acid Lưic huyết có thể xảy ra hoặc gout ở một số bệnh nhân đang đùng trị liệu thiazid.
Đối với các bệnh nhân đái thảo đường điều chinh 1iều cùa insulin hoặc thuốc hạ glucoza huyết đường uống có thể được yêu
cầu.
/ễé
n\IỈ-…t b 2 .'…ả`
Tảng glucoza huyết có thể xảy ra với thuốc lợi tiểu thiazid. Vì vậy, đải tháo đường tiềm ẩn có thể xảy ra trong khi trị liệu
thiazid.
Tảo dụng khảng tảng huyết ảp cùa thưốc có thể tăng iên ở bệnh nhân sau khi cắt bỏ thần kinh giao cảm.
Nếu suy thận trở1ên tiển triển rõ rảng cần xem xc't tiếp tục hay ngưng trị liệu thuốc iợi tiếu.
Thiazid đă được biểt lảm tăng sự bải tiết magiê trong nước tiếu, điếu nảy có thể dẫn đến hạ magiê huyết.
Thiazid có thể lảm giảm sự bải tiễt oalci trong nước tỉềư. Thiazid có thể gây ra sự tăng calci hưyết nhẹ hoặc tăng không 1iên
tực trong trường hợp không có cảc rối ioạn cúa chuyến hóa oaici. Tăng caici huyết rõ rệt có thế iâ đấu hiệu của tăng năng
tuyến cặn giáp bị che dấu. Thiazid cần ngưng điều trị trước khi tiến hảnh kiểm tra chửc năng tuyển cận giảp.
Tăng hảm lượng choiesteroi vả triglycerid có thế liên quan đến trị iiệu với thuốc lợi tiều thiazid.
Suy giãm chửi: năng gan
Telmisartan
Vì teimisartan chủ yếu được thải trừ bởi sự bải tiết mật, bệnh nhân bị rối loạn tắc nghẽn mật hoặc suy gan có thế bị giảm độ
thanh thải của thuốc. Do đó viên teimisartan vả hydroclorothiazid nến được sử dụng thận trọng ở những bệnh nhân nây.
Suy chức năng thặn
Telmz'sartan
Thay đổi chức năng thận như là một kết quả cùa sự ức chế hệ rcnnin-angiotensin-aidosteron có thế được đoản trước ở một vải
bệnh nhân nhạy cảm. Ở bệnh nhân mà có chức năng thận có thể phụ thuộc vảo sự hoạt động của hệ rennin-angiotensin—
aldosteron (ví dụ bệnh nhân suy tim sung huyết nặng), trị liệu với chẩt ức chế men chuyến angiotensin vả thuốc ức chế thụ
thể angiotensin có thể liên quan với thiểu nỉệu vả/hoặc ure huyết tiến triến vả (hiếm) với suy thận cắp vảfhoặc tử vong. Kết
quả tương tự có thế được đoản trước ở bệnh nhân trị iiệu với telmisartan.
Trong cảc nghiên cửu câc chất ừc chế ACE ở bệnh nhân bị hẹp động mạch thận một bên hoặc hai bên, sự tăng creatinin huyết
thanh hoặc ure nitrogen máu đã được quan sát. Chưa sử dụng kéo dải telmisartan ở bệnh nhân bị hẹp động mạch thận một
bẽn hoặc hai bẽn nhưng tác dụng phụ tương tự với những tác dựng phụ thấy với cảc thuốc ức chế ACE nên được dự đoản
trước.
Hydroclorothiazid
Thiazid nên được sử dụng thận trọng ở bệnh nhân bị bệnh thận nặng. Ở bệnh nhân bị bệnh thận, thiazid co' thể gây urê huyết.
Tác động tich lũy của thuốc có thế tiến triễn ở bệnh nhân bị suy chức năng thận.
Ức chế kép hệ rennin-angiotensin-aldostcron:
Telmỉsartan
Như iả hệ quả cùa sự ức chế hệ rennin-angiotensin-aldosteron, thay đổi chức nãng thận (gồm suy thận cẳp) đã được bản cáo.
Ức chế kép hệ rennin—angiotensin—aldosteron (ví đụ, do thêm một thuốc ức chế ACE vảo một thuốc đối kháng thụ thể
angiotensin 11) nên kiếm soát chặt chẽ chức năng thận.
Thử nghiệm ONTARGET trên 25,620 bệnh nhân dưới 55 tuổi bị mắc xơ vữa động mạch hoặc tiểu đường kèm tốn thương cơ
quan đich, thứ ngẫu nhiến trên các bệnh nhân chi với tclmisartan, với ramipril hoặc dạng kết hợp, và theo dõi bệnh nhân
trong một thời gian trung bình là 56 thảng. Chi tiếu lâm sảng liếư quan đến tử vong do tim mạch, nhồi mảư cơ tim, đột quy và
suy tim phải nhập viện ở bệnh nhân sử dụng dạng kểt hợp te1misartan vả ramipril không tốt hon so với nhớm bệnh nhân chỉ
sử dụng teimisartan đơn độc hoặc ramiprii đơn độc.
Sử dụng đồng thời telmisartan vả ramipril gây tãng sự phơi nhiễm cùa cả ramipril vả ramipriiat bới một thừa số khoảng 2
(xem Thận trợng, Tường tác thuốc).
Không khuyến cảo sứ đụng đồng thời telmisartan vả ramiprii.
Thông tin cho bệnh nhân:
Phụ nữ mang thai: Các bệnh nhân nữ đang trong độ tuối sinh để nên được biết về hậu quả của sự phoi nhiễm với thuốc hoạt
động trên hệ rennin—angiotensin trong thời kỳ thai kỳ thứ 1, thứ 2 và thứ 3, và bệnh nhân cũng nên được biết rằng đối với kỳ
thứ nhất của thai kỳ, những tác dụng phụ nảy không xuất hiện do sự phơi nhiễm của thuốc trong tử cung nhưng sự phơi
nhiễm nảy cũng nên được hạn chế. Những bệnh nhân nảy nên được yêu cầu báo cản mang thai với bảo sỹ ngay khi có thế.
Triệu chửng hạ áp: Bệnh nhân đang uống viến teimisartan vả hyđroclorothiazỉd nên được cảnh báo là đầu óc quay cuống có
thể xuất hiện, đặc biệt trong ngảy đầu trị liệu, và triệu chứng nảy nên được báo cấm với bác sỹ kế đơn. Bệnh nhân nên được
thông bảo là nếu xuất hiện ngắt xiu, nên ngừng sử đụng vỉên telmisađan vả hydroclorothiazid cho tới khi đã tham khảo ý kiển
bảc sỹ.
Tắt cả bệnh nhân nên được cảnh bảo rằng uống không đủ nước, ra mồ hôi quả nhiều, tiêu chảy, hoặc nôn mứa có thể dẫn tới
tựt huyết ảp quá mức, với hậu quả tương tự ngắt và đầu óc quay cuống có thể xảy ra.
Bổ sung Knli: Bệnh nhân đang uống viên telmisartan vả hydroclorothiazid nên được thông báo là không sử dụng các chẳt bổ
sung kali hoặc cảc muối thay thế mả có chứa kali mà không tham khảo bảo sỹ kê đơn.
Tương tác thuốc:
Telmisurtan
Digoxin: Khi teimisartan được sử dụng đổng thời với dìgoxin, tăng nồng độ đỉnh trưng binh cùa digoxin (49%) và tăng nồng
độ rãnh (20%) đã được quan sảt. Do đó, khuyến các lá nồng độ digoxin nến được kiểm soát khi bắt đầu sử dụng, điểu chinh
và ngừng telmisartan để tránh quá liều hoặc không đủ trị liệu digitalis.
Lithi: tăng thuận nghịch nồng độ lithi huyết thanh và độc tố đã được báo cáo trong suốt quá trinh sử dụng đồng thời lithi với
các thuốc ức chế men chuyến angiotensin. Cũng có những trường hợp được bảo cáo với thuốc đối kháng thụ thể angiotensin
11 gồm teimisartan. Bởi vậy lithi không nến được sử dụng với thuốc lợi tiểu, khỏng khuyến cảo sử dụng lithi với telmisartan
vả hyđrociorothiaziđ.
ếb~ I H’Vl’“ '
Thuốc chống viêm Non-Steroid gồm các thuốc ức chế có chọn lọc qchooxygenase -2 (chất ức chế COX-2): Ớ bệnh nhân cao
tuồi, giảm thể tích nội mạch (gồm cả những trường hợp đang trị liệu thuốc lợi tiểu), hoặc với những thuốc 1ảm tồn thương
chửc năng thận, sử dựng đồng thời với NSAIDS, gồm cả thuốc ức chế chọn 1ợc trên COX-2, với các thuốc kháng thụ thể
angiotensin 11, gồm teimisartan, có thể dẫn tới tồn hại chức năng thặn, gồm cả suy thặn cấp. Những ảnh hướng nây thường
hồi phục. Kiếm soát chức năng thận định kỳ ở bệnh nhân đang sử dụng trị liệu telmisartan vả NSAID.
, . . . . -\Ề
Tảo dụng hạ ảp cúa thuõc đôi kháng thụ thê angiotensin 11, gôm cả teimisartan có thế bị giảm bời cảc thuốc NSAIDS gôm cĩải '
thuốc ức chế chọn lọc COX-2. ' "Ụ
Ramipril vờ ramiprz’lat: Sử dựng đồng thời teimisartan 80 mg một lần mỗi ngảy vả ramiprii lOmg một lần mỗi ngảy 0
người khỏe mạnh 1ảm tăng Cmax hẳng định vè. AUC của ramipril tương ứng 2,3 và 2,1 lần, vả tăng Cmax vả AUC cùa
@
ramiprilat tương ứng 2,4 và 1,5 1ần. Ngược iại, Cmax vả AUC cùa teimisartan giảm tương ứng 31% và 16%. Khi sử dụng
đồng thời teimisartan vả ramipril, sự đảp ứng có thề 1ả iớn hơn vi có lẽ tác dụng dược iực học gia thêm cùa những thuốc kết
hợp, và cũng bởi vì tăng sự phoi nhiễm ramipril vả ramiprilat khi có mặt teimisartan.
Warfarin: Telmisartan được uống trong 10 ngảy lảm tăng nhẹ nổng độ rãnh trung binh cùa warfarin; sự giảm nảy không iảm
thay đổi tỷ lệ tiêu chuẩn hóa quốc tế (INR).
Các thuốc khác: Sử dụng đồng thời với telmisartan không gây tương tác đáng kể trên iâm sảng với acetaminophen, amiodipin,
glibenclamid, simvastatin, hydroclorothiazid hoặc ibuprofen. Teimisartan không được chuyến hóa bời hệ cytochrome P450
và không có tác dụng trên in vitro trên enzyme cytochrome P450, ngoâi trừ với một số chắt ức chế CYP2C19. Telmisartan
không được cho 121 tương tảo với các thuốc ức chế enzyme cytochrome P450; nó cũng không được cho iả tương tác với các
thuốc được chuyển hóa bời enzyme cytochrome P450, ngoại trù có thế ức chế sự chuyến hóa của cảc thuốc được chuyển hóa
bới CYP2CI9.
Hydroclorothiazid
Khi sử dụng đồng thời, những thuốc sau có thể gây tương tác với thuốc lợi tiểu thiazid:
Rượu, barbiturat, hoặc các thuốc hướng thần: tiếm tảng hạ huyết áp thế đứng có thể xuất hiện.
Thuốc điều rrị tiều đường (thuốc uống vả insulin): Có thể cần điều chinh liều của thuốc điều trị tiếu đường.
Các thuốc chống tăng huyết áp khác: gia thêm tảo dụng hoặc tiềm tảng.
Nhựa Cholestyramin vả colestipoi: Sự hấp thu của hydroclorothiazid bị giảm khi có mặt của nhựa lảm trao đồi anion. Liều
đơn cùa nhựa cholestyramin hay colestipoi gắn kết với hyđrociorothiazid và giảm sự hắp thu cùa thuốc từ dường tiêu hóa tới
tương ứng 85% và 43%.
Corticosteroids. ACTH: Lảm tăng sự suy giảm chất điện giải, đặc biệt là hạ kaii.
Các amin tăng huyết áp (ví dụ, norepínephrín) : Có thể lảm giảm sự đáp ứng các thuốc amin tăng huyết ảp nhưng không đủ
để ngăn cản việc sử dụng chúng.
T huốc giãn cơ xương, khỏng khử cực (ví dụ, tubocurarin): có thể lâm tăng sự đáp ứng đối với thuốc giãn cơ.
Lithi: Nói chung không nên dùng cùng với thuốc iợi tiểu. Các thuốc iợi tiếu gỉảm độ thanh thải thận cùa Iithi và gia tăng cao
nguy co độc tính iithi. Tham khảo toa hướng dẫn cùa chế phấm lithi trước khi sử dựng những chế phẳm nảy với viên
telmisartan vả hydroclorothiazid.
Thuốc chống viêm Non—steroid: Ở một số bệnh nhân, sử dụng thuốc chổng viêm non—steroid có thể giảm tác dụng lợi tiểu,
tăng bải tiết natri niệu vả chống tăng huyết áp cùa thuốc lợi tiểu quai, giảm ka1i vả thiazid. Do đó, khi viên Telmisartan vả
hydroclorothiazid vả cảc thuốc chống viêm non-steroid được sư dụng đồng thời, bệnh nhân nên được kiểm soát chặt chẽ để
xác định iiệu tác dụng iợi tiểu mong muốn có đạt được không.
Khả nãng gây ung thư, đột biến gen và suy giảm khả năng sỉnh sân:
Telmisartan vả hydroclorothiazid
Chưa có cảc nghiên cứu về khả nãng gây ung thư, đột biến gen, hoặc suy giảm khả năng sinh sản được tiến hảnh với dạng kết
hợp telmisartan vả hydroclorothiazid.
./0
ỉ \°`-x\
léắ²ĩ/ ẫ—
T elmisarian
Chưa có bằng chứng về khả năng gây ung thư khi teimisartan được dùng trong chế độ uống ở chuột nhắt vả chưột đồng tởi 2
năm. Liều cao nhắt được dùng cho chuột nhắt ( 1000 mg/kglngảy) vả chuột đồng (iGOmg/kg/ngảy) tinh theo mglm2 tương
ứng gấp khoảng 59 vả 13 lần iiều khuyến cáo tối đa trên người (MRHD) của telmisartan. Những iiều tương tự như vậy đã
được thử nghiệm để cung cấp sự phơi nhìễm hệ thống trung binh với teimisartan tương ứng >100 lằn vả >25 lần so với sự
phơi nhiễm hệ thống ở người đang dùng MRHD (80mgfngây).
Những thử nghiệm độc tỉnh gen không cho thẳy bất kỳ tác dụng phụ liên quan tới tclmisartan ở cả gen hoặc mức
chromosome. Những thử nghiệm nảy gồm các thử nghiệm đột biến vì khuấn Saimonelỉa vả E. coli (Ames), thử nghiệm đột
biến gen với tế bảo V79 chuột túi mả Cricetus Trung Quốc, một thử nghiệm tế bảo di truyền học với tế bảo lympho người, và
một thử nghiệm nhân sinh sản chuột
Không thắy tác dựng 1iẽn quan tới thuốc trên sự sinh sản cùa chuột đồng cái vả. đực được chủ ý ở liếư lOOmg/kg/ngảy (iiếu sử
dụng cao nhất), gấp khoảng 13 lẩn, tinh thoo mg/mz, iiếu MRHD của telmisartan. Liều nảy trên chuột cho sự phơi nhiễm hệ
thống trung binh (AUC teimisaftan được xác định vảo ngảy thứ 6 cùa thai kỳ) it nhất gắp 50 iần sự phơi nhiễm hệ thống
trung bình ở người với iiều MRHD (80mg/ngảy).
Hydroclorothìazid
Một nghiên cứu trên chuột nhắt vả chuột đồng uống thuốc 2 năm được tiến hảnh dưới sự bảo trợ của Chương trinh độc tính
quốc gia (NTP) cho thắy không có bằng chứng về khả năng gây ung thư cùa hydroclorothiazid ở chuột nhắt cái (ở iiếu tới xấp
xỉ 600mg/kg/ngây) hoặc trên chuột đồng cải và đực (ờ iiều tới xẩp xi lOOmg/kgjngảy). Tưy nhiên, Chương trình độc tinh
quốc gia (N TP) đã thấy có bằng chứng nhưng không rõ rảng về sinh oarcinom gan ở chuột nhắt đực.
Hydroclorothiazid không có độc tính gen trong ổng nghiệm trong thử nghiệm đột biến Ames của Salmonella typhimurium
chùng TA 98, TA 100, TA 1535, TA 1537 và TA 1538 vả trong thử nghiệm bưồng trứng chuột tùi mả cricetus Trung quốc về
sai iệnh nhiễm sẳc thế, hoặc trên ống nghiệm trong thử nghiệm sử dựng nhiễm sắc thể tế bảo mầm phôi chnột nhắt, nhiễm sẳc
thế tủy xương chưột tủi mả cricetus Trung quốc, và gen lận liên kết giới tinh cùa ruồi giấm gây tử vong. Kết quả thử nghiệm
dương tinh đã thu được trong ống nghiệm thử nghiệm (clastogenicity) trao đồi nhiễm sắc thể CHO Sistcr, trên thử nghiệm tế
bảo lympho chuột nhắt (tính gây đột biến), và trên thử nghiệm không phân 1y Aspergiilns niduians.
Hydroclorothiazid không có tảo dụng phụ trên khả năng sinh sản cùa chuột nhắt và chuột đồng cùa cả hai giới tính trong các
nghiên cứu trong đó những loải nảy được tiếp xúc, thông qua chế độ ăn ưống, ở liều tương ứng tới 100 và 4mg/kg, trước khi
giao phối vả trong suốt thời kỳ mang thai.
Phụ nữ mang thai:
Thai kỳ loại C (3 thảng đầu tiên) và D (3 thảng giữa và 3 tháng cuối) (xem phần CÀNH BÁO, tỳ 1ệ mắc bệnh, tử vong của
thai nhi/trẻ sơ sinh).
Phụ nữ cho con bủ:
Không biết iiệu telmisartan có được bải tỉết vảo sữa mẹ hay không, những telmisartan được thấy lá có trong sữa cùa chuột.
Thiazid thi có trong sữa người. Bởi vi tiềm tảng tảo đụng phụ trên trẻ bú mẹ, nên tinh toản quyết định ngừng cho con bú hoặc
ngừng dùng thuốc theo tầm quan trọng cùa thuốc với người mẹ.
Sử dụng cho trẻ em:
Tinh an toản và hiệu quả ở trẻ em chưa được thiết lặp.
Sử dụng ở người cao tuối: _/í/
- zt'L.i
|1—1
Trong các cuộc thử nghiệm lâm sảng có kiếm soát (n=1017), xấp xỉ 20% bệnh nhân được trị 1iệu với
telmisartan/hyđroclorothiazỉd có tuổi từ 65 trở nên, và 5% lả 75 tuỗi trở nên. Không oó sự khảo biệt tổng thể về tính an toản
và hiệu quả của. telmisartan/hyđroclorothiazid được quan sát thấy ở những bệnh nhân nảy so với bệnh nhân trẻ tuối. Kinh
nghiệm lâm sảng được báo cảo khảo không thẳy sự khảo biệt nảo về sự đảp ứng giữ người oao tuổi và người trẻ tuồi, nhưng
không loại trừ một vải người cao tuối nhạy cảm hợn.
ẢNH HƯỞNG CÙA THUỐC TRÊN KHẢ NĂNG LÁI XE VÀ VẶN HÀNH MÁY MÓC
Khi chưa có một bảo các cụ thể nảo, thì bệnh nhân vẫn cần được thông bảo về những tác dụng phụ không mong muốn họ có
thể gặp như chóng mặt hay buồn ngủ trong khi điếu trị bằng Pretension Pius. Do vậy, phải cẩn trọng khi lải xe hay vận hả.nh
mảy móc.
TÁC DỤNG PHỤ:
Viên teanism1an vả hydrociorothiazid đã được đánh giả về tính an toản trên hơn 1700 bệnh nhân gồm 716 bệnh nhân được trị
liệu trên 6 tháng vả 420 bệnh nhân trị liệu trên 1 năm. Trong cảc thử nghiệm iâm sảng với viên telmisartan vả
hydroclorothiazid, không có tảo dụng phụ không ngờ tới được quan sảt thấy. Kinh nghiệm về tác dụng phụ còn được hạn chế
với những người mả trước đó đã được bảo cảo có tác dụng phụ với telmisartan vảfhoặc hydroclorothiazid. Tần xuất chung
cùa các tác dụng phụ được báo cảo với đạng kết hợp nảy 1ả so với giả dược. Cảo tảo dụng phụ phổ biến lả nhẹ vả thoáng qua
vả không đòi hỏi ngừng trị liệu.
Các tảc dỤng phụ xuất hiện ở tỷ lệ từ 2% trở lến ở bệnh nhân được điều trị với telmisartan/hydroclorothiazid vả ờ tỳ 1ệ cao
hơn so với bệnh nhân trị 1iệu với giả dược, không phân biệt mổi quan hệ nguyên nhân, được trinh bảy ở bảng 1.
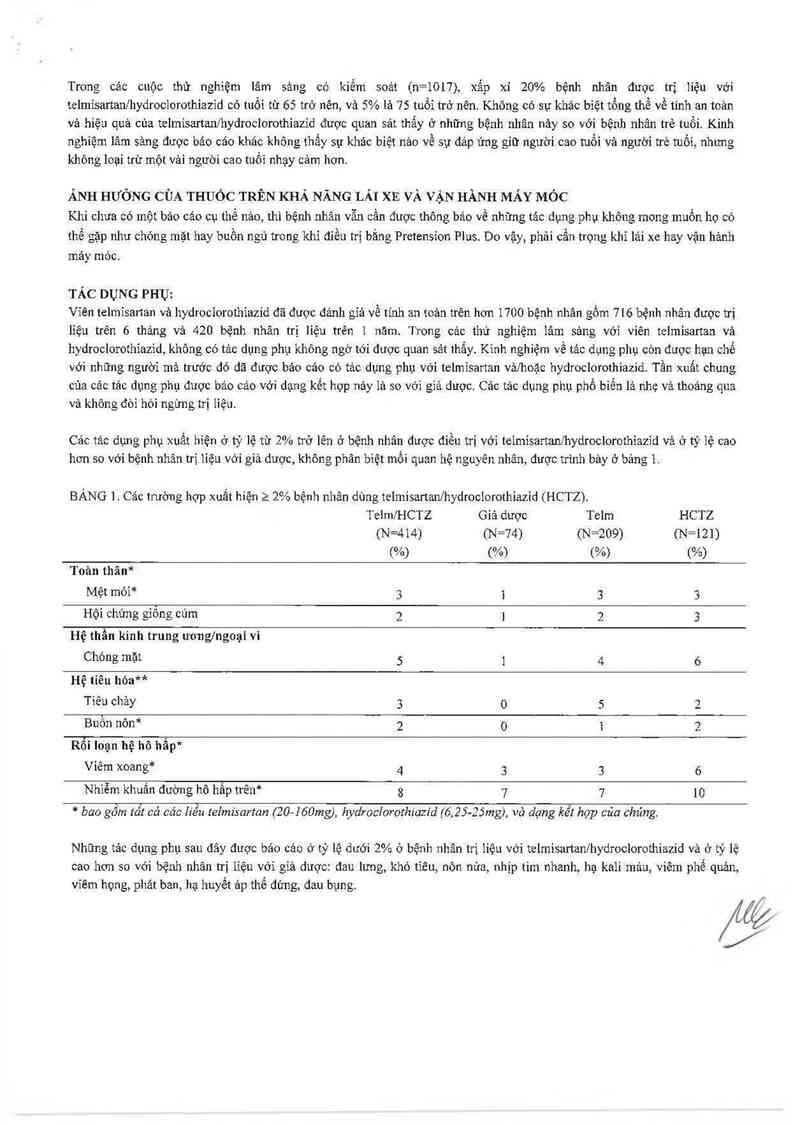
BÀNG 1. Các trường hợp xuất hiện 2 2% bệnh nhân dùng telmisartan/hydrociorothiazid (HCTZ).
Teim/HCTZ Giả dược Tolm HCTZ
(N=414) (N=74) (N=209) (N=121)
Wo) (%) (% (%)
T oản thân*
Mệt mòỉ* 3 1 3 3
Hội chứng giông cúm 2 1 2 3
Hệ thần kinh trưng ươnglngoại vi
Chóng mặt 5 1 4 6
Hệ tiêu hóaMr
Tiêu chảy 3 0 5
Buồn nôn* 2 0 1
Rối loạn hệ hô hẩp*
Viêm xoang* 4 3 3 6
Nhiễm khưân đường hô hấp trên* 8 7 7 10
* bao gôm tât cả các Iiếu telmisartart (20—160mg), hydroclorothiazid {6,25—25mg), vò dạng kết họp của chủng.
Những tảo dụng phụ sau đây được bảo cáo ở tỷ 1ệ đưới 2% ở bệnh nhân trị iiệu với te!misartanihydrocloroủazid và ở tỷ lệ
cao hơn so với bệnh nhân trị iiệu với giả dược: đau lưng, khó tiêu, nôn nửa, nhịp tim nhanh, hạ kali máu, viêm phế quản,
viêm họng, phảt ban, hạ huyết ảp thế đứng, đau bụng.
Cuối cùng, các tác dụng phụ sau đây được bảo cáo ở một tý 1ệ từ 2% trở lên ở bệnh nhân trị liệu với
teimisartanlhydrociorothiazid, nhung bằng hoặc phổ biến hơn ở nhóm giá dược: đau, nhức đầu, ho, nhiễm khuẩn đường tiết
niệu.
Cảo tác dụng phụ xuất hiện ở khoảng hoặc cùng tỷ lệ giữa nam và nữ, người cao tuổi và người trẻ tuổi, bệnh nhân da đen và
da mảư khảo
Trong cảc cuộc thử nghiệm có kiếm soát (n=1017), 0,3% bệnh nhân trị iiệu với viên teimisartan vả hydroclorothiazid với các
hảm iượng 40/12,5mg; 80/12,5 mg hoặc 80/25 mg đã ngừng trị liệu do hạ huyết áp thế đứng, vả tỷ lệ chóng mặt tương ứng là
4%, 7% và 1%.
Telmisartan
Cảo phân ứng phụ khác đã được báo oảo với teimisartan, mã không liên quan tới quan hệ nguyên nhân—kết quả, được liệt kê
dưới đây:
Hệ thần kinh iự động: iiệt dương, tăng tiết mồ hôi, đò bững.
Toản thân: Dị ứng, sốt, đau chân, mệt mòi, dau ngực.
Tim mạch: Đảnh trống ngực, phù phụ thuộc, đau thắt ngực, chân phù nế, ECG bất thường, tăng ảp, phù ngoại biên.
Hệ thần kinh trung ương: mất ngù, buổn ngủ, đau nửa đẩu, chóng mặt, di oảm, co thắt cơ bắp không tự chủ, giám cảm giảc.
Tìêu hóa: Đằy hơi, táo bón, viêm dạ dảy, khô miệng, trĩ, viêm dạ dảy-ruột, trảo ngược đạ dảy thực quản, đau răng, rối ioạn
tiêu hóa không rõ râng.
Chuyến hóa: gout, tăng cholesterol mảư, đái tháo đường.
Cơ xương khớp: viêm khớp, đau khởp, chuột rủt ở chân, đau ohân, đau cơ.
Tâm lliần: Lo âu, trầm cảm, oăng thằng.
Cơ chế khảng: Nhiễm khuẩn, nhiễm nấm, áp xe, viêm tai giữa.
Hô hấp: Hen, viêm mũi, khó thớ, chảy mảư cam.
Da: Viếm da, eczema, ngứa.
Niệu: Tăng tần số đi tiểu, viêm bảng quang.
Mạch máu: Rối ioạn mạch mảư não.
Gìa'c quan: Nhìn bất thuớng, viêm kết mạc, ù tai, đau tai.
Một trường hợp phù mạch đã được bảo cảo (trong tồng số 3781 bệnh nhân trị liệu với telmisartan).
Hydroclorothlazld
Các phản ứng phụ khảo đã được báo oảo với hydroclorothiazid, mả không liên quan tới quan hệ nguyên nhân-kết quả, được
liệt kê dưới đây:
Toản thân: yếu
Tiêu hóa: viêm tụy, vảng da (vảng da ứ mật), viêm tuyến nước bọt, co thắt, kich ứng dạ dảy.
Huyết học: thiếu mảư bất sản, mất bạch cầu hạt, giảm bạch cầu, thiếu máu than huyết, giảm tiểu cầu.
Quá mẫn: Ban xuất huyết, nhạy cảm ánh sáng, nổi mề đay, hư thận hoại tử (viêm mạch và viêm mạch da), sốt, suy hô hấp
bao gồm vỉêm phổi và phù phối, phản ứng phản vệ.
Chuyến hóa: tăng đường huyết, đường niệu, tăng acid uric mảư.
Cơ xương: oo thắt cơ.
Hệ thẫn kinh/tâm thần: bồn ohồn.
Thận: suy thận, rổi loạn chức năng thận, viêm thận kẽ ạ
Da: Hồng ban đa dạng gồm cả hội chứng Stevens-Johnson, viêm da ước vấy gồm cả nhiễm độc hoại tử biếu bì.
Giác quan: nhìn mờ thoáng qua, chứng trông lúa vảng. /
Các tác dụng phụ được báo cáo khi lưu Itởn/i rhuốc:
Những tảo dụng phụ sau đây được thấy trong sưốt thời gian sau khi phê chuẩn cho sử dụng viên telmisartan. Vì những tảo
dựng phụ nảy được báo các tự nguyện từ một số iượng bệnh nhân không chắc chắn, cảc cảo tảo dụng phụ nảy thường không
được thiết 1ập tần xuất chắc chắn hoặc thiết lập được mối liên quan với sự phơi nhiễm thuốc.
Quyết định phân ioại những phản ứng được dựa trên đặc trưng cùa một hoặc hơn những nhân tố sau:
(1) Mức độ nghiếm trọng cùa phản ứng, (2) tẩn suất báo cáo, hoặc (3) mức độ oủa mối quan hệ nguyên nhân với viên
temisartan. Các tảo dựng phụ được báo các tự phát với tần xuất phổ biến nhất gồm: đau đần, chóng mật, suy nhược, ho, buồn
nôn, mệt mòi, yếu, phù, phù mặt, phù chân, phù mạch thần kinh, mảy đay, mẫn cảm, tăng tiết mồ hôi, ban đò, đau ngực, rung
tâm nhĩ, suy tim sung hưyết, nhồi máu cơ tim, huyết áp tảng, tăng huyết ảp trầm trọng, hạ ảp (gồm cả hạ huyết ảp thế đứng),
tăng kaii huyết, ngất xiu, khó tiếu, tiếu chảy, đau, nhiễm khuẩn đường niệu, rối Ioạn chức năng cương dương, đau lưng, co co
(gổm cả chưột rủt chân), đau cơ, nhịp tim chậm, tăng bạoh cầu ái toan, giảm tiền cẩu, tăng acid uric, rối ioạn chức nảng gan,
sưy thận gồm cả suy thận cắp, thiếu mảư, tăng CPK, phản ứng phản vệ, vả đau dây chằng (gồm cả đau gân, viêm bao gân).
Một vải trường hợp hìếm tiêu cơ Vân đã được bảo cáo ở bệnh nhân dùng thuốc ức chế thụ thể angiotensin 11 gồm cả viên
telmisartan.
Cảo phảt hiện phòng thí nghiệm lâm sảng:
Trong cảc cuộc thử nghiệm có kiểm soát, sự thay đổi liên quan tới lâm sảng cùa cáo thông số thử nghiệm phòng thí nghiệm
chuẩn hiếm khi có Iiên quan tới việc sử đựng viên tcimisartan vả hydroclorothiazid.
Huvết oầu tố và tif lê thế tich huvết cầu: Giảm huyết cầu tố (2 2g/đL) vả tỷ lệ thể tich huyết cầu (29%) đã được quan sảt
trên 1,2% và 0,6% bệnh nhân dùng tclmisartan/hydrooiorothiazid, tương ứng, trong các cuộc thử nghiệm có kiếm soát.
Sự thay đổi huyết oần tố và tỷ 1ệ thể tich huyết cầu không được xem lả Có ý nghĩa lâm sảng đáng kế và khỏng phải ngừng
thuốc do thiếu máu.
Creatinine, Nitrogen ure ma'u (BUN): tảng BUN (2 11,2 mg/dL) vả creatine huyết thanh (2 0,5 mg/dL) đã được quan sảt
trên tương ứng 2,8% vả 1,4% bệnh nhân tăng áp vô cản được trị liệu với viện telmisartan trong oác cuộc thử nghiệm lâm sảng.
Không có bệnh nhân nảo ngừng trị iiệu với telmisartan do tăng BUN hoặc creatinin.
Ca'c thử nghíệm chức năng gan: đôi khi tăng men gan vả/hoặc bilirubin huyết thanh xuất hiện. Không cần ngừng trị liệu
teImisartanỉhydroclorothiazid do chửc nảng gan bất thường.
Các chẩt đỉện gíải huyết thanh: xem mục “Thận trọng”.
QUÁ L[ỂU:
Teimisartan
Dữ iiệu có sẵn iiên quan tới quá iiều teimisartan trên người cờn giới hạn. Cảo biếu hiện của quả iiều với telmisartan sẽ lả hạ
ảp, chớng mặt vả nhịp tim nhanh, nhịp tỉm chậm cũng có thể xuất hiện tư kỉch thich đối giao oảm (giây thần kinh phế vị).
Nếu triệu chứng hạ ảp xuất hiện, trị iiệu hỗ trợ nên được thực hiện, tcimisartan không được ioại bằng cách thẩm tảch mảư.
Hydroclorothiazid
Cảo dẳu hiện và triệu chứng phổ biến nhắt được quan sảt 6 những bệnh nhân nảy 1ảthuốc gây giảm chất điện giải (hạ kali
huyết, hạ chloro huyết, hạ natri huyết) và mắt nước do iợi tiếu quá mức. Nếu đigitalis oũng được đùng, hạ kaii huyết có thế
IảLn tăng rối loạn nhịp tim. Mức độ loại hydroclorothiazid bẳng thẩm tảch máu chưa được thiềt lập. Liễu LDSO ưống cùa ]
hydroclorothiazid là lớn hơn 10g’kg trên cả chuột nhắt vả chuột đồng. &
/
onto KIẸN BÀO QUẨN
Bảo quản ở nhiệt độ phòng dưới 30°C, trảnh ánh sáng và độ ẩm
QUY CÁCH ĐỎNG GÓI:
Hộp 3 vi x 10 viên.
HẠN DÙNG: 36 thâng kể từ ngảy sản xuất.
ĐỌC KỸ HƯỚNG DÃN sử DỤNG TRƯỚC KHI DÙNG
NÊU CÀN THÊM THÔNG TIN XIN HỎI BÁC sỹ
KHÔNG DÙNG THUỐC ĐÃ QUÁ HẠN sử DỤNG
ĐỀ XA TÀM TAY TRẺ EM
CÔNG TY SÂN XUẨT:
DASAN MEDICHEM CO., LTD.
#10, Wasan-ri, Dogo-myeon, Asan-si, Chungcheongnam-do, 336-910, Korea
CÔNG TY ĐÓNG GÓI:
PHARMAKING CO., LTD
363, Ogung-ri, Gamgok-myeon, Eumsung-gun, Chungchengbuk-do, 369-852, Korea.
TUQ. CỤC TRUỞNG
P.TRUỚNG PHÒNG
Jiỷuyễn JẾty JẳìnÚa
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng