


















BỘ Y 'TỆ'
cuc QUÁN LÝ DUOC '
ĐÃ PHÊ DUYỆT
Lán đâu:Ãĩi…/…ăhZJ…ẳDẩễ
/Í'—\
CxAE`M "Vrầ
Ả'“ `*`^°
è
` VĂN PHONG`Ý’Ồ
ĐAI DIỆN )ỏii
Each hard capsule con = - : '— ` — ' ẹt“exilate @
Pradaxa® mesilate equivalentto "ể- : gbĨẵỂẵỞẵầẽaỉễ .’1 E
Dabigatran etexilate om use \HO Hl MlNH/ị' ’,s' Ễ
Read the package leaflet . : n,.ủ/Ậủ/ ~
75 mg Once opened, the Ễroduct ỉe uged w\ủ 30 days. Ễ
Keep the bottletig tly closed. -*~-—'… --~’riginal package
60 h a rd ca P SUỈGS in order to protect from motsture.
Manufactured by:
Boehn'nger tngelheim Pharma GmbH & Co. KG
Keep out of reach of children ịngelheim am Rhein, Germany
Medicine! productsubìectto … — - … ' .nm. )
medical prescription Ẹẹgeetỉẫiểiigneìratrrềgẵịìhẵinm International GmbH eá ' M
Germany Batch No.] 56 lô SX: Exp. Date/ HD:
^ Boehringer
llil Ingelheim llll
Product + component: Dabigatran 75 mg 60 Kaps ! Label (Pradaxa)
Art. No.: 66927 | UNl l2
Country: EXP
Dimension: 45 x 120 mm
Scale: 1 : 1
Date: 17. April 2007
Colours: Black . PAN 659 c H PAN 293 c F
No. of films: 3 + format design
Manufacturer: Boehringer Ingelheim Pharma GmbH & Co. KG
No. of code: 15
Ref. drawing:
Circularoí correction: 01 (27. 08. 2007)
SaleslSamples/Clinic: Registrierungsmuster /aả/—
, , 272625 | 21. 08. 2001 | BIG/
ả @ Pradaxa | BI] 240-01 | ir
«5:-
Prađaxr 7Ểmg
60 hard capsules
oọc n numm 0… sử oụuc
taươc m oùne
oE xa nu nv … sn
Rx mscmpmu ONLY mmcme
Pradaan
Diblgamn Eiexilate
175 mg
Chi dịnh. thóng ch! đgnh. cách dùng
& cát thỏng lln khác: xin đọc trong
tù huúng dán sử dụng
Sau khi mửchaư, chl sử dụng thuõc
tmng 4 lhtng
Đúng I—` " ` “ `_—“_`_A`_ _/ ỷ __ ~ " 1
\| A(
t' Il
'…` smwunuz *
xsmsmmm
mm…
Sôlnsdn pm 01 x 9
.exepud
| R: Pasanmuou ONLVMEDICINE
Pradaxa°
Dabigmn mm
75 mg
6: 10 hard cipsuleS
' Chl linh, 1le «N dlnh tkh nủnn &
Rx muóc nAn meo em
0 " \
& VAN PHONG
² ĐẬI DIÊN
u.; .
ầ
+ HO cm' MIN
°’o
Pra
D:blgatnn Emdhm
75 mg
6x !0hirdcipsules
/.
ụEìM !
<ờ N’e
ẬlJHANH P 0
Ồ1v
v
A
.o
z
›
l\
c)
mu ›… muh unn… u,u ….
lml Ingelheim
DHNK:
› Dautqmcn Ennun mam:
úcmbnọunhnxmduwngw ,
. m 11 on:
PradaxaO ……a…… _ ) Pradaxaơ 23.11'.“ "*
, Dihlgilliũ Etudlle :ĨfẫẵỂẵiỀĨễh WWW leigatran Etenlale :zncẵngễuuv nu unrưv
75 mg 'DÍIIỈẨÙfẨVVỈỂl“ ' 75 mg KỈIUOWOỈYIIIIIKIIỰ
uu: qwln ugnyu um … › « cnmuln
uuh Im Stunnmnmguut MW mendu
luuthan mpnnnulm mohluu
1 Du mt mm … WC
ỉ
uonl vl : io nen Nu Mg nu…luun bysnu:
6 x … hard capsales ,… ,…, … ° * '° ham ²°Pfum ..….ụ. …,.im …… c…
ưa KG
… l…guãu …
sszlemlncim umMm,
. . c……ny
^ Boehrmger ^ Boehnnger
Illll Ingelheim
\
L 11
I ion laeo 'đxa
Aảmeưpp
IM?mưẹp …
XS 01 95 I`°N lPlJG
zxs…aiep le
Each hard capsule contains 86,48 mg Dabigatran
Etexilate mesilate equivalent to 75 mg Dabigatran
Etexilate
READ CAREFULLY THE LEAFLET BEFORE USE
KEEP OUT OF THE REACH OF CHILDREN
Store in the original package in order to protect
from moisture
Do not store above 30°C
oọc KỸ HƯỚNG DẤN sử oụuc mươc KHI oùuc
DỄ XATẨM TAY TRẺ 5…
Bảo quán nguyên trong bao bì để trảnh ẩm
Bảo quản không quá 30°C.
Chỉ định, chõng chi dịnh. cách dùng & cảc thông
tin khác: xin đt)c trong tờ hướng dán sử dụng.
Hộp \ vỉ x 10 viên nang cửng
Dùng đường uõng
SĐK:
Manufactuted by] sx bởi:
Boehringer Ingelheim Pharma GmbH & Co KG
Binger Str. 173
55216 Ingelheim am Rhein, Germany.
ỉ 11
o®`, _ 5~…
@ VAN PHONG %)
o.— ĐAI DIÊN ’;Ị`.“
LH — ' _v ..
g TA… _)HPHO g,
Ệ& OCHI INH/NỀ'
/Ộ '
~ a./
t_JjỄ/’
2ag zug
" n. " G.
% ẳẳ8
n. 0 3. o
ê ê
Ế ề.
8 a
Rx muóc 0ÁN meocon
Pradaxa®
Dabigatran Etexilate
75 mg
1 x 10 hard capsules
DNNK:
^ Boehringer
Illll Ingelheim
66922]
UNl/2
L 1
\\
›'.…uurm `\
Each hard capsule contains 86.48 mg Dabigaưan 00 'D
Etexilate mesilate equivalent to 75 mg Dablgatran q
Etexilate X g
o-t D.
READ CAREFULLY THE LEAFLEI' BEFORE USE 0 m 0
KEEP OUT OF REACH OF CHILDREN 3 x 3_
Store in the original package in order to ptotect from N 0.) m
motsture a 3
Do not store above 30°C 0 0
… m
. . 'U 13
ĐỌC KỸ MƯỚNG DẦN sư oụnc mươc KHI ouuc … , , …
oéqummmè EM E RX THUỐC BAN meo ĐơN 5
Báo quán nguyên trong bao bì để trảnh ẩm fD P d m
ln U'I
Bảo quản không quá 30°C ra a xa ®
Chi dịnh. chõng chỉ định. cách dùng & các thòng tin Dabigatran Eteỵiịaỵe
khác xín đọc trong từ hướng dán sửdụng
Hộp3vi x10vièn nang củng 75 m g
Dùng đường uõng
SĐK: ,
1
Manufactured byISX bời:
Boehringer lngelheim Pharma GmbH & Co. KG 3 x 10 ha rd ca psu les
Binger Str. 173
552161ngelhetm zm Rheín. Germany DNNK;
|
A
Boehrmger
I I .
| | Ingelhe1m
1
` 300170-02
_ ndalmy ln
File inlormation _. _ … MW
jÍm n… um; n u_1,z_qu Vu …
NH SKU VJ)ztỷ7d Nu Vn
FFM 5K0nnlen1 QG? Me Vu
muuuumnm >)Ju m; un _ … MS 0 0,5 ,…
JmưoJ-_Pi ẵỉ._ _! ’HẸJẸfflẸ’L—2 … i… …, E ,_, ,…
' ` i mm 6) 1.0 mm
ụ…ẫỈo ›uẩ, s…. ]00170-0ẩ _ * No im
.… … , 4- _ Ứ Enmụlc
L_ _ - _ _______ 4 4, mhntul mhmnten
Lum unmlcn- V] 0 011,0…2010121uu ne =… nunu … ưmeư iz) 1 CmtaolCodlĩwl LulniCodl
Technical '
a-Butho ' 1==hwycúl ___
ĩ ' MJMÃKXAMr] dllt _ gd A Mllầimn'thvut
hcnnuledm _ .—1
i°ệLú 11’333.L ,lpzưv _ L…flrỉif , O
… Ẩ , __Ĩ_ _
J_ddtttumt ' , ' ol Packl_gtng_stte
Tmpmợ nung ’rrHìjDúleI-SJN 1 lneern
1 1
›?
e"
_g_
nm
mv
~“W …
ịddẳ.lnihmy
ọua Ht~Ễ _HfNi
NỆIG NG
_ 4.-… 4 —…
ẫ .!ỉtẽfflăả 8 ...PfậẸặặỉ. . 3…²Ẻãẻtảg …Pfadẹtsa. aẫ ›. .Etệ£ã…ắ² ..:::8a .....3 t
)ẫ … 75mg _ m75mg . ằ 75mg 75mg . )ẵ 75mg m75mg
). "v….i-"wvị E ~..~..._zz… 3? 3 …:::zgfflw1 Ì….mrgạg_. .….rrr Ễ ỉ …ư:mr~ams ị..q r.ẵ~r…
)ẵ @:ưnư % ê 11 m: ễ i mm 8 ; .::.".ư ; Ề | .’.ztz’m » 11 1.211:
).2Ậ_ÍÍ. ,_ … _ … ). __
ị ..Ềiẫẳẵăỉ. .ẺỊỆẸệặẽ. ẻ Ẹ .ẵảẳỉảẫỉ. ..Êễẽđẫầffl. ị Ẹ ỈLi'ắảử .ẵiẳ'SẢi’. ả
,~, _ 75 mg _ 75mg j ị 75 mg 75 mg ; ; 75 mg 1 _ 75 mg ~
ỉ” 'ni"… ennưlrlnguuw ị ị uwfẫẵĩltễẵ'ịiẵm ỉ ị ưlz:ylulgnuưlểpmễm i n mnmIẵĩccuzaullauiiền ' , Muưzmam tzlÊpzanư ẵ } mẫn'fẫmamẵ'aiềúổ'"
s fẵ\_locumm 'E I Iarìrinm 1 l 3 I hnnuu 3 ỉ Gluhmnm ã ễ Grrủnlv. :
wmma... 5 a 1 hulhin ffllmmin 5 Ở l mau… 3 ẵ mụ…iu 5 ) Ở lnllhnln'
g Pradaxa ì % Pradaxa ; nPradaxa ứ % Pradaxa : g Pradaxa 73 % Pfadaxa
Ê mi… … ẵ 3 … nm… : ẵ mmnm mm… ĩ ~. nm… nmme Ề g mtmw … I J muon… mm…
, 75 mg ! I 75 mg ị ;} 75 mg 1 ỉ 75 mẽ… ; ị 75 mg Ế Ễ 75 mg
ẵ wưỈẵĨẳẽifẹ'ễẫỂỗ" ’"ổ.'ãâ…ă"ĩ"ĩẽ" ẵ ' ẫ u…n'fwc'fflẵ mửa— ằcuu. ' , ẵ ""ãmwệc.m ) mỗỀẫĨ'Ể-nư A"ẾỀỆM
, .
Ế .'.“á'ĩiâ'ả' ` ả“.'ẩ'íia'.ă' 1 l u'.ĩắỀằ' 1 Ê.“.1'11'31." Ể n'ẩằì'â'ầ’ ` f.?ẳĩễZ'ã'
; ..Ẻửẩãă'... 1 .'ỉ'ổãảẳ. ẵ ẳ .ỂẽẳẺẩẵ. .BẸẸỆặỆ. ? Ệ .ỈEỆắẫắẳ'. .fiă’3ẫăỉ. g
1 ;, 75 mg _ 75 mg ị g 75mg 75 mg ị ; 75 mg _ 75 mg : )
; ""....â°"…ảư.'ẽfề"ị ẳ*ưttzg.fflựriz~ ỉ ị -:nzrgaưgễwẫ ẫ-.…zrgz_zzraw ị ẳ **“..vưiwca'wẫ ẫ“1:z.:zg:arW .
, _ _ … 'Ĩ.. '.Ĩ"… . ..…. ,
Í ®"""'-'" 5 . c _.'.'.'ẵ.l.f.' l _ẩ .'...ủ'á’ '; a CỀf.ĩẳlư ẵ ! u…'ẽẳỉĩã' % c .'.mzr: T
1“’ ““ e'" _ “_ 'TT "— _:—
Ẹ .Ẻ118882 : t- .28828. % .::.:gẹh ? @ …B.f3ftièh , .'.1Lé888. : *: ..Êtãỉảăỉ. 11
i 15 mg Ễ ) Ế 75 mg ẵ ã 75 mg ỉ ! 75 mg : a 75 mẽ....J Ị ỉ 75 mg :
Ể …..bz…~zmirh… …:::haz. .…::… g Ễ ….z-wn. '"'…'fẳẻầ… ...::at ẳ ; *'t…~….:.n.. .. "*ưầĩt'w ẫ
Ỉ cư.:ư. ) czr.m . ² ’ :::c: : ::..:r: . )_Ể ci>r-…… . ®i;111~: .
)ẳ .f..f.ẽ.Eih 1 .'288888 ; g ...ÊBEỆảẽ. .288838. . 's .nz…=da…i…a .!ỉtsaéisa. g
Ế …. Ĩẵ."'ẽ. _ ) _ 25 mg ẽ : 75mg 75 mg ề ẵ ...75 mg _ _ 75 mg :
. ::…...znam _: ị**…:i..ễzỵr… 3 3 “"1ằ."“"'tf' '…~ỉ ì…z:ztr:zzmrw i 2 ""…7Wđ'iềt'fẻ' ; a ~:r..m…ưem~ ã
Ễ , cumunzq z 1 ẵ g ễ Gmmuy 3 cuaqu Ễ 5 G… n…q Ễ
…...Iưả' % e Cri`Df.“i""" Ế ; ®P'“...."… 1; e 1.';'.11111' Ễ i : .'.1'11'3’." 1; e ®:zttm :
; Pradaxa \ Pradaxa 2 g Pradaxa Pradaxa 4 g Pradaxa Pradaxa ý
! mllưlh ElFẮ:M 00qu PM ấ s MW I'flmll WIGAYIM I'lmtlll ễ Ê MIGAIW ntxun DAIIWINI U!IIIẢW Ế
; 15 mg _ ) 75mg ; ; 75mg 75m = a 75mg1 15 mg :
ẫ ~~.:.f…mmrwẳ j…mmgamrw ị ~ …:z:ạzzrẫw i“"...:rézm'zư:ư ị ị ~:ư... Ế ~:r…~r. ị
’ .13;1.:11.’ s ] e vD.':;ătăf. ỉ ẳ .'.ìfi'ả" '; ; ®.T.ă.r… I = m.:z Ế a ®1.1.1233 i
._ _ _ __. _. _ _ _ _ )ỳ _ _ ỳià _
Ptadaxa ì % Pradaxa e =.= Pradaxa D 9 Pradaxa s :: Pradaxa 919 Pradaxa
ẫ MIW Ufflull 3 i WNHIIIID! ẫ Ế NIIGLW nm… ỉ ẵ MAỈlII nm… Ệ Ế MIMIII NXIUIỈ 3 1 Ễ MW nmum ẵ
: . .Zẽ.…ẽ…z 75…8 = . .....Zĩ’fflổ....i z...Zặin… . a .. Zẽ……ii… › `i 75….8… E
Ê 'mỄofẵoưum ) mỉmcư nca nc ỉ ị m…rcvm z"ẹc «. m…cm ưỀ'xc ỉ ' uìu na … ) "'…'…'ỂẺT 's"…ư; ị
… .….. ..….
4 .'.11112' '…ziw ! * t::iư: t::r: ã Ể 11:1115' tzitr: i
g .ẺLỉầããâ. 1 .Eni.a:a. g ; :.zaian. …ẾIâẺỆãỆ g .288123. 1 .Ẹtsgẹặẳ g
;, _ 75 mg _ 75 mg ,) ị 75mg 75 mg ị ị 75 mg _ ) _ 75 mg - ;,
ẳ 1…Wưgưẫ'ưwẳ1 ẫ…=zc:zgưnnr ; ị …:nzrsgmựaưẵ Ễ…ưr…mzzẹ.. .… ;.)g ….zmwvzmỵ Ễ~1r.m~ư …
5nnu ` . . n ,, ) n Cllmlll
::::1: 5) (: ®i.nr:r ẵ . t:.ce: '» t 0: ::a::.: ẫ ỉ r:t:i:' » a ®:ztrzư'ằ Ễ
_ _____ __,ỳ___ ,_,__,__ __.W__ ___
.. . ,. 1
ặ .ttịgẹặn ² * Pfa…na…xa ặ .P…fad…ama… :? g .ỉfflảăâ. . ã hai:.ăa. g,g .!3888X8 Ẹ
, - ; , , , _ .
u ›,th ² ² …ny.luam lnldhllm w uytuw 5 ! nu ủ mm… .… Ế Mu Ion. ln ’
3 rog, ă )… 75mg ì 3 mg s … _)».7smw ); 75111 :
ẵ Ể ; …. …m'F'acq lnlhqu5FIẽoĨư-l Ệ m… .… ; m…c-m-u
ẵ 5 ~6 hú mt ` Bulrỉ l ẫ Gẵmni crniD" ẫ
_ ỀỂỂÝ/ ; iẳ ®llllíbfỉlll ®Tut 2 luoihrì'ni ) ®hĩdư'l )
€(450011101 Ạ
66rỈm
csl.mm.`ỉ
_ _ -(
Im MI …mwm
M IU
uuuwm
1… …
wutuuoiui au
wulm
mnuuúu
wnưom
1muquonqwnulụụu
(… c) nu 10 …ID
ụmnui nnimu.tmmnlnnợw
uz'ơms
uP P 51 WM
unaq l W'l
nm…
. ›
mụ um; : :; L W @I'I ~ '
WW …
W_m
IHL um IN W '— 'ỦI
W IN!
llOl … tl
W …nst
Klẵlffli
mưlru
mm
1 I
mu…mw-p ]
m wma: n lllmu m tip … ouzmntlm TỈA
U
Rx
PRADAXA®
Dabigatran etexilat
THUỐC DÙNG THEO ĐON BÁC SỸ
Thânh ghần
dabigatran etexilat dạng bazơ 75 mg hoặc 1 10 mg.
Tả dươc:
Tartaric acid, acacia, hypromellose, dimethicone 350, talc, hydroxypropyl cellulose
Vỏ nang HPMC: Carragenan, potassium chloridc, titanium dioxide, Sunset Yellow (El 10), Indigo
Carmin (13132), hypromellose.
Mực in: Shellac, N-butyl alcohol, isopropyl alcohol, industrial methylated spirit, Iron oxide black
(E172), nước tinh khiết, propylene glycol
Chỉ đinh
Phòng ngừa tai biến thuyên tắc huyết khối tĩnh mạch (TTHKTM) ở những bệnh nhân người
trưởng thảnh trải qua phẫu thuật chương trình thay thê toản bộ khởp hảng hoặc khớp gối.
Liều lương và cách dùng
Nên uông PRADAXA viên nang cứng với nước, cùng hoặc không cùng với thức ăn.
Không mở viên nang.
Người trưởng thânh:
Phòng ngừa TTHKTM sau phẫu thuật thay thế khớp gối. Nên bắt đầu điều trị với PRADAXA
đường uông trong vòng 1 — 4 giờ sau khi phẫu thuật xong với một viên nang duy nhất (1 10 mg) sau
đó tiếp tục uông 2 vỉên nang một lần môi ngảy trong tông cộng 10 ngảy. Nếu việc câm mảu chưa
được bảo đảm, nên trì hoãn khởi đầu điều trị. Nếu không băt đâu dùng thuốc ngay trong ngảy tiến
hảnh phẫu thuật, nên bắt đầu điều trị sau đó với 2 viên nang, một lần mỗi ngảy
Phòng ngừa TTHKTM sau phẫu thuật thay khớp háng. Nên bắt đầu điều trị với PRADAXA đường
uông trong vòng 1—4 giờ sau khi phẫu thuật xong với một viên nang duy nhất (110 mg) vả sau đó
tiếp tục với 2 viên nang một lần môi ngảy trong tổng cộng là 28- 35 ngảy. Nếu vìệc câm máu chưa
được bảo đảm, nên trì hoãn khởi đầu điều trị. Nếu không bắt đầu dùng thuốc ngay trong ngảy tiến
hảnh phẫu thuật nên bắt đầu điều trị sau đó với 2 viên nang, một lần môi ngảy
Trẻ em:
PRADAXA chưa được nghiên cứu ở những bệnh nhân < 18 tuối. Không khuyến cảo điều trị
PRADAXA ở trẻ em.
Suy thận:
Nên đánh giá chức năng thận bằng việc xác định độ thanh thải creatinine (CrCL) trước khi bắt đầu
điều trị với PRADAXA để tránh điều trị cho những bệnh nhân suy thận nặng (ví dụ CrCL< 30
mL/phủt). Chưa có dữ Iiệu hỗ trợ cho việc sử dụng thuốc ở bệnh nhân suy thận nặng (độ thanh thải
creatinine dưới 30 mL/phút); không khuyến cảo điều trị PRADAXA ở nhóm bệnh nhân nảy (xem
“Chống chỉ định”).
Trong khi đang điều trị, chức năng thận nên được đảnh gìá trong một số trường hợp trên lâm sảng
khi có nghi ngờ chức nặng thận có thể suy giảm hoặc xâu đi (ví dụ giảm thể tích tuần hoản, mất
nước, vả với một số thuốc dùng đồng thời,… ..)
Nên giảm liếư PRADAXA xuống còn 150 mg một lần mỗi ngảy, dùng 2 viên nang 75 mg ở những
bệnh nhân suy thận trung bình (độ thanh thải creatinine 30 — 50 mL/phủt).
Nguời cao tuổi:
Kinh nghiệm lâm sảng về sử dụng thuốc cho bệnh nhân cao tuồi (>75 tuổi) vẫn còn hạn chế. Nên
thận trọng khi điều trị cho đối tượng bệnh nhân nảy. Liều khuyến cảo là 150 mg mỗi ngảy dưới
dạng 2 viên nang 75 mg (xem phần “Cảnh báo đặc bỉệt và thận trọng” vả “Đặc tính dược lý học”).
Trong phẫu thuật thay thế khớp gôi, nên bắt đầu điều trị bằng đường uống với 1 viên nang trong
vòng 1 — 4 giờ khi hoản thảnh ca phẫu thuật và tiếp tục với 2 viên nang một lần mỗi ngảy sau đó
với tổng thời gian điều trị là 10 ngảy
Trong phẫu thuật thay thế khớp háng, nên bắt đằu điếu trị bằng đường uống với 1 viên nang trong
vòng 1 — 4 giờ sau khi hoản thảnh ca phẫu thuật vả tiếp tục với 2 viên nang một lần mỗi ngảy sau
đó với tổng thời gian điếu trị là 28— 35 ngảy.
Các nghiên cứu dược động học ở bệnh nhân cao tuổi hơn cho thấy có tăng phơi nhiễm thuốc ở
những bệnh nhân suy giảm chức năng thận do tuổi tảo.
Do suy giảm chức năng thận có thể thường xuyên hơn ở những bệnh nhân người cao tuổi (> 75
tuổi), nên đánh giá chức năng thận bằng việc xảc định độ thanh thải creatinine (CrCL) trước khi
bắt đầu điều trị với PRADAXA để tránh điều trị cho những bệnh nhân suy thận nặng (ví dụ
CrCL<3O mL/phủt). Chức năng thận cũng nên được đảnh giá ở những bệnh nhân điếu trị với
PRADAXA trong một số tình huống lâm sảng khi có nghi ngờ chức năng thận suy giảm hoặc xấu
đi (ví dụ giảm thể tích tuần hoản, mất nước và với một sô thuốc dùng đồng thời,. .).
Cân nặng: , `
Không cân thiêt phải chỉnh Iiêu.
Sử dụng đồng thời PRADAXA vởi các chất ức chế mạnh P-glycoprotein, ví dụ amiodarone,
quinidine hoặc verapamil:
Nên giảm liều PRADAXA còn 150 mg dùng một lần mỗi ngảy với 2 viên nang 75 mg ở những
bệnh nhân dùng đồng thời PRADAXA vả amìodarone, quinidine hoặc verapamil (xem “Tưong tác
thuôo”).
Nên tránh việc bắt đầu điều trị với verapamil ở những bệnhnhân sau đại phẫu chỉnh hình mà đang
sử dụng PRADAXA. Cũng nên tránh việc băt đâu đỉêu trị đông thời PRADAXA với verapamil.
Chuyến từ việc diều trị PRADAXA sang thuốc clzổng đông dạng tiêm:
Chờ 24 giờ sau liều cuối cùng trước khi chuyến từ việc đỉều trị với PRADAXA sang một thuốc
chống đông dạng tiêm.
Chuyển từ việc điều trị thuốc chổng đông tịgmg tiêm sang PRADAXA:
Nên dùngPRADAXA O — 2 giờ trước khi đên lủc dùng liêu tiêp theo của trị liệu cách quãng, hoặc
tại thời điêm ngừng dùng thuôo trong trường hợp trị lỉệu liên tục (ví dụ Heparin đường tĩnh mạch).
Quên liều _
Tiêp tục với cảc liều dùng hảng ngảy còn lại tại cùng thời điêm cùa ngảy tiếp theo.
Không được dùng liêu gâp đôi đê bù vảo cảc liêu riêng lẻ bị quên.
Chống chỉ đinh ,
' Quá mẫn vởi dabigatran hoặc dabigatran etexilat hoặc một trong cảc tá dược cùa thuôo
/Ởv
' Suy thận nặng ('CrCL < 30 lephút)
~ Cảo biền hiện chảy mảư, bệnh nhân có cơ địa chảy mảư hoặc bệnh nhân giảm đỏng mảư do
dùng thuốc hay tự phảt
' Cảc tổn thương ở cơ quan có nguy cơ chảy mảư cao trên lâm sảng bao gồm đột quỵ xuất huyết
trong vòng 6 tháng
~ Điều trị đồng thời với ketokonazolc toản thân (xem tương tảc thuốc)
o Bệnh nhân đặt van tim nhân tạo cơ học
Cảnh bảo đăc hỉêt và thân trong
Nguy cơ xuất huyết:
Giống như cảc thuốc chống đông khảc, nến sử dụng PRADAXA thận trọng trong cảc trường hợp
có tăng nguy cơ gây chảy máu. Chảy mảư có thế xuât hiện tại bất cứ vị trí nảo trong quá trình điều
trị vởi PRADAXA. Nên tỉm kiếm nơi chảy mảu nếu hcmoglobin vả/hoặc hematocrit hoặc huyết áp
gỉảm mả khỏng giải thích được nguyên nhân
Điều trị vởi PRADAXA khộng yêu cằu theo dõi chống đông mảu. xét nghiệm INR không tin cậy
Ở những bệnh nhân đang điêu trị với PRADAXA và đã có báo cáo về tăng INR dương tính giả. Do
vậy, không nên tíẽn hảnh xét nghiệm INR.
Xét nghiệm đánh giá hoạt tính chống đỏng máu như thời gian trombin (TT), thời gian đông mảư
ecarin (ECT) và thời gian thromboplastin từng phấn hoạt hóa (aPTT) có thể được dùng để phát
hiện hoạt tính quá mức của dabigatran.
Tỉnh trạng chống đông iiên quan dabigatran có thể được dánh giá bởi ECT hoặc TT. Nếu khỏng có
ECT hoặc TT, xét nghiệm aPTT giúp đảnh gìả tương đối mức độ chống đông máu cùa
PRADAXA.
Các nghiên cửu dược động học cho thấy có tăng nồng độ thuốc ở những bệnh nhân suy giảm chức
năng thận do tuổi tảc. Chống chỉ định dùng PRADAXA trong những trường hợp suy thận nặng
(CrCL< 30 mL/phút).
Nên ngừng sử dụng PRADAXA ở những bệnh nhân bị suy thận cấp.
Cảo yếu tố như suy gìảm chức nảng thận (CrCL 30- 50 mL/phủt),_ > 75 tuối, hoặc đang điếu trị chất
ức chế mạnh P- -gp có ìiên quan đến tảng nông dộ dabigatran huyết tương Sự xuất hiện cùa một
hoặc nhiều trong cảc yếu tố nảy có thề lảm tăng nguy cơ chảy máu (xem liều lượng và cách dùng).
Vìệc sử dụng đồng thời của PRADAXA với cảc trị liệu sau đây chưa được nghiên cứu và có thể
gây tăng nguy cơ chảy mảư: hcparin (ngoại trừ khi dùng với lìều cần thiết để duy trì thông thương
của catheter tĩnh mạch trung tâm hoặc động mạch) và các dẫn xuất heparin, hcparin phân từ lượng
thấp (LMWH), fondaparinux, desirudin, cảc thuốc lảm tan huyết khối, các chẳt đối khảng thụ thể
GPIIb/IIIa, tíclopidine, dextran, suiiinpyrazone, rỉvaroxaban, prasugrel, cảc thưốc đối khảng
vitamin K, cảc thuốc ức chế P-gp, itraconazole, tacrolismus, cyclosporine, ritonavir, tipranavir,
nelfmavir vả saquinavir.
Sử dụng đồng thời với dronedarone iảm tăng hấp thu dabigatran và không được khuyến cáo (xem
“Nhóm bệnh nhân đặc biệt”).
Việc sử dụng đồng thời với ticagrelor lảm tăng nồng độ dabigatran vả có thế có tương tảc dược lực
học, dẫn đến tăng nguy cơ chảy máu.
Nguy cơ chảy mảư có thế tãng lến ở những bệnh nhân điều trị đồng thời với các chất ức chế tái hấp
thu có chọn lọc serotonin (SSRI) hoặc các thuốc ức chế tái hấp thu serotonin norepinephrine
(SNRI).
Trong những trường hợp có tăng nguy cơ chảy mảư (ví dụ mới được sinh thìết hoặc bị chấn
thưong nặng, viêm nội tâm mạc do vi khuẩn), nhìn chung cần được theo dõi chặt chẽ (để phảt hiện
các dấu hiệu chảy mảư hoặc thiếu mảu).
Sử dụng các thuốc khảng viêm không steroid (NSAID) để giảm đau trong thời gian ngắn trước
hoặc sau phẫu thuật không lảm tăng nguy cơ chảy mảư khỉ điếu trị kết hợp vởi PRADAXA. Bầng
chứng về việc sử dụng NSAID thông thường có thời gỉan bán thải dưới 12 giờ trong quá trình điếu
trị với PRADAXA còn chưa đầy đủ và không thấy tăng nguy Cơ chảy mảư
Tuơng tác vởi các thuốc gây cảm ưng P-gp:
Việc sử dụng đổng thời PRADAXA với thuốc gậy cảm ứng mạnh P— —gp như riíampicin lảm giảm
nồng độ dabigatran trong huyết tương Cảo thuốc gây cảm ứng P- -gp khác như St. John` s Wort
hoặc carbamazepỉnc cũng có thế lảm giảm nồng độ dabigatran trong huyết tương, vả nên thận
trọng khi sử dụng phối hợp (xem “Tương tác thuốc” vả “Nhóm bệnh nhân dặc biệt”).
Phẫu thuật vả T hu thuật can thiệp:
Cảo bệnh nhân đang điều trị với PRADAXA mả trải qua phẫu thuật hoặc cảc thủ thuật xâm lấn có
nguy cơ chảy máu tăng lên Do vậy, có thế cẳn tạm ngừng PRADAXA để tiến hảnh những can
thiệp phẫu thuật (xem “Dược động học”).
Gíai đoạn truớc khi phẫu thuật:
Do nguy cơ tăng chảy mảư, nên tạm ngưng PRADAXA trước khi tiến hảnh cảc thủ thuật xâm lắn
hoặc tìên hảnh phẫu thuật. Nếu có thế nên ngừng sử dụng PRADAXA ít nhất 24 giờ trước thủ
thuật xâm iấn phẫu thuật hoặc phẫu thuật Ở những bệnh nhân có nhìếu nguy cơ xuất huyết hơn
hoặc trong đại phẫu khi cần đến quá trình đông mảư tốt, nến ngừng sử dụng PRADAXA 2- 4 ngảy
trước khi phẫu thuật Thanh thải cùa dabigatran ở những bệnh nhân suy thận có thế dải hơn Đìếu
nảy cần được xem xét trưởc bất kỳ thủ thuật nảo (xem Bảng ] vả “Dược động học”).
Bảng ] tóm tắt cảc quy tắc ngưng thuốc trước khi tiến hảnh thủ thuật xâm lẩn hoặc phẫu thuật
Chức năng Thời gỉan thải trừ Ngừng dabigatran trước phẫu thuật chương trình
thận dự kiến (giờ)
(CrCL Nguy cơ chảy mảư cao Nguy cơ thông thường
mL/phút) hoặc đại phẫu
2 80 ~ 13* 2 ngảy trước 24 giờ trước
ì 50-<80 ~15* 2 -3 ngảy trước 1 -2ngảytrước
230-<50 ~ 18* 4ngảytrước 2-3 ngảytrưởc
(> 48 giờ)
* để biết thêm chi tiết xcm bảng 5 “Dược động học” & `
!
Chống chỉ định sử dụng PRADAXA ở những bệnh nhân suy thận nặng (CrCL < 30 mprhút)
nhưng nếu trường họp nảy có xảy ra thì nến ngừng sử dụng PRADAXA ít nhất 5 ngảy trước kh"…
đại phẫu.
Nên tạm thời ngừng sử dụng PRADAXA nếu cẩn có nhũng can thiệp tức thời Nếu có thế nến trì
hoãn thủ thuật can thiệp/phẫu thuật cho tới ít nhất 12 gìờ kế từ liếư dùng cuồi cùng Nếu không thể
trì hoãn phẫu thuật thì có thể tăng nguy cơ chảy mảu. Ngưy cơ chảy mảư nảy nên được cân nhắc
cùng vởi tính khẩn cấp của việc can thiệp.
Gây tê tủy sống/Gây tê ngoải mảng cứng/Chọc dò Iủy sổng.
Các thủ thuật như gây tê tùy sông có thế cân chức năng câm máu hoản chỉnh
/@ff
Nguy cơ bị khối mảư tụ ngoải mảng ct'rng hoặc tủy sống có thể tảng lên trong những trường hợp
chạm thương hoặc chọc dò lặp đi, Iặp Iại và do đặt catheter ngoải mảng cứng kéo dải. Sau khi rủt
catheter, cần chờ ít nhất 1 giờ trước khi bắt đằu dùng Iiếư PRADAXA đầu tiên. Cần thường xuyên
theo dõi cảc dắu hiệu vả triệu chứng thần kinh cùa hiện tượng khối máu tụ ngoải mảng cúng hoặc
tùy sống ở những bệnh nhân nảy.
Giai đoạn sau thủ rhuật
Tiếp tục đỉều trị lại sau khi đạt được cầm mảư hoản toản
Bệnh nhân thay van tim sinh học
Chưa có đảnh giá việc sử dụng dabigatran etexilat cho bệnh nhân đặt van tim sinh học, do đó
không khuyên cảo sử dụng dabigatran ctexilat trên đỏi tượng bệnh nhân nảy.
Tá được: ”
Thuôc chứa tả dược sunsct vảng (El 10), có thẻ gây các phản ứng dị ứng.
Tương tác thuốc \
Sứ dụng đồng thời PRADAXA với các thuốc tảc động lên sự cầm mảư hoặc đông mảư bao gôm
cảc chất đối kháng Vitamin K có thế lảm tăng đáng kể nguy cơ chảy mảư. (xem “Cảnh bảo đặc
biệt vả thận trọng”).
Dabígatran etexiiat vả dabigatran không bị chuyến hóa bởi hệ thống cytochrome P450 vải không có
tảo động trên hệ enzyme cỵtochrome P450 cùa người ín vitro. Do đó cảc tương tảo thuõc — thước
liến quan khó có khả năng xảy ra vởi dabigatran etexilat hoặc dabigatran (xem “Nhóm bệnh nhân
đặc bìệt”).
Tương tác P-gp:
Các thuốc ức chế P-lecozzroiein
Dabigatran etexilat lả một cơ chất cho chất vận chuyến xuất bảo P- -gp. Sử dụng đồng thời cảc chất
ức chế P-gp (như amiodarone, veraparnil quinidine, kctoconazolc toản thân, dronedarone,
ticagrelm vả clarithromycinc) có thế lảm tăng nồng dộ dabigatran trong huyết tương.
Chống chỉ định sử dụng đồng thời vởi ketoconazoie toản thân
Về việc sử dụng đồng thời với cảc chất ức chế P— —gp vả Iiếu lượng của PRADAXA trong chỉ định
“phòng ngưa thuyên tắc huyết khối tĩnh mạch (TTHKTM) ở những bệnh nhân vừa trải qua đại
phẫu chinh hỉnh” xin xem “Liều lượng và cách dùng” và “Nhóm bệnh nhân đặc biệt”
Amz'odarone: Nồng độ dabigatran ở người tình nguyện khỏe mạnh tăng lến khoảng 1,6 lần (+60%)
khi có sự xuất hiện cùa amiodarone (xem Nhóm bệnh nhân đặc biệt).
Verapamiỉ: Khi dùng PRADAXA (150 mg) cùng với verapamil đường uống, Cmax vả AUC cùa
dabigatran được tăng lến nhưng mức độ thay đối nảy iả khảo nhau, phụ thuộc vảo thời gian dùng
thuốc vả dạng chế phẩm của verapamil (xem “Nhóm bệnh nhân đặc biệt”)
Quinidine: Nồng độ dabigatran ở người tinh ngưyện khỏe mạnh tăng lên khoảng 1, 5 lần (+53%)
khi có sự xuất hiện cùa quinidinc (xem °Nhóm bệnh nhân đặc biệt”)
Clart'thromycin: Nồng độ dabigatran & người tình ngưyện khóe mạnh tăng lên khoảng 19% khi có
sự xưất hiện cùa ciarithromycin mà không có bất cứ lo ngại về tính an toản trên lảm sảng (xem
“Nhóm bệnh nhân đặc biệt”)
Ketoconazole: Nồng độ dabigatran tăng lên khoảng 2,5 lần (+150%) sau khi dùng đơn liếư và đa
liếư của ketoconazole toản thân (xem “Chống chỉ định” và “Nhóm bệnh nhân đặc biệt”).
Dronedarone: Nồng độ dabigatran tãng lên 2,1 lần (+1 14%) hoặc 2,4 lần (+136%) tương ứng sau
khi dùng đơn liều hoặc đa liều dronedarone (xem “Nhóm bệnh nhân đặc biệt”).
Ticagrelor Nồng độ dabigatran tăng 1,46 lần (tăng 46%) ở người tình nguyện khóe mạnh khi có
sự xuất hiện cùa ticagrelor ở trạng thái ỏn định hoặc tăng 1,73 lần (tãng 73%) khi dùng đồng thời
liều tấn công ticagrelor và đơn liều 75 mg dabigatran etcxilat.
Các thuốc lá cơ chất cúa P- glycoproteìn.
Digoxin: Trong một nghiên cứu được tiến hảnh trên 24 người khỏe mạnh, khi sử dụng PRADAXA
cùng với digoxin, đã quan sát thấy không có sự thay đối digoxin và không có những thay đồi liên
quan đển lâm sảng về nông độ dabigatran (xem“Nhóm bệnh nhân đặc biệt”).
Thuốc gâv cám ửngJ P-glvcoprolein:
Sau 7 ngảy điều trị với 600 mg rifampicin ngảy 1 lần cả AUCg.00 vả Cmax của dabigatran lấn lượt
giảm 67% và 66% so với điều trị tham chiếu.
Sử dụng đồng thời với cảc thuốc cảm ứng P-gp (ví dụ rifampicin) lảm giảm nồng độ dabigatran và
nên tránh (xem “Cảnh báo đặc biệt và thận trọng” vả “Nhóm bệnh nhân đặc biệt”).
Khả nãng sinh sản. thai kỳ và cho con bú
Thai kỳ
Hiện không có dữ liệu lâm sảng nảo về việc sử dụng thuốc ớ phụ nữ có thai. Nguy cơ đối với thai
nhi chưa được biết.
Phụ nữ đangtrong độ tuổi sinh sản cần tránh có thai trong quá trinh điều trị với PRADAXA và
không nên điêu trị với PRADAXA ở phụ nữ đang mang thai trừ khi lợi ích mong đợi nhiêu hơn so
với nguy cơ.
Cho con bú
Hiện chưa có dữ liệu lâm sảng. Nên thận trọng băng cách ngừng cho con bủ.
Khả năng sinh sản
Không có dữ liệu lâm sảng. Cảc nghiên cứu tiên lâm sảng trên khả năng sinh sản không cho thây
bât kỳ tảc dụng ngoại ý trên khả năng sinh sản hoặc phát triên cùa động vật sau khi sinh.
Ánh hưởng lên khả nãng lải xe và vân hảnh máy móc
Chưa có nghiên cứu vê ảnh hưởng trên khả năng lái xe và vận hảnh máy móc được tỉên hảnh.
Tảc dung phu `
Tính an toản cùa PRADAXA nhin chung đã được đảnh giả trên 223837 bệnh nhân được điêu trị
trong 7 nghiên cứu lâm sảng ; trong đó có 18 726 bệnh nhân được điêu trị với PRADAXA.
Cảc nghiên cứu ban đầu trong phòng ngừa TTHKTM sau đại phẫu chỉnh hình với tồng số 10.795
bệnh nhân được điếu trị trong 6 nghiên cứu có nhóm chứng được sử dụng it nhất một liếư
dabigatran etexilat (150 mg một ngảy, 220 mg một ngảy, enoxaparin). 6 684 trong số 10 795 bệnh
nhân được điều trị với liều 150 hoặc 220 mg dabigatran etexilat một lần mỗi ngảy.
Tống cộng có `khoảng ,9% bệnh nhânrđược điếu trị phẫu thuật chương trình thay khớp gối hoặc
khớp hảng (điêu trị ngăn hạn có thế đên 42 ngảy) bị các phản ứng ngoại ý.
Chảy máu
)tV
Chảy mảư là tác dụng phụ liên quan nhiều nhất tới PRADAXA; xác định bới dấu hiệu chảy máu
bất kỳ loại hoặc mức độ nghiêm trọng nảo và xuất hiện trong khoảng 14% bệnh nhân điếu trị ngắn
hạn trong phẫu thuật thay khớp gôi hoặc khớp háng
Mặc dù tần suất hiếm gặp trong cảc nghìên cứu lâm sảng, chảy máu nặng hoặc nghiêm trọng có
thế xảy ra, vả bất kế vị trí, có thể dẫn tới hậu quả tản tật, đe dọa tính mạng hoặc thậm chỉ gây từ
vong.
Tỷ lệ chảy mảư nói chung là tương tư giữa các nhóm điều trị và không có sự khác biệt đáng kế.
Tác dụng phụ:
Cảc phản ứng ngoại ý được phân loại theo hệ cơ quan và thuật ngữ MedDRA được bảo cáo từ bất
kỳ nhóm điếu trị nảo trong dân số của tất cả cảc nghiên cứu có đối chứng được liệt kê dưới đây
Bảng 2 và 3 liệt kê cảc tảc dụng phụ được xảc định.
Cảo tảo dụng phụ nhìn chung liên quan đến cơ chế dược lý học của dabigatran etexilat và lá cảc
biến cố liên quan đến chảy máu có thể xảy ra ở các cơ quan và vị trí giải phẫu khảo nhau
Tỷ lệ các tảo dụng phụ quan sảt_được của dabigatran etexilat ở những bệnh nhân điều trị trong
phòng ngừa TTHKTM sau phâu thuật thay khớp gôi hoặc hảng năm trong phạm vi của
enoxaparin.
Bảng 2: Cảo tảo dụng phụ được xác định từ các nghiên cửu phòng ngừa tiên phát Iaí biến
TTHKTM sau đại phâu chỉnh hình vả phòng ngừa đột quỵ do thuyên tăc mạch và
Ihuyên lăc hệ thông ở bệnh nhân rung nhĩ:
Rôi loan hê máu và bach huyêt
Thiêu máu, giảm tiêu câu
Rối loan hê miễnđich ` ,
Quá mân với thuôo bao gôm mảy đay, phảt ban và ngứa, co thăt phế quản, phù mạch, phản
ứng quả mẫn
Rối loan hê thần kinh
Xuât huyêt nội sọ
Rối loan mach
Mảu tụ , chảy máu
Rối loan hô hấp, ngưc và trung thất
Chảy mảư mũi , ho ra máu
Rối loan da dảỵ ruôt
Xuât huyêt tiêu hóa , đau bụng, tiêu chảy, khó tiêu, buôn nôn, loét dạ dảy, viêm thực quản
dạ dảy, trảo ngược thực quản dạ dảy, nôn, khó nuôt
Rối loan gan mât
Bât thường chức năng gan
Rối loan da vả mô dưới da
Xuât huyêt da
Rôi ioan xương, cơ xương khớp vả mô liên kẽt
Tụ mảư khởp
Rôi loan thân và tiết niên
Xuât huyêt niệu sinh dục
Rối loan toản thân và tai vi tri sử dung
Xuât huyêt nơi tiêm, xuât huyêt tại vị trí đặt catheter
Tốn thương, ngô đôc hoảc nhũng biển chứng sau thù thuât
Chảy mảư do chân thương, chảy mảư tại vêt rạch
Bảng 3: Cảc tảo dụng phụ cụ thể dược xác định theo mỗi chỉ định
Phỏng ngừa mi bìến TTHKTM ơ những bệnh nhân sau đại phẫu chỉnh hình:
Rối loan mach máu
Chảy máu tại vệt thưong
Rôỉ loan toản thân và tai vi trí SỬ dunE
Tiêt dịch có mảư
Tổn thương, ngô đôc hoăc những biến chứng sau thủ thuât
Khôi mảư tụ sau thủ thuật. chảy mảư sau thù thưật, thiêu máu hậu phân, tiết dịch sau thủ
thuật, vệt thương tiêt dịch
Cảo thù thụât nôi khoa vả ngoai khoa
Dân iưu vết thương, dân lưu hậu phâu
Thông báo cho bác sỹ các tác dụng phụ gặp phải khi sử dụng thuốc.
Quá Iiều
Quả liếư khi dùng PRADAXA có thể dẫn đến cảc biến chứng chảy mảư do đặc tính dược iực học
của thuốc. Không có sẵn thuốc giải độc đặc hiệu đối khảng với hoạt tính dược lực học cùa
PRADAXA Dùng liếu cao hơn các liếư được khuyến cảo lảm tăng nguy cơ chảy máu. Có thế phải
ngừng sử dụng PRADAXA khi có tảc dụng chống đông mảư quá mức Khi có cảc biến chứng
chảy mảư, phải ngứnlg điếu trị vả xảo định vị trí chảy mảư. Do dabigatran được thải trừ chủ yêu
qua thận, cân duy trìl ượng nước tỉễu thích hợp
Nến tiến hảnh cảc biện phảp điếu trị chưẩn thích hợp, như phẫu thuật cầm mảư vả. bồi hoản lượng
máu mất. Ngoài ra, có thế cân nhắc việc sử dụng máu tưới toản phần hoặc huyết tương tươi đông
lạnh. Do liên kết với protein thấp, dabigatran có thế được thẳm phân, tuy nhiên cảc kinh nghiệm
lâm sảng về việc dùng biện phảp iọc máu trong trường hợp nảy còn hạn chế (xcm “Nhóm bệnh
nhân đặc biệt”).
Phức hợp prothrombin đậm đặc họat hóa (ví dụ FEIBA) hoặc yếu tố VIIa tải tổ hợp hoặc các chế
phẳm đậm đặc chứa cảc yếu tố đông mảư II, IX, X nên được xem xét sử dụng. Có một vải bằng
chứng thực nghỉệm để hỗ trợ cho vai trò cùa cảc yếu tố nảy trong việc đảo ngược hiệu quả chống
đông của dabigatran nhưng sự hữu ích của chúng trên lâm sảng chưa được chứng minh một cách
có hệ thống. Nên thận trọng đối với vỉệc truyện tiếu cầu đậm đặc trong trường hợp có thiếu tiếu
cầu hoặc đã sử dụng cảc thuốc khảng tiếu câu có hoạt tinh kéo dải. Tất cả điếu trị triệu chứng được
đưa ra theo quyết định cùa bảc sỹ.
Đãc tính dươc lv hoc
Nhóm điểu trị: thuốc ức chế thrombin trưc tiếp dùng đường uống
Mã ATC : BOIAEO7 - dabigatran ctexilat
Thõng tin chung
Dabigatran etexilat lả một tiến chẳt có phân tử lượng nhỏ và không có tác dụng dược lý. Sau khi
uống, dabigatran etcxiiat được hấp thu nhanh chóng và chưyến hóa thảnh dabigatran nhờ sự thùy
phân được xúc tảo bới esterase trong huyết tương và gan. Dabigatran là một chẩt ức chế thrombin
trực tiếp, có hồi phục, mạnh vả có tính cạnh tranh và lá chẳt có hoạt tính chinh trong huyết tương
Do thrombin (scrinc protcasc) giúp chuyến đổi fibrinogen thảnh fibrin trong quá trình đông mảư,
dùng thuốc ức chế thrombin sẽ ngăn chặn sự hình thảnh cục mảư dông. Dabigatran củng ức chế
thrombin tự do, thrombin liên kết với fibrìn vả sự kết tặp tiều cầu do thrombin
Các nghiên cứu in—vivo vả ex-vivo trên dộng vật cho thấy hiệu quả chống huyết khối và hoạt tính
chông đông cùa dabigatran sau khi dùng theo đường tĩnh mạch và dabigatran etexilat sau khi uông
ớ cảc mô hình huyết khôi trên động vật khảo nhau.
Có một mối tương quan chặt chẽ giữa nổng độ dabigatran trong huyết tương vả mức độ hiệu quả
chống dông
Dab1gatran kéo dải thời gian aP1 T (thời gian thromboplastin từng phần hoạt hóa) ECT và TT
Cảc nghiên cứu 1âm sảng ban đầu về phòng ngừa thuvên tắc tĩnh mach do hưvết khối sau đai phẫu
thav các khởn lớn:
Trong 2 nghiến cứu dò liếư, mù đôi, nhóm song song, ngẫu nhiên quy mô lớn, những bệnh nhân
được đại phẫu chinh hình theo chương trình (một nghiên cứu cho bệnh nhân có phẫu thuật thay
khớp gối và một nghiên cứu cho bệnh nhân có phẫu thuật thay khớp háng) dùng dabigatran
etexilat 75 mg hoặc 110 mg trong vòng 1 - 4 giờ phẫu thuật, sau đó dùng 150 mg hoặc 220 mg
một lần môi ngảy, khi quá trình cầm máu đã được bảo đảm, hoặc enoxaparin 40 mg vảo ngảy
trước khi phẫu thưật và một lằn mỗi ngảy sau đó.
Trong nghiến cứu RE MODEL (thay khớp gối) bệnh nhãn được điếu trị 6-10 ngảy vả trong
nghiến cứu RE-NOVATE (thay khớp háng) trong 28- 35 ngảy. Tổng số 2076 bệnh nhân (khớp
gối) và 3494 hệnh nhân (khớp hảng) đã được điều trị
Các kết quả cùa nghiên cứu thay khớp gối (RE- MODEL) theo tiếu chí chinh lả toản bộ bỉến cố
thuyên tăc huyết khối tĩnh mạch bao gồm biến cố không triệu chứng và tử vong do mọi nguyên
nhân đã cho thấy tác dụng chống huyết khối của dabigatran etexilat ở cả hai mức liếư lá không
thua kém về mặt thống kế so với enoxaparin.
Tương tự như vậy, toản bộ biến có thuyên tắc huyết khối tĩnh mạch kể cả biến cố khỏng triệu
chứng và tử vong do mọi ngưyên nhân lả tiêu chí chính của nghiên cứu thay khớp hảng (RE-
NOVATE). Một lần nữa, dabigatran etexilat ở cả 2 mức lìếu hảng ngảy về mặt thống kế đến không
thua kém so với tác dụng cùa enoxaparin 40 mg mỗi ngảy.
Ngoài ra trong một nghiên cứu thử 3 (RE MOBILIZE) với thiết kế mù đôi, ngẫu nhiên, nhóm
song song, các bệnh nhân trải qua phẫu thuật thay khớp gối dùng dabigatran etcxilat 75 mg hoặc
] 10 mg trong vòng 6 - 12 giờ sau khi phẫu thuật và sau đó dùng 150 mg và 220 mg một lằn mỗi
ngảy. Thời gian điều trị là 12 - 15 ngảy. Tổng cộng có 2615 bệnh nhân được chọn ngẫu nhíên và
2596 bệnh nhân được điếu trị. Liều thuốc so sánh của enoxaparin lả 30 mg hai iằn mỗi ngảy theo
hưởng dẫn sữ dụng cùa Mỹ Tính không thua kém không được chứng minh qua nghiên cứu RE-
MOBHJZE. Không có sự khác hỉệt có ý nghĩa thống kê về hiện tượng chảy máu so với thuốc đối
chửng.
Bên cạnh đó, một nghiên cứu pha II, ngẫu nhiên, nhóm song song, mù đôi, có đối chứng vời giả
dược tiến hảnh trẻn bệnh nhân người Nhật Bản dùng dabigatran etexilat 110 mg, 150 mg, vả
220 mg ở ngảy kế tiếp sau khi phẫu thuật thay khớp gôi theo chương trình. Nghiên cứu trên người
Nhật Bản cho thẳy mối liên hệ rõ rảng giữa đảp ứng với liếư lượng lến hiệu quả của dabigatran
etexilat vả đặc điếm chảy mảư tương tự giá dược
Trong nghiên cứu RE-MODEL vả RE-NOVATE, việc chia nhóm ngẫu nhiên được thực hỉện trước
khi phẫu thuật và trong nghiên cứu RE-MOBILIZE và nghiên cứu có so sánh giá dược trên người
Nhật Bản thì việc chia nhóm ngẫu nhiên được thực hiện sau khi phẫu thuật. Dây là điểm lưu ý đặc
biệt trong khi đánh giá tính an toản ở những nghiên cứu nảy. Vì lý do nảy cảc nghiên cứu được
gộp lại thảnh nghiên cứu ngẫu nhiên trước và sau khi phẫu thuật trong Bảng 4.
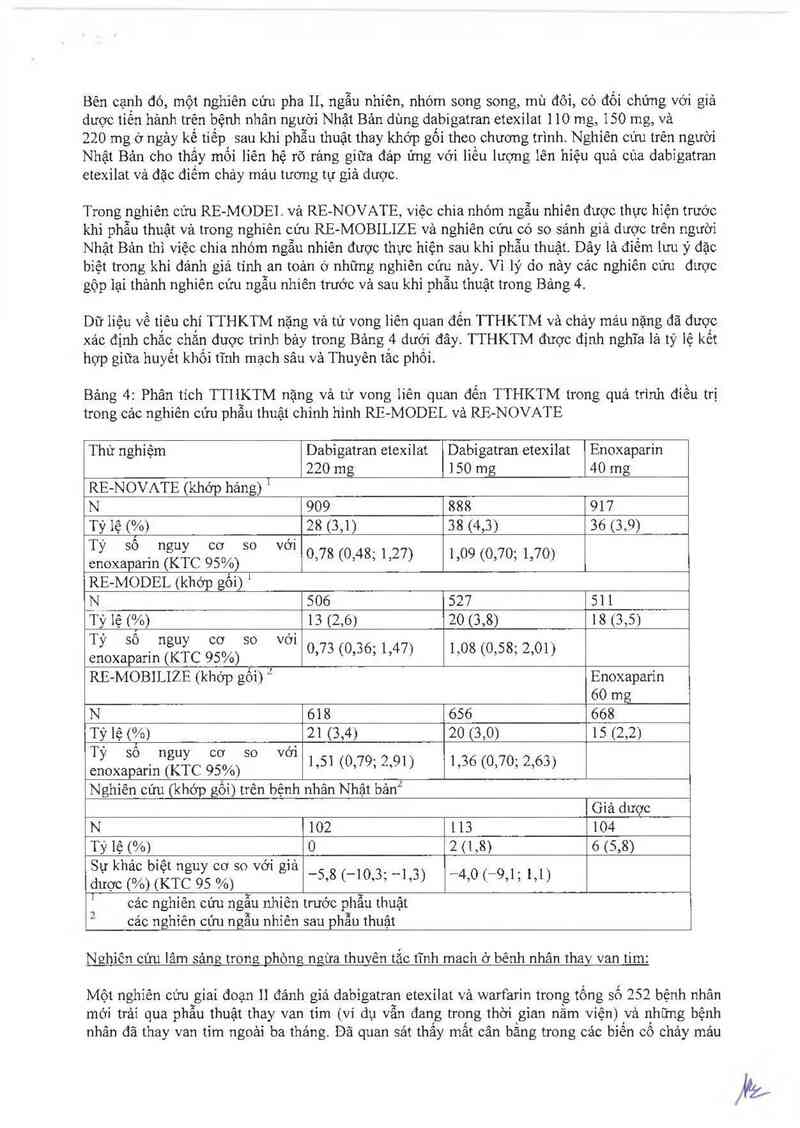
Dữ liệu về tiêu chí TTHKTM nặng và tử vong liên quan đến TTHKTM và chảy mảư nặng đã được
xảc định chắc chắn được trình bảy trong Bảng 4 dưới đây TTHKTM được định nghĩa lả tỷ lệ kết
hợp giữa huyết khối tĩnh mạch sâu vả Thưyến tắc phối.
Bảng 4: Phân tich TTII_KTM nặng và tử vong Iiên quan đến TTHKTM trong quá trình điều trị
trong cảc nghiên cứu phân thuật chinh hình RE-MODEL vả RE-NOVATE
Thử nghiệm Dabìgatran etexilat Dabigatran etexilat Enoxaparin
220 mg ]50 mg 40 mg
RE-NOVATE (khởp hảng) 1
N 909 888 917
Tỷ lệ (Ễ/o) 28 (3,1) 38 (4,3) 36 (3,9)
Tỳ sô nguy co so với
enoxaparin (KTC 95%)
RE-MODEL (khởp gối) '
_N 506 527 51 1
Tỷ lệ (%) 13 (2,6) 20 (3,8) 18 (3,5)
Tỷ số nguy co so với
0,78 (0,48; 1,27) 1,09 (0,70; 1,70)
enoxaparin (KTC 95%) 0,73 (0,36, 1,47) 1,08 (0,58, 2,01)
RE-MOBILIZE (khớp gối) ² Enoxaparin
60 mg
N 618 656 668
Tỷ lệ (vo) 21 (3,4) 20 (3,0) 15 (2,21
Tỷ sô nguy co so với _ _ ,
enoxaparin (KTC 95%) 1,51 (0,79, 2,91) 1,36 (0,70, 2,63)
Nghiên cứu (khớp gối) trên bệnh nhân Nhật bản“’
Giả dược
N ]02 113 104
Tỷ lệ (%) 0 2 (1,8) 6 (5,8)
Sự khác biệt nguy co so với giả _ _ _ __ _ _ _
dược (%) (KTC 95 %) 5,8 ( 10,3, 1,3) 4,0( 9,1 , 1,1)
! ' « › Ì ~ A o A
cac nghien cưu ngan nhtcn trươc phẫu thưạt
cảc nghiên cún ngẫu nhìên sau phần thuật
.,
L
Nghìôn cứu iâm sảng trong phòng ngừa thuvên tắc tĩnh mach ở bênh nhân thav van tim:
Một nghiến cứu giai đoạn 11 đảnh giả dabigatran etexilat vả warfarin trong tống số 252 bệnh nhân
mới trải qua phẫu thuật thay van tim (ví dụ vẫn đang trong thời gian năm viện) và những bệnh
nhân đã thay van tim ngoải ba thảng Đã quan sải thấy mất cân bằng trong cảc biến có chảy mảư
do thuyên tắc tĩnh mạch vả tồng số cảc biến cố chảy mảư (chủ yếu lả nhẹ). Ở những bệnh nhản hậu
phẫu giai đoạn sớm, chảy máu nghiếm trọng chủ yêu biếu hiện như xuất huyết trản dịch mảng tim,
đặc biệt ở những bệnh nhân bắt đầu điếu trị dabigatran etexilat sớm (vỉ đụ vâo ngảy thứ 3) sau
phẫu thuật thay van tim
Dươc đông hoc
Sau khi dùng đabigatran etcxilat đường uống ở những người tinh nguyện khoẻ mạnh, đặc tính
duợc động học của dabigatran trong huyết tương được đặc trưng bới sự tăng nhanh nồng độ trong
huyết tương, với nồng độ đỉnh (Cmax) đạt được trong khoảng 0, 5- 2, 0 giờ sau khi uống. Cmax, diện
tich dưới dường cong nồng dộ trong huyết tương theo thời gian (AUC) tỷ1 ệ với lìếu dùng Sau C-
…,x, nồng độ trong huyết tương cùa dabigatran giảm theo hảm mũ kép với thời gian bán thải trung
bình của pha cưôi khoảng 11 giờ ở người cao tuôi khoẻ mạnh Sau khi dùng da liều, thời gìan bản
thải cuối cùng được ghi nhận vảo khoảng 12 14 giờ. Thời gìan bán thải không phụ thuộc vảo liếu.
Tuy nhiến thời gian bản thải bị kéo dải nếu chức năng thận suy giảm như trinh bảy ở Bảng 5 dưới
đây
Bảng 5: Thời gian bản thải của dabigatran ở người tình nguyện khóe mạnh vả ở người có chức
năng thận suy giảm
, ~, , Trun binh nhân % biên thiên trun bình
Đọ 0² ca“ thạn (chl) nhângịgcvoxol; gỉới(hạn) thoi gìan bán tỂái
lmLiphút] [gìờ]
> 80 13,4 (25,7%; 11,0 - 21,6)
>50 - S 80 15,3 (42,7%;11J - 34,1)
>30-550 18,4(18,5%;13,3-23,0)
530 27,2 (15,3%; 21,6- 35,0)
Sinh khả dụng tuyệt đối của dabigatran sau khi ụống dabigatran etexilat với vỏ nang HPMC xấp xỉ
6,5 %.
Thức ăn không ảnh hướng đến sinh khả dụng cùa dabigatran etexilat nhưng gây trì hoãn thời gian
đạt được nông độ đinh trong huyết tương khoảng 2 giờ.
Sinh khả dụng đường uống có thế tãng lên khoảng 1,8 lần (+75%) so với công thức viến nang
tham chiếu khi cảc hạt nhỏ được đùng không có vỏ nang HPMC. Do đó, trên lâm sảng cằn luôn
luôn bảo vệ tinh nguyên ven của vỏ nang HPMC để tránh vô ý lảm tăng sinh khả dụng cùa
dabigatran etexilate. Vì thế, nên khuyên bệnh nhân không mở viến nang vả trảnh Uống cảc hạt
thuốc không được bao bọc (vi đụ rắc thuốc vảo thức ản hoặc cho vảo đồ uống). (xem “Liều iượng
và cách dùng”)
Một nghiến cứu đảnh giá sự hấp thu cùa dabigatran etexilat sau phẫu thuật 1 —3 giờ cho thấy quá
trinh hấp thu bị chặm hơn so với người tinh nguyện khóe mạnh, thế hiện bằng đường cong nông
độ - thời gian bằng phẳng, không có nồng độ đinh tăng cao Nồng độ đỉnh trong huyết tương đạt
được sau khi uông thuốc 6 giờ, hay khoảng 7- 9 giờ sau phẫu thuật (nghiên cứu BISTRO Ib) Tuy
nhiến cũng cân lưu ý lả do ảnh hưởng cùa những yêu tố khảc như gây mê, liệt dạ dảy ruột và tác
động phẫu thuật, sẽ có một tỉ lệ bệnh nhân chậm hấp thu thuốc bất kể dạng bảo chế đường uống
Mặc dù nghiên cứu nảy không dự đoản được liệu sự giảm hẳp thu có tiếp tục xảy ra với cảc liếư
tiếp theo không, một nghiên cứu khảo đã cho thắy sự chậm và khó hấp thu thuốc thường chi xảy
ro trong ngảy tiến hânh phẫu thuật. Trong cảc ngảy tiếp theo, dabigatran được hầp thu nhanh vả
nông độ đinh trong huyết tương đạt được trong khoảng 2 giờ sau khi uống.
Chuyến hoậ vả thải trừ dabigatran được nghiên cửu sau khi đùng một liếư đơn tiêm tĩnh mạch
đảnh dâu băng đông vị phóng xạ ở những đôi tượng nam giới khỏe mạnh. Sau một liêu tiêm tĩnh
mạch, dẫn chất dabigatran có hoạt tinh phỏng xạ được thải trừ chủ yếư’qua`thận (85%). Khoảng
6% liếư dùng được thải trứ qua phân. Khoảng 88 - 94% liêu dùng đánh dâu đông vị phóng xạ được
thu thập sau 168 giờ kế từ khi dùng thuôo.
Sau khi uống, dabigatran ctexilat nhanh chóng chuyến thảnh dabigatran, dạng có hoạt tính trong
huyết tương. Quá trình chưyến tiến chất dabigatran etexílat thảnh hoạt chất chinh dabigatran nhờ
enzym xúc tác thuỷ phân esterase lả phản ứng chuyến hoá chủ yểu. Dabigatran lả một chất dễ kết
hợp tạo thảnh các acylgiucưronides có hoạt tính dược lý. Có 4 chất đồng phân vị trí, 1 -0, 2- 0, 3-
0, 4- O- acylglucưronide, mỗi chẳt chiếm khoảng dưới 10% tồng lượng dabigatran trong huyết
tượng Lượng rắt nhờ cùa các chất chuyến hoả khảo chỉ được phảt hiện nhờ những phương phảp
phân tích có độ nhạy cao Dabigatran được thải trừ chủ yếu dưới dạng không đổi trong nước tiếu
vói tốc độ khoảng 100 mL/phút tương ứng với tốc độ lọc câu thận. Sự gắn kết cùa dabigatran vảo
huyết tương người thì thấp (34- 35%) và không tùy thưộc vảo nồng độ. Thế tich phân bố cùa
dabigatran khoảng 60— 70 L vượt quả thể tích nước của toản bộ cơ thể cho thấy thuốc phân bố vảo
mỏ ở mức trung bình.
Nhóm bệnh nhân đặc biệt
Suv thân
Trong một nghiên cứu pha 1, phân bố thuốc (AUC) dabigatran ở những người tinh nguyện suy thận
trung binh (CrCL 30— 50 mprhút) sau khi uỏng dab1 gatran etexilat cao xâp xỉ 3 lần so vởi những
người không bị suy thận
Ở một số it người tình nguyện suy thận nặng (CrCL 10 - 30 mL/phút), nồng độ dabigatran cao gấp
khoảng 6 lần vả thời gian bản thải kéo dải khoảng 2 lằn so với quan sảt ở người không bị suy thận
(xem phần “Liều lượng vả cách dùng” vả “Chống chỉ định”).
Thải trừ dabigatran nhờ iọc mảư đã được nghiến cứu ở nhũng bệnh nhân suy thận giai đoạn cuối
(ESRD) mả không bị rưng nhĩ Thầm phân được tiến hảnh với tốc dộ chảy cùa dịch lọc 1ả
700 mL/phủt, kéo dải 4 giờ, tốc độ dờng mảư 200 mL/phủt hoặc 350— 390 mL/phút. Phương pháp
nảy loại bỏ tương ứng 50% hoặc 60% nồng độ dabigatran dạng tự do hoặc toản phẩn. Lượng
thuốc bị loại bỏ nhờ thẩm phân thận tỷ lệ với tốc độ dòng máu. Hoạt tính chống đông máu của
dabigatran giảm khi nồng độ trong huyết tương giảm vả mối liên quan PK/PD không bị ảnh hướng
bời cách điếu trị nảy.
Nguời cao ruồi
Cảo nghiên cứu dược động học pha 1 chuyên biệt trên người cao tuổi cho thẳy AUC tảng khoảng
1,4 đến 1,6 lần (+40 60%) và Cma, tăng khoảng 1,25 lần (+25%) so với ở người trẻ tuôi
Giá trị AUC… vả Cmams ở những đối tượng cao tuổi nam giới và nữ giới {> 65 tuồỉ) cao xẩp xỉ 1,9
lần và 1, 6 lẫn đối với nữ giới cao tuồi so với nữ giới trẻ tuổi vả cao hơn 2, 2 và 2 ,0 lần đối vởi nam
gỉới cao tuỗi so với nam giới trong độ tuổi 18- 40.
Tăng nồng độ dabigatran được quan sảt có tương quan với sự giảm độ thanh thải creatinine liên
quan đên tuôi tảc.
Ánh hưởng của tưối tảc đến nồng độ dabigatran đă được khẳng định trong nghiến cứu RE- LY với
sự tảng khoảng 31% nồng độ đảy đối với những đối tượng_ > 75 tuối và giảm khoảng 22% nồng độ
đảy đối với nhũng đối tượng < 65 tuồi so với những bệnh nhân trong độ tưồí 65 và 75
Suv gan.-
T rong một nghiến cứu pha 1, nồng độ dabigatran không thay đỗi ở 12 bệnh nhân suy gan trung
binh (Child Pugh B), so sảnh với 12 người thuộc nhóm chứng.
Bệnh nhân Suy gan từ trung bình đến nặng (phân loại Child Pugh B vả C) hoặc mắc bệnh gan
được cho là có bất kỳ tác động nảo tới sự sông còn hoặc tăng men gan_ > 2 lằn giới hạn trên của giá
trị binh thường (ULN) được loại trừ trong các nghiến cứu lâm sảng
Cán năng:
Nồng độ đáy của dabigatran là thấp hơn khoảng 20% ở những bệnh nhân có cân nặng > 100 kg so
với bệnh nhân có khối iượng cơ thể tư 50 ~ 100 kg. Phần lớn bệnh nhân (80,8%) có trọng lượng_ >
50 kg và < 100 kg và không có khác biệt rõ rảng nảo được phảt hiện Dữ liệu vẽ những bệnh nhân
5 50 kg còn hạn chế
Giới tính:
'[Jrong các nghiên cứu ban đằu cho phòng ngừa TTHKTM, nồng độ thuốc tăng khoảng 1,4 đên 1,5
lân (+40% tới 50%) ở bệnh nhân nữ. Phảt hỉện nảy không có ảnh hưởng iâm sảng.
Chủng lỏc:
Dược động học cùa dabigatran được nghiên cứu trên người tinh nguyện da trắng và Nhật Bản dùng
liếư đơn hoặc đa liều. Chủng tộc không ảnh hưởng tới dược động học cùa dabigatran tới mức có
ảnh hướng lâm sảng.
Dữ liệu về dược động học của thuốc ở bệnh nhân da đcn còn hạn chế và không có gợi ý là có khác
biệt 1iên quan.
Tương tảc dươc đóng hoc:
Các nghìến cứu tương tảc in vitro cho thấy không có sự ức chế hoặc cảm ứng hệ cytochrome P450.
Điếu nảy đă được khẳng định bằng các nghiên cứu in vivo trên người tình nguyện khoẻ mạnh,
không thấy có tương tảc gìữa đìều trị dabigatran etcxìlat vả cảc thuốc sau: atorvastatin (CYP3A4)
vả diclofenac (CYP2C9)
Atorvastatín: Khi dabigatran được dùng đồng thời với atorvastatin, một cơ chẩt cùa CYP3A4, nổng
độ của atorvastatin, chât chuyên hóa atowastatin vả cùa dabigatran lá không thay đôi cho thây không có
sự tương tác.
DicIojènac: Khi dabigatran etexilat được dùng đồng thời với diclofenac, một cơ chất của CYP2C9,
dược động học cùa cả hai thuôo lá không thay đôi điêu nảy cho thây không có tương tác giữa
dabigatran etcxilat vả diclofcnac.
Các tương tác với chất ức chế/cảm ứng P-Ep
Tiến chắt dabigatran etexilat, mả không phải 1ả dabigatran, lả một cơ chất của chất vận chưyến
P-giycoprotein (P—gp). Do vậy việc dùng đổng thời với các chất ức chế và cảm ứng với chẩt vận
chưyến P-gp đã được khảo sảt.
Dù_g đồng_hời với chắt ửc chế P go
Amiodarone: Khi dabigatran ctcxilat được dùng đồng thời với một liếư đơn dạng uống 600 mg
amiodarone, mức độ vả tỷ lệ hấp thu cùa amiodarone vả chẩt chuyến hóa có hoạt tinh của thuốc
nảy lả DEA về cơ bản không thay đồi. AUC vả Cmax cùa dabigatran tương ứng lần lượt tăng
khoảng 1,6 lẳn vả 1,5 lần (+60% và 50%).
Dronedarone Khỉ dabigatran etexìlat vả droncdaronc được dùng cùng một thời điếm, cảc giá trị
AUCg00 vả Cmax cùa dabigatran tương ứng tãng khoảng 2 ,4 lẩn và 2, 3 lần (+136% vả 125%), sau
khi dùng đa liều 400 mg dronedarone hai lần môi ngảy, và khoảng 2,1 lằn và 1 9 lần (+1 14% vả
87%), tương ưng sau khi dùng đơn liếư 400 mg Thời gỉan bản thải vả thanh thải qua thận của
dabigatran không bị ảnh hưởng bởi dronedarone. Khi dùng đơn liếư vả đa liếư dronedarone 2 giờ
sau khi sử dụng dabigatran, AUCg.…tăng tương ứng gấp 1,3 lằn vả 1,6 lần.
Verapamil. Khi dabigatran etexilat được dùng đồng thời với verapamil dạng uống, Cmax vả AUC
cùa dabigatran tãng phụ thuộc vảo thời gian dùng và công thức của chế phẩm verapamii
Nồng độ dabigatran tăng mạnh nhất được quan sải sau khi dùng một liếư cùa dạng thuốc phóng thích
nhanh verapamii một giờ t1ước khi dùng dabigatran etcinat (Cmax tãng khoảng 2, 8 lần (+180%) vả
AUC tăng khoảng 2 ,5 lẳn (+150%)) Tác động giảm dần dần khi sử dụng dạng phóng thích chậm
(tăngC max khoảng 1,9 lần (+90%) vả AUC khoảng 1,7 lần (+70%)) hoặc dùng nhiếư liếư
vcrapamil (tăng Cmax khoảng 1 _,6 lần (+60%) vả AUC khoảng 1 ,5 lằn (+50%)) Điếu nảy có thế
được giải thích do sự cảm ứng P- -gp trong ruột do điếu trị verapamil kéo dải
Không có tương tác có ý nghĩa được quan sảt khi vcrapomii được dùng 2 giờ sau khi dùng dabigatran
etexilat (tảng Cmm khoảng 10% vả AUC khoảng 20%). Điếu nảy được giải thich đo dabigatran được
hấp thu hoản toản sau 2 giờ (xem Liêu lượng và cách dùng).
Không có dữ liệu sẵn có cho dạng tiêm của verapamil; dựa vảo cơ chế tương tảc, có thế không có
tương tảo có ý nghĩa.
Keloczonazole Ketoconazole toản thân gây tãng toản bộ cảc giá trị AUC…r vả Cmax của dabigatran
tương ứng khoảng 2 ,4 lần (+138% và 135%) sau khi dùng liếư đơn 400 mg, vả tương ứng khoảng 2 ,5
lần (+153% vả 149%) sau khi dùng đa iiếư 400 mg kctoconazole ngảy ] 1ần. Ketoconazole không ảnh
hướng đến thời gian đạt nồng độ đinh, thời gian bản thải và thời gian tồn lưu irung bỉnh trong cơ thể của
thưốc
CIarz'lhromycin: Khi sử dụng clarithromycin 500 mg hai lần mỗi ngảy cùng với dabigatran etexilat,
không có tương tảc dược động học có ý nghĩa trên lâm sảng được ghi nhận (tăng Cmax khoảng 15% và
AUC khoảng 19%).
Quinidine Quinidine được dùng với liếư 200 mg mỗi 2 giờ cho tới tống liếư 1000 mg. Dabigatran
etexilat được dùng hai lần môi ngảy trong 3 ngảy liến tiếp, vảo ngảy thứ 3 có h0ặc không có
quỉnidine AUC… và C…,,_,, của đabigatran tăng trung bình khoảng 1,5 iẩn (lần lượt +53% và
56%) với việc dùng đồng thời quinidine.
Ticagrelor: khi dùng liếư đơn dabigatran etexilat 75 mg một cách đồng thời với một liếư tắn công
ticagrelor 180 mg, AUC vả Cmax cùa đabigatran tương ứng tăng 1,73 lần và 1,95 lần (tãng 73% và
95%). Sau khi dùng đa liếư ticagrelor 90 mg hai lẩn một ngảy, tăng AUC vả Cmax cùa dabigatran giảm
đi, tăng tương ứng còn 1,56 lần và 1,46 lần (tảng 56% và 46%)
Dùng cùng với cơ chẩt cùa P-gn
Digoxz'n: Khi dabigatran etexilat được dùng cùng với digoxin, một cơ chắt P-gp, không có tưong
tảo về được động học được ghi nhận. Cả dabigatran và tiền chất dabigatran etexilat đến không ức
chế P-gp trên lâm sảng.
Sứ dung cùng với chắt cảm ứng P- -ED
szampz'cine: Cảc liếư thăm dò trước cùa chắt gây cảm ứng như rifamicine ở liếư 600 mg ngảy ] lần
trong 7 ngảy lảm giảm cả nồng độ đinh vả nông độ toản phần dabigatran tương ửng iả 65,5% vả
67% Tảc động gây cảm ứng bị giảm dần dẫn đến nồng độ dabigatran gân bằng với mức tham
chiếu ở ngảy thứ 7 sau khi ngùng điếu trị rifampicine. Không thẳy sinh khả dụng tãng thêm sau 7
ngảy nữa.
Sử dung cùng với các chất ức chế kết tân tiếu cầu
Acegzlsaỉycylỉc acid (ASA ) Tác động của việc dùng đồng thời dabigatran etexilat vả acid acetylsalicylic
(ASA) vế nguy cơ xuất huyết đã được nghiến cứu trên những bệnh nhân rung nhi trong một nghiên cửu
pha 1! trong dó víệc sử dụng ASA ngẫu nhiên được ảp dụng. Cản cứ vảo phân tich hồi qui logistic, việc
sử dụng ASA cùng với dabigatran etexilat 150 mg hai lần mỗi ngảy có thế lảm tăng nguy cơ gây chảy
mảư từ 12% đến 18% và 24% tưong ứng khi dùng liếư 81 mg và 325 mg ASA.
Từ các dữ liệu thu được trong nghiến cứu pha III RE-LY, đã qụnn sát thấy ASA hoặc ciopidogrel sữ
dụng cùng với dabigatran etexilat ớ liếư 1 10 hoặc 150 mg hai lần mỗi ngảy có thể gây tăng ngưy cơ
chảy mảư nặng. Tưy nhiên tỷ lệ biến cố chảy máu cao hơn khi dùng cùng vói ASA hoặc clopidogrel
cũng được ghi nhận đối với warfarin.
Sử dụng NSAID để giảm đau trong thời gian ngắn trước hoặc sau phẫu thuật không lảm tăng nguy
cơ chảy máu khi điếu trị kết hợp với dabigatran etexilat. Bằng chứng về việc sử dụng thường
xuyên NSAID có thời gian bán thải dưới 12 giờ trong quá trinh điếu trị với dabigatran etexilat còn
hạn chế vả chưa cho thẳy tăng nguy cơ chảy mảư.
Clopidogrel: Trong một nghiến cứu pha [ ở nam giới tình nguyện khỏe mạnh, việc sử dụng đồng
thời dabigatran etexilat vả clopidogrel không lảm kéo dải thêm thời gian chảy mảư mao mạch
{capillary blceding time) so với đơn trị liệu clopidogrel Thêm vâo đỏ, AUCTss vả Cmax_SS cùa
dabigatran vả các xét nghiệm đông mảư để đánh giá tác dụng cùa dab1gatran như aPTT, ECT, hoặc
TT (khảng FIIa) hay xét nghiệm đảnh giá khả năng ức chế kết tập tiếu câu ( IPA) của clopidogrel
về cơ bản là không thay đồi khi điếu trị kết hợp so với cảc đơn trị líệu tướng ứng Với một liếư
clopidogrel ban đấu lến tới 300 hoặc 600 mg, AUCLss vả Cmam cùa dabigatran tảng khoảng 1 ,3
đến 1,4 lằn (+30 tới 40%) (xem cảc mục ở trên vê ASA)
Các chất chống kết tập Iiểu cầu và chống đông máu khác. Sử dụng đồng thời dabigatran etexilat
và các chất chống kết tập tiếu cầu h0ặc chống đông máu khác có thề lảm tăng nguy cơ chảy máu
(xem Cảnh bảo đậc biệt vả thận trọng)
Sứ dung đồng thời với cảc chẳt ức chế tái hấp thu serotonin có chon loc:
SSRIS iám tăng nguy cơ chảy mảư trong tât cả các nhóm điêu trị trong nghiên cứu RE-LY.
Sứ dung cùng với các chầt lảm tăng DH da dảv
Pantoprazole: Khi dabigatran được sư dụng cùng với pantoprazole, đã quan sát thấy giảm diện tich
dưới đường cong nồng độ - thời gian trong huyết tương cùa dabigatran khoảng 30%. Pantoprazole vả
các chất ức chế bơm proton được sử dụng cùng vói dabigatran etcxilat trong cảc nghiên cứu lâm sảng
và không ghi nhận ảnh hướng lên tình trạng chảy máu hoặc hiệu quả.
Ranitt'dine: Sử dụng ranitidíne cùng với dabigatran etexilat không gây ảnh hưởng có ý nghĩa tên
mức độ hấp thu cùa dabigatran.
Những thay đồi trong nông độ dabigatran, được xảo định bằng phân tich dược động học dân số,
gây ra bời thuốc ức chế bơm proton (PPI) và các thuốc kháng acid được xem lá không có ý nghĩa
lâm sảng do tảc động ít (giảm rât ít sinh khả dụng, khỏng đáng kể đối với thuốc khảng acid vả
14,6% đối với cảc PPI Trong nghiến cứu pha III, RE- LY, sữ dụng cùng với PPI không lảm giảm
nồng độ đáy vả nhìn chung chi gây giảm nhẹ nồng độ sau khi dùng thuốc (…11%). Do vậy, sữ dụng
cùng với PPi dường như không lảm tăng tỷ lệ đột quỵ hoặc SEE, đặc biệt trong so sánh với
warfarin, vả vì thế, giảm sinh khả dụng do sử dụng cùng với pantoprazole được cho là không có ý
nghĩa lâm sảng.
Điều kiên bảo uuản
Dạng vỉ :
Bảo quản nguyên trong bao bì dế tránh ẩm. Bảo quản không quá 30°C
Dạng chai :
Sau khi mở chai, chỉ sử dụng thuốc trong 04 tháng. Đóng chặt nắp chai thuốc để tránh ấm. Bảo
quản không quá 30°C.
Trình bảv `
Viên nang cứng tương ứng 75 mg, ] 10 mg.
Hộp carton chứa 1, 3, 6 ví x 10 viên; một lọ 60 viên;
Han dùngq '
36 tháng kế từ ngảy sản xuât
Sản xuất bởi
Boehringer Ingelheim Pharma GmbH & Co.KG
Binger Str. 173 5 5216 Ingelheim am Rhein, Germany.
ĐỂ XA ỊÀM vớt CQA TR_Ẻ ’ \
Đọc Ky HƯOỊNG DAAN sư DỤNG TRỰơợ Km DUNG
NEU CAN THEM THONG TIN XIN HOI Y KIEN BÁC sỹ
PHÓ cuc muờnc
O/VMỗn GÌẵỆtỡẩay
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng