




















1 READ CAREFULLY THE LEAFLEI' BEFORE USE
zo…mo … xs 01 w … uun
ma…vp …
|ijuzurpp asumư '…
samsdeo mm 01 x s
8… ogl …exept-nd
Each hard capsule contains 172.95 mg dabigatran … … Ị
etexilate mesilate equivalent to 150 mg dabigatran >< … m
. Q 0.
etex1late 8 3 N
contains sunset yellow (E 1 10) =,- ou ả
(see leaflet for further information) N o
Oral use 3
Do not chew 8
Store in the original package ìn order to protect from 8
moisture Ễ-
Do not store above 30°C
KEEP OUT OF THE REACH OF CHILDREN
Rx
Mõi viên nang chứa 172,95 mg dabigatran etexilate
mesilate tuong đương với 150 mg dabigatran P fa d axa ®
etexilate ' '
Chứa sunset yellow (E110) DB b1gatra I'I etex1late
(Tham khảo thém trong tờ huóng dãn sử dụng) _
Không được nhai 1 50 m 8
Bảo quản nguyên trong bao bì để tránh ấm
Bảo quản không quá 30°C
ĐỂ XA TÃM TAY TRẺ EM 3
. . x 10 hard ca sules
ĐỌC KỸ HƯỞNG DÃN sư DỤNG mước KHI DUNG p
TH uóc BÁN THEO ĐơN
Dùng đuờng uống 0
Hộp 3 ví x 10 viên nang cứng 2
cm đinh, chõng chỉ định, cách dùng vả các thỏng tin ẫ
khác: xin xem trong tờ hưởng dãn sử dụng
SĐK:
Manufactured by/SX bởi: q 'ỳyh Ồ
Boehringer ĩngeiheim Pharma GmbH & Co KG ' ' '
Binger Str. 173 1 Boehringer
552161ngelheim am Rhein. Germany l___lngelheỉm
. . . Mandatory ỉn D" E " G
Fìle mformahon . m -- Primtìle , . , «
Issue date oíTD~ __ _30.06 201] __ Yes Yes
PPM SKU' _ POPWlL _ _ No _ VES
WM SKU vemon- —OOI No Yes ' | _
Issue date olznwork _429. MAR 2012 __ _ . No Yes MASS D 05 n.…
Prìmcokỉi PAN ôễ9 PAN 293 . PAN BLACK No Yes HASÊ E ] r mm
PAN au ’ ' ` J
_— MASS Cl `..O mm
› _ _ , . __
Mal. No. Patk. Slte. 300990—0] No Yes
Í * ' anmple
— - _ ~ …_ _ _ Technical ~nímrnarion
Legend case version V] 0 OlllLN/2OW lulease co noi cnenge or remove ~l) Ĩ ControlCodeĩype: LaelusCode
Ẹ:bnical information _ _ _
a=Bafch No D=Expưy d.… _ _
c= Manu'aclu mg date [ c! = Puce/SamclvlCin c
Technical colon _ _ _
Bl- Dlec ụt Legtrdc ase . F'ee MEa 1 ] Bleacquev-lree E
| A
Additional Requirements_gf Packaging sitỳe_
Yernplale rame TD-FỀSẺ7xISSJPJ ] Index a __
Mìnưruh Fonlscze ln AW Sol B[SansNext
[ W
Ủn
»Ễ
"đoO
:::ẹg
z-<
ẵă
-ạ%
samsdeo pmq 01 x
300990-01
j
nm lac ~ .; … m
. 0 x… ma
Wũ iad ~ 0 1²²0 lad
JfflmP'd
ỦNIWb \ u ìthpij
affl²fflad
mulm 0 \ % mu p›a
»… Im ~
.… ..…
W. .… « .... u … ….. u
… F V Y Y V. V Y
…
M m Yu No … m … M
. … … … \
_
… … _
… _
. … _ . …
.…. … \
.. I ..… ..…. ..
I… … …. . ... …. . .…
0 m.. N M
H W … u & .… W… x… .. . … x …
1 G K. .. U ư P. 0 i\
…… … .… .q. … m … n … w …»
.… .… . … … …
.: c … n s … n .… u … e ... w …
0 n … … a … H - … … u & … … .… .… :
m….……… .… … .………….…… …..……J…
……ỉ...… . .….………… ...…
ũ…uu……. a u. a.…mm d…memư
F BWWh…F…\ …M …. Ta..hũ ẢkAdưs...
.… ỗz
ẾỔArỸ …OÀA 0
T G H H Ổ0
N N N P W ù.
! \.uOH.W. .…u M 8.8ỄMvvv
. ủ . | ..… .ffl * . .. . … eẫỄ sẵẵ. … eẵẵ.
… . G A A. .… C ..…ẵ … … .ỄuỂ .…ẩỄ …. … …ẵEẵ
… …s..° .WẾĐ \ A%… 8 .8 nẩEEẹuư-ẽẫ … … 9.8 u:ẢEì%—ễ 9..8 nẫẵ.Ẻẫ … … u….ốễẽM-ỄỄ
… :Ễầs . ..ỂỄ A. Ế ẻỉẳẵ.ẫ … … sẵ...ầ:ễẳẫaz M N e.…ẵỂủễẫ—ẫas … … eỄâsầẽgẫẳuỉ
… … m… z. m:.om… … … wc.o…… … … mc.o…… … … …c.om…
… Ễ \ » Ễẫẵ … … ẾỄẫẵ ». v Ễẵ … … Ễẵ
u metm.ĩ 0 Ở mmem.ỉ .o .u @XơUỂn— đ … Ờ metơ.ỉ …. .o @XNUỂE
. . .. \ \ . \ ..... \ . \ ...….Ễ.\
… ửuỄ .Ễử = m … … H……uỄ .ẵổể … … ẫ€Ển
% 0x 60 M:QỄỌUOuEIẾ O.: .ou Ẹc-uouuuỄnzs % W On .3 ẺỄEÉỒOQỄUỄ … 08 60 %ẵEEMWỄEẾ % 3 o…. .8 3:EWOỄỄ
… E.…ẵẫt :Ễẵsz …. u EỄỄ... .Ẻẫẵzz … … eỄ.ỄỀ :EỄỄẵ. … … W .:...Ềs Eẵẫẵ. … … ..ỄỀỄ ......ẵằes
… mc.o…… … … mp.o…… … … wc.om… mc.om… … … …:.om…
meUm.ỉ 0 ở NmeNỉ …… . NXGUEn— 9 … ũ meDPỉ . NXNUN.Ể
!. . \ . u\ 5? -uS . E…oEunẵ
« …EỄẺ. ~ Ổ .HưnhỄ … … -Ểuủ w … w ầni.Foen … … .…Ễẵuẵ
… … uỵổnsửouo.ẵã … … oỵ.8uzễõ.ễ » …» uỵ.eụuãưhuuễễ … … … o….8uaẵễẳ …… ….. o….ổnãỄễẫ
… EỀ1Ể .…ỄỄ … … EỄỄ. .ỄụẵÌ 8: m « :::... ...…czgẫẵuỉ … m. E.:ìỂ .Ẻẵ ẵ 8: m … .:.:1-s. ẽỂnẵE:
Ì S Ầ X
… …:.om… mc.o…… … … wc.o…… mc.om… .… . w:.o……
. … Ễẫẳ.ẵ Ễẫẫ …. … w. …BỄẳ t.. «1 .. .…..uJì. . ` w …. Ễễ
.u metm.ỉ NXNUN.Ể . . @XWUEL mxmbm.ỉ . NXNUN.ỉ
. un . Ế:
… Ề... .…....……….....… . . ......Ễ … … ..….........
… … 3.8 uãeổvễẵ 9. .ổnfieủễễ … … 9.8 nẵnủuoễẫ 9.8 .nEỄWỄỄ .» M 9. .8 uaỄõ-ỄỄ
… EỄ.oẵ ủuẵẫẵ.ẵ … ẵỄsẫẽỂnẵuỉ …… « eỀz—zủẽgẫẵuỉ W u e.Ễs.ủ.Ễẫ %. uỉ … … ....ỄỄ. .ỄẵỄ ...ì
. s P .. ..
.… mc.o…… … … …:.o…… … … mc.o…… … … wc.o…… … … …c.om…
… … Ễẫẵ ». m. Ễẫẵ w w …ẵỄẫă ». …SỄỄẽIỗ … … Ễẫẵ
… . meUm.ĩ J ở mmem.ĩ n . .o NXNUPỂ J ở metm.ĩ . . . NXNỉN.Ể
. _ … .
. nỂ
… .ễẵav mm .ẵẵ … … .ẵỄ wm .ỄỄ … … .ẵỂ…
% 01.00 h:hnưw…W-Ễẵa Wl. Wu 0: .cOU:nnttfflO-Ễẵs … %. Ozỏuncủcỉũmvnễ … W 0860 0: AEU:EHẾ W W 9. .00 Ẹ:MụũỄ…ẫ
. w... ẫễẵẳẽ:ẫẵaz … m. ..:-s.…sz €ẽẵẫẵ. … n. ...ỄMỄ ..ỄỀaz … … EỄỄ... ễtâẵẵ. n. ….. ..:...Ềsb s...…ẵkEs
.… wc.o…… wc.om… … … oc.o…… mc.o…… … … wc.o……
meUơ.ĩ meUFĩ . @XmUN.ỉ … NXNUN.Ể NXNUN.ỉ
...mu sẵỄ aễ&s … .m… s.ẵẵ. uẵ…ẵ D… :Ểỉs
…. .… .ẳ .…Ễãẵ .. n _ … .… .…..Ễwã ẫẳẵ . …. .… …Ễsẵ
› ỂnỄ
… M .… OxGUÙ:ỄuOÓnEÌẾ 0x dUỦẸIMủỮOỄEL M … N .… OdeẺỄỦỄỄ OxỏUWẵn—cMWỄ-ễu W N .… uzỏỤd nỉuủễlt
mffl EĨE... .Ễsnẵes u… u… Esiẵ :.zẫaẵỉ … … mffl :.Ễầsz Ễ.ẵuẫì u… % e....zỂa Eẫẵẵ. … … W…Ểễỉ .Ễẫầẵ.
›!
…J …Eo…… … … wEo…… … …f …Eo…… ……m wEo…… … … f …Eo……
a ẫễẵ … … Ễẫ … m Ễẳẵ …— ….q ẳmẵẫ … … Eễẫả
… uxẵmỉ a …. mẫumỉ w … mẫumỉ .… … & mẫumỉ … … mẫumỉ
\\ẵ \- .- \ \ \ \ . \ \ \ . . \ \ \
..P aẫ…ẵ ...ẫẽ. … @… aẫa... - sẫẵ. … M… eẫẫ. …
n … ẵ.Ễẵ .Ễẵẵ « n .… .Ễẵẵ ẳ.Ễẫ … . n … …Ễẵẵ «
…. .m 6 ›:nỄỔnE .e ›:ỄoOaỄ W …. … …uỵduẵỉỉủnễ.ẫ Uz.ouhỄ:EijủuEẵẫ W W .… 0sđUU:ỄỄSI
… ẽmulw..u ễửnuỀỉ M N E.…ưnầwW .Ễ8nẳi … … MẸEÌS :ỀSnỄES W % EỄỀỄ ..Ếgẳỉ … … WESÍỂỀ:EỄỄES
…J wc.o…… … … m:.om… … … J. mc.o…… q … …:.omffl … … J wc.o……
… Ễẫẵ x. 4 ỄỄ.Ể … … …SỄỄ … ….q ẫễẵẵ w … ……Ễẫẵ
., @XmUm.ỉ 0 ở NXNUG.Ể .. .. mmeÊẸ 0 ở QXNUN.Ể .. . metm.ỉ
. .n.…… s…ẻằ: \\D Ổ e…zỂs %… ...ẫaz \ \b P sẫ.ẵ M… e…eỀ...
…. … ẫỂẵG .…ễfã … u .… .ỄEẫỂ u… u. ..ẵaẫ … … … ỄEỂ
M .… . ỀnỄỗ E.: W W . Ềnẫu …. … … xã n:dRoúụỄit P .Il Qx.ouu:nnEhuoonẺnf … % .… 0z.80:ủonWnỄỄ
…..W EỦ.tnw.ễạềuẳ M … E…mẫu. Ễh.ửtẵ … MM E.…gtuwt €.WSẺES … m. eẫs.ucỉẫsẳỉ « « WEỄỄ. ...:.ẵẫs:
1 l 5 . S 1 B S
…J …Eo…… …Eo…… … …f mEom… wEo…… ….… wEo……
W Ễẫẵ Ễẫẵ W … W …BỂẳmỗ ẾỄ ễễl:uEỉO
nỗ ỄỄ
nm lac f Q 1… ma
ẾỂ Ễẵ
mẫuaằ
E…ẵoun.
.uẽaơẵ
Ế!EỔ
9. .8 a 5 nỄnf
Efỉẵ
Ể
Ễ Ễẵ
mẫumỉ
B…ẵổi
.Ễzẫ
›ẫEiu
S .8 ! nED SEỄ
E.:Eẵ .
Ể
Ễ
uxẵuỉ
n:mqpaạ @ ~ ven pad
E…uấơẵ
ỉễnoẵ
›:uEìo
08 .nO …- nỗ nỄnf
Ể
w—5Ễ ẫễ
mxẵmỉ
ở……
...…zỄ...
.…2Eẵ
ỀnỄo0
08 .oO ! S qỄaf
Ể
…...Ểẵ
mxmuuỉ
eẫẳ.
..Ểă
Ềaẫ
9. .8 1 củ nỄ-f
mm… 15 °] um P²d
Ể
Ễẳ
mẫumỉ
B…uấnuắ
…uỂoẵ
Ềuẵ
@: .ou i EU nEỉf
m:.om…
Ế…Ễmẵỉ
l…oãẵ:
ồỂoẵ
Ểuẵ
.Ể... ....ễ
mc.o……
E.ễ ẳẵ
.…ẫumỉ
căỀẵ
Eẵ ẵ &:
E.!onn &: E!
tzuẵ ..Ề ĐỂ
Eẵ... … :Eẵ Ề z:
eỄỄ. .… ......ẵ 5. ẵ.
ezi... : .ỄS. ..s ...:
......ẵs : Ễẵ 5. a:
.Ễẳ s.... &:
ONIdXI 115 U 05 N>Wl
\
'CIN/II! 1“ OI OSIW
Wu! —'XS OI PS NW
IIWm²XSW9SI®H
MJK! 'rsvưnmưn
²ũWdũ ²XS 0! 95 ^P“l
UMIlXJ #5 °I95 I'PlW
WIKFXấOIỸSẦPUI
WĐG ĩXSOWỉ/Mm
0%
PRADAXA®
Dabigatran etexilate
THUỐC DÙNG THEO ĐON BÁC SỸ
Thânh phần
] viên nang chứa 86,48 mg, 126,83 mg hoặc 172,95 mg dabigatran etexilate mesilate tương dương
với dabigatran etexilate dạng bazơ 75 mg, 110 mg hoặc 150 mg.
Tả dươc:
Tanario acid, acacia, hypromellose, dimethicone 350, talc, hydroxypropyl cellulose.
Vỏ nang HPMC: Carragenan, potassium chloridc, tỉtanium dioxide, Sunset Yellow (El 10), Indigo
Carmin (E132), hypromellose.
Mực in: Shellac, N—butyl alcohol, isopropyl alcohol, industrial methylated spirit, Iron oxide black
(E172), nước tinh khiết, propylene glycol.
Chỉ đỉnh
Phòng ngừa tai bíển thuyên tắc huyết khối tĩnh mạch (TTHKTM) ở những bệrih nhân người trưởng
thảnh trải qua phẫu thuật chương trình thay thế toản bộ khớp hảng hoặc khớp gôi.
Phòng ngừa đột quỵ, thuyên tắc hệ thống và giảm tử vong do nguyên nhân mạch máu ở những bệnh
nhân rung nhĩ.
Liễu lương và cách dùng
Nên uống PRADAXA viên nang cứng với nước, cùng hoặc không cùng với thức ăn.
Không mở viên nang.
%
Người lởm ?
Phỏng ngừa tai biến thuyên tắc huyết khối tĩnh mạch (TTHKTM) sau phẫu thuật thay thế khởp gối.
Nên bắt đầu điều trị với PRADAXA đường uống trong vòng 1 -4 giờ sau khi phẫu thuật xong với
một viên nang duy nhắt (110 mg) sau đó tiếp tục uông 2 viên nang một lần mỗi ngảy trong tổng cộng
10 ngảy. Nếu việc cấm mảu chưa dược bảo đảm, nên trì hoãn khớỉ dầu điều trị Nếu không bắt đầu
dùng thuốc ngay trong ngảy tiến hảnh phẫu thuật nên bắt đầu điều trị sau đó với 2 viên nang, một
lần mỗi ngảy.
Phòng ngừa tai biến thuyên tắc huyết khổi tĩnh mạch (TTHKTM sau phẫu thuật thay khóp háng
Nên bắt đầu điều trị với PRADAXA đường uống trong vòng 1-4 giờ sau khi phẫu thuật xong với
một viên nang duy nhất (110 mg) vả sau đó tiếp tục với 2 viên nang một lần mỗi ngảy trong tổng
cộng là 28- 35 ngảy. Nếu việc câm máu chưa được bảo đảm, nên trì hoãn khởi dầu điều trị. Nếu
không bắt đầu dùng thuốc ngay trong ngảy tiển hảnh phẫu thuật, nên bắt đầu điều trị sau đó với 2
vỉên nang, một lần mỗi ngảy.
Phòng ngừa đột quỵ, thuyên !ẳc hệ thống và giảm !ử vong do nguyên nhân mạch máu ở những bệnh
nhân rung nhĩ.
Liều khuyến cáo dùng hảng ngảy của PRADAXA là 300 mg, dường uống với vỉên nang cứng 150
mg hai lần mỗi ngảy. Điều trị trong thời gian dải.
Trẻ em:
PRADAXA chưa được nghiên cứu ở những bệnh nhân <18 tuổi. Không khuyến cảo điều trị
PRADAXA ở trẻ em.
Suy thận:
Nên đánh giá chức năng thận bằng việc xác định độ thanh thải creatinine (CrCL) trước khi bắt đầu
điều trị với PRADAXA để trảnh điều trị cho những bệnh nhân suy thận nặng (ví dụ CrCL< so
mL/phủt). Chưa có dữ liệu hỗ trợ cho việc sử dụng thuốc ở bệnh nhân suy thận nặng (độ thanh thải
creatinine dưới 30 mL/phút); không khuyến cáo điều trị PRADAXA ở nhóm bệnh nhân nảy (xem
“Chống chỉ định”).
Trong khi đang điều trị, chức nãng thận nên được đánh gỉả trong một số trường hợp trên lâm sảng
khi nghi ngờ chức năng thận có thể suy giảm hoặc xấu di (ví dụ giảm thể tích tuần hoản, mẩt nước,
và với một sô thuốc dùng đồng thời, v. v. ).
Dabigatran có thể được thấm phân; Có rất ít kinh nghiệm lâm sảng cho thấy sự có ích của phương
phảp nảy trong các nghiên cứu lâm sảng.
Phỏng ngừajai biến TTHKTM'ở bệnh nhân sau đại pftẫu chinh hình:
Nên giảm liêu PRADAXA xuông còn 150 mg một lân mỗi ngảy, dùng 2 viên nang 75 mg ở những
bệnh nhân suy thận trung bình (độ thanh thải creatinine 30-50 lephút).
Phòng ngừa đột quỵ, thuyên tắc hệ thống và giảm tử vong do nguyên nhân mạch máu ở những bệnh
nhân rung nhĩ:
Ở những bệnh nhân suy thận trung bình (CrCL 30 - 50 mL/phút), chức năng thận nên được đảnh giá
ít nhất một năm một lần.
Không cần thỉết phải chỉnh liều, bệnh nhân nên điều trị với liều hảng ngảy 300 mg dùng đường uống
với viên nang cứng 150 mg hai lằn mỗi ngảy.
Người cao tuổi: <Ễ
%
Phòng ngừa tai bỉến TTHKTM ở bệnh nhân sau đại phẫu chỉnh hình:
Kinh nghiệm lâm sảng về sử dụng thuốc cho bệnh nhân cao tuổi (>75 tuổi) vẫn còn hạn chế. Nên
thận trọng khi điều trị cho dối tượng bệnh nhân nảy. Liều khuyến cảo là 150 mg mỗi ngảy dưới dạng
2 viên nang 75 mg (xem phần “Cảnh bảo dặc biệt và thận trọng” vả “Đặc tính dược lý học”).
Do suy giảm chức năng thận có thế thường gặp hơn ở người cao tuổi (>75 tuổi), nên dánh giả chức
năng thận bằng việc xác định độ thanh thải creatinine (CrCL) trước khi bắt đầu điều trị với
PRADAXA đề trảnh điều trị cho những bệnh nhân suy thận nặng (tức là CrCL<30 mL/phút). Chức
năng thận cũng nên được đánh giá trong một số tình huống lâm sảng khi có nghi ngờ chức năng thận
suy giảm hoặc xấu đi (ví dụ giảm thể tích tuần hoản, mất nước và với một số thuốc dùng đồng
thời,v.v.,).
Phỏng ngừa đột quỵ, thuyên lắc hệ thống và giám tử vong do nguyên nhân mạch máu ở những bệnh
nhân rung nhĩ:
Do suy giảm chức năng thận có thể thường gặp hơn ở người cao tuổi (>75 tuổi), nên đánh giá chức
nãng thận bằng vìệc xảo định độ thanh thải creatinine (CrCL) trước khi bắt đầu điều trị với
PRADAXA để tránh điều trị cho những bệnh nhân suy thận nặng (tức CrCL<30 mL/phút). Chửc
năng thận cũng nên được đánh giá ít nhất mỗi nãm một lần ở bệnh nhân dìều trị với PRADAXA
hoặc thường xuyên hơn trong một số tình huống lâm sảng khi có nghi ngờ chức năng thận suy giảm
hoặc xâu đi (ví dụ gỉảm thể tích tuần hoản, mất nước và với một sô thuốc dùng đồng thời, v. v. ,)
Bệnh nhân 80 tuổi trở lên nên được điều trị với liều hảng ngảy 220 mg dùng đường uống với viên
nang cứng 110 mg hai lần mỗi ngảy.
Cảo nghiên cứu dược động học ở bệnh nhân cao tuổi hơn cho thấy có tăng nồng độ thuốc ớ những
bệnh nhân suy giảm chức năng thận do tuôi tảc.
Xem thêm phân Liêu lượng và cảch dùng mục suy thận.
Cân nặng:
Không cần thiết phải chỉnh liều.
Sử dụng đồng thời PRADAXA với các chất ức chế mạnh P-glycoprotein, ví dụ amỉodarone,
quinidine hoặc verapamỉl:
Phòng ngửajai biến TTHKTM ở bệnh nhân sau đại phẫu chinh hình:
Nên giảm liêu` PRADAXA còn 150 mg dùng một lân mỗi ngảy với 2 viên nang 75 mg ở những bệnh
nhân dùng đông thời PRADAXA vả amiodarone, quinidine hoặc verapamil (xem “Tương tảc
thuôo”).
Nên tránh việc bắt đầu điều trị với vcmpamii Ở. những bệnh nhân sau đại phẫu chỉnh hình mà đang
sử dụng PRADAXA. Cũng nên trảnh việc băt đâu điêu trị đông thời PRADAXA với verapamil.
Phòng ngừa đột quỵ, thuyên lắc hệ thống và giảm tử vong do nguyên nhân mạch máu ở những bệnh
nhân rung nhĩ:
Không cần thiết phải chỉnh liều, bệnh nhân nên điều trị với liều hảng ngảy 300 mg dùng đường uống
với viên nang cứng 150 mg hai lần mỗi ngảy.
Bệnh nhân có nguy cơ chảy máu:
Phòng ngừa đột quỵ, thuyên tắc hệ thống và giám tử vong do nguyên nhân mạch máu ở những bệnh
nhân rung nhĩ
Sự xuất hiện của cảc yếu tố sau có thế lảm tăng nguy cơ chảy máu: ví dụ tuối Z 75, suy thận trung
bình (CrCL 30-50 mL/phút), điều trị đồng thời với các chất ức chế P-gp mạnh (xem “nhóm bệnh
nhân đặc biệt”), chất chống kết tập tiếu cầu hoặc chảy mảu dạ dảy- ruột trước đó (xem “Cảnh báo
đặc biệt và thận trọng’ ’) Đối với những bệnh nhân có một hoặc nhiều hơn một trong các yếu tố nguy
cơ đó, giảm liều hảng ngảy còn 220 mg, bằng cách uống 110 mg hai lần mỗi ngảy, có thế được cân
nhắc theo quyết định của bác sỹ.
Chuyển từ điều trị PRADAXA sang thuốc chống đông dạng tiêm: ẫỄ
Phòng ngừa tai bíển Ĩ'I'JHKTM ở bệnh nhán san đại phễu chinh hình: . '
Chờ 24 giờ sau liêu cuôi cùng trước khi chuyên từ điêu trị vởi PRADAXA sang một thuôo chông
đông dạng tiêm.
Phòng ngừa đột quỵ, thuyên lắc hệ thống và giảm tử vong do nguyên nhân mạch máu ở những bệnh
nhân rung nhĩ: \ . ’ `
Chờ 12 giờ sau liêu cuôi cùng trước khi chuyên từ điêu trị vởi PRADAXA sang một thuốc chông
đông dạng tiêm.
Chuyển từ điều trị thuốc chống đông dạng tiêm sang PRADAXA:
Nên dùng PRADAXA o - ; giờ trước khi đến lủc dùng liều tiểp theo của trị lỉệu cảch quãng, hoặc tại
thời điếm ngừng dùng thuôc trong trường hợp trị liệu liên tục (ví dụ Heparin đường tĩnh mạch).
Chuyển từ điều trị với các thuốc đối kháng Vitamin K sang PRADAXA:
Phòng ngừa đột quỵ, thuyên tắc hệ thống vả giảm tử vong do nguyên nhân mạch máu ở những bệnh
nhân rung nhĩ:
Nên dừng việc điểu trị với chất đối kháng Vitamin K (viết tắt VKA). PRADAXA có thể được dùng
ngay khi INR < 2,0.
Chuyển từ đỉều trị PRA DAXA sang các thuốc đối kháng Vitamin K:
Thời đỉếm bắt đầu điều trị VKA nên được điểu chinh theo độ thanh thải CrCL của bệnh nhân như
SâUI
. CrCL a 50 mL/phủt, bắt đầu dùng VKA 3 ngảy trước khi ngững sử dụng dabigatran etexilate
. CrCL a 30 - < 50 mL/phút, bắt đầu dùng VKA z ngảy trước khi ngừng sử dụng dabigatran
etexilate
Chuyển nhịp:
Phòng ngừa đột quỵ, thuyên tắc hệ thống và giảm tử vong do nguyên nhân mạch máu ở những bệnh
nhân rung nhĩ. . ’
Bệnh nhân có thẻ tiêp tục dùng PRADAXA trong khi đang được chuyên nhịp.
Quên liều:
Phòng ngừa tai bíện TTHKTM ở bệnh nhân sau đại phẫu chỉnh hình: ,
Tiêp tục với cảc liêu dùng hảng ngảy còn lại tại cùng thời điêm cùa ngảy tiêp theo.
Không được dùng liều gâp đôi đê bù vảo các liêu riêng lẻ bị quên.
Phòng ngừa đột quỵ, thuyên tắc hệ thống và giám tử vong do nguyên nhân mạch máu ở những bệnh
nhân rung nhĩ: ' ' ` .
Liều bị quên của PRẠDAXA có thế được dùng nêu thời gian tới khi phải dùng Ịiêu tiêp theo là hơn
6 gìờ. Nên bỏ qua liêu bị quên nêu khoảng thời gian trước khi phải dùng liêu tiêp theo không quá 6
giờ. . `
Không được dùng liêu gâp đôi đê bù vảo các liêu riêng lẻ bị quên.
Chống chỉ đinh Ề
~ Quá mẫn với dabigatran hoặc dabigatran etexilate hoặc một trong các tá dược của thuốc
- Suy thận nặng (CrCL < 30 mL/phủt)
' Cảc biền hiện chảy mảư, bệnh nhân có cơ địa chảy mảu, hoặc bệnh nhân giảm đông mảư do dùng
thuốc hay tự phảt
' Các tổn thương ở cơ quan có nguy cơ chảy mảư cao trên lâm sảng, bao gồm đột quỵ xuất huyết
trong vòng 6 tháng
' Điều trị đồng thời với ketoconazole toản thân (xem tương tác thuốc)
. Điếu trị đồng thời vởi cảc thuốc chống đông khảo như heparin (UFH), cảc hepan'n trong lượng
phân từ thấp (như enoxaparin, dalteparỉn), các dẫn xuất heparin (như fondaparỉnux), thuốc chống
đông đường uống (như warfarin, rivaroxaban, apixaban) ngoại trừ trong những trường hợp
chuyền sang hoặc chuyến từ Pradaxa hoặc khi UFH được dùng ở những liều cân thiết để duy trì
thông thương catheter động mạch hoặc tĩnh mạch trung tâm..
. Bệnh nhân đặt van tim nhân tạo cơ học.
Cảnh báo đăc biêt và thân trong
Nguy cơ xuất huyết:
Giống như các thuốc chống đông khảo, nên sử dụng PRADAXA thận trọng trong các trường hợp có
tăng nguy cơ gây chảy mảư. Chảy mảư có thể xuất hiện tại bất cứ vị trí nảo trong quá trình điều trị
vởi PRADAXA. Nên tỉm kiếm nơi chảy mảu nếu hemoglobin vảfhoặc hematocrit hoặc huyết áp
giảm mả không giải thích được ngưyên nhân.
Điều trị vởi PRADAXA không yêu cầu theo dõi chống đông máu Xét nghiệm INR không tin cậy ở
những bệnh nhân đang điếu trị với PRADAXA và đã có bảo cáo về tăng INR dương tính giả. Do
vậy, không nên tiển hảnh xét nghiệm INR
Xét nghiệm đảnh giá hoạt tinh chống đông mảư như thời gian trombin (TT), thời gian đông mảu
ecarin (ECT) và thời gian thrombopiastin từng phần hoạt hóa (aPTT) có thế được dùng để phảt hiện
hoạt tính quá mức cùa dabigatran.
Tình trạng chống đông liên quan dabigatran có thể được đánh gìá bởi ECT hoặc TT. Nếu không có
ECT hoặc TT, xét nghiệm aPTT giúp đánh giá tương đối mức độ chống đông mảư cùa PRADAXA.
Ở những bệnh nhân rung nhì trong thử nghiệm RE-LY điều trị với 150 mg hai lặn mỗi ngảy một gỉá
trị aPTT cao hon 2,0 — 3,0 lân giới hạn bình thường tại nông độ đảy liên quan đên nguy cơ tăng chảy
mảư.
Cảo nghiên cứu dược động học cho thấy có tăng nồng độ thuốc ở những bệnh nhân suy giảm chức
nảng thận do tuôi tảc. Chông chỉ định dùng PRADAXA trong những trường hợp suy thận nặng
(CrCL < 30 mL/phút).
Nên ngừng sử dụng PRADAXA ở những bệnh nhân bị suy thận cấp.
Các yếu tố, như suy giảm chức năng thận (CrCL 30- 50 mL/phủt),_ > 75 tuổi, hoảc đang điều trị chất
ức chế mạnh P-gp có liên quan đến tăng nồng độ dabigatran huyết tương. Sự xuất hiện của một hoặc
nhiều hơn các yêu tố nảy có thể lảm tăng nguy cơ chảy mảư (xem liều lượng vả cách dùng)
Víệc sử dụng đổng thời cùa PRADAXA với cảc trị liệu sau đây chưa được nghiên cứu vả có thể gây
tăng nguy cơ chảy mảu: heparin (ngoại trừ khi dùng với liều cẳn thiết để duy trì thông thương
cathcter tĩnh mạch trung tâm hoặc động mạch) vả cảc dẫn xuất heparin, heparin trọng lượng phân từ
thấp (LMWH), fondaparinux, desirudin, cảc thuốc lảm tan huyết khối, cảc thuộc đối khảng thụ thể
GPHb/IIIa, ticlopìdine, dextran, sưlfinpyrazone, rivaroxaban, prasugrei, cảc thuốc đối kháng vitamin
K, các thuốc ức chế P-gp, itraconazole, tacrolismus, cyclosporine, ritonavir, tipranavir, nelfinavir vả
saquinavir.
Sử dụng đồng thời vởi dronedarone lảm tảng hấp thu dabigatran vả không được khuyến cảo (xem
“Nhóm bệnh nhãn đặc biệt”).
Sứ dụng đồng thời với ticagrelor lảm tảng hấp thu dabigatran và có thế cho thẳy tương tảc dược lực
học dân đên tãng nguy cơ chảy máu.
Nguy cơ chảy máu có thể tăng lên ở nhũng bệnh nhân điếu trị đồng thời với cảc chất ức chế tải hấp
thu có chọn lọc serotonin (SSRI) hoặc cảc thuôo ức chế tải hâp thu serotonin norepinephrine (SNRI).
Sử dụng các thuốc lảm tiêu sợi huyết trong điểu trị đột quỵ do thíểu máu cục bộ cáJn:
Víệc sử dụng cảc thuốc lảm tiêu sợi huyết trong điếu trị đột quỵ do thiểu mảu cục bộ cấp có thế được
cân nhắc nếu bệnh nhân có thời gian thrombin (TT), hoặc thời gian đông máu Ecarin (ECT), hoặc
thời gian thromboplastin từng phần hoạt hóa (aPTT) không vượt quá giởi hạn trên (ULN) theo phạm
vi tham khảo cùa mỗi nước.
Trong những trường hợp khi có tãng nguy cơ chảy máu (ví dụ mới được sinh thiết hoặc bị chấn
thương nặng, viêm nội tâm mạc do vi khuẩn), nhìn chung cần được theo dõi chặt chẽ (để phải hiện
các dấu hiệu chảy mảu hoặc thiếu mảư).
Phỏng ngừa tai biến TTHKTM ở bệnh nhân sau đại phẫu chỉnh hình:
Sử dụng các thuốc kháng viêm không steroid (NSAID) để gỉảm đau trong thời gian ngắn trước hoặc
sau phẫu thuật không lảm tăng nguy cơ chảy máu khi điều trị kết hợp vởi PRADAXA. Bằng chứng
về việc sử dụng NSAID thông thường có thời gian bản thải dưới 12 giờ trong quá trình đỉều trị với
PRADAXA còn chưa đẩy đủ và không thấy tăng nguy cơ chảy máu.
Phỏng ngừa đột quỵ, thuyên tắc hệ thống và giám tử vong do nguyên nhăn mạch máu ở những bệnh
nhân rung nhĩ.
Sử dụng đồng thời với cảc thuốc chống kết tập tìểu cẩu (bao gổm aspirin vả clopidogrel) và các
thuốc NSAID lảm tăng nguy cơ chảy mảu. Đặc bỉệt, khi sử dụng đổng thời với cảc thuốc chống kết
tập tiếu cầu hoặc ức chế mạnh P- -gp ở bệnh nhân > 75 tuốỉ, nguy cơ chảy mảư nghiêm trọng, trong đó
có xuất huyết tiêu hóa, tăng lên. Nếu có nghi ngờ chảy mảu trên lâm sảng, nên ảp dụng cảc biện
phảp thích hợp như xét nghiệm mảư ẩn trong phân, hoặc kiểm tra xem hemoglobin có bị giảm
không.
Tương tác với các thuốc gãy cảm ứng P-gp:
Việc sử dụng đổng thời PRADAXA với thuốc gây cảm ứng mạnh P-gp như rifampicin lảm giảm
nổng độ dabigatran trong huyết tương. Các thuốc gây cảm ứng P- -gp khảc như St. John s Wort hoặc
carbamazepine cũng có thể lảm giảm nồng độ dabigatran trong huyết tương, và nên thận trọng khi sử
dụng phối hợp (xem “Tương tác thuốc” vả “Nhóm bệnh nhân đặc biệt”).
Phẫu thuật và Thủ thuật can thiệp:
Cảo bệnh nhân đang điểu trị với PRApẠXA mả trải qua phẫu thuật hoặc các_thữ thuật xâm lấn có
tăng nguy cơ chảy máu. Do vậy, có thế cân tạm ngừng sử dụng PRADAXA đê tiên hảnh những can
thiệp phẫu thuật (xem “Dược động học”).
Giai đoạn trước khi phẫu thuật: ạ
Do nguy cơ tăng chảy máu, nên tạm ngưng PRADAXA trước khi tiến hảnh cảc thủ thuật xâm lấn
hoặc tiến hảnh phẫu thuật. Nếu có thể, nên ngừng sử dụng PRADAXA ít nhất 24 giờ trước thủ thuật
xâm lấn phẫu thuật hoặc phẫu thuật. Ở những bệnh nhân có nhiều nguy cơ xuất huyết hơn hoặc trong
dại phẫu khi cần đến quá trình động máu tốt, nên ngừng sử dụng PRADAXA 2 - 4 ngảy trước khi
phẫu thuật. Thanh thải của dabigatran ở những bệnh nhân suy thận có thế dải hơn. Điều nảy cần
được xem xét trước bất kỳ thủ thuật nảo (xem Bảng ] vả “Dược động học”).
Bảng 1 tóm tắt các quy tắc ngưng thuốc trước khi tiến hảnh thủ thuật xâm lắn hoặc phẫu thuật
Chức năng Thời gian thải Ngừng dabigatran trước phẫu thuật chương trình
thận trừ dự kiến
(CrCL (giờ) Nguy cơ chảy mảu cao Nguy cơ thông thường
mL/phủt) hoặc dại phẫu
Z 80 ~ 13* 2 ngảy trước 24 giờ trước
ì50-<80 ~ 15* 2—3 ngềy trước 1 —2ngảytrước
ì 30 - < 50 ~ 18* 2 ngảy trước 2 — 3 ngảy trước (> 48 giờ)
* để biết thêm chi tiết xem bảng 10 “Dược động học”
Chống chỉ định sử dụng PRADAXA ở những bệnh nhân suy thận nặng (CrCL < 30 mL/phút) nhưng
nêu trường hợp nảy có xảy ra thì nên ngừng sử dụng PRADAXA ít nhất 5 ngảy trước khi đại phẫu.
Nên tạm thời ngừng sử dụng PRADAXA nếu cần có những can thiệp tức thời. Nếu có thế, nên trì
hoãn thủ thuật can thiệpíphẫu thuật cho tới ít nhắt 12 gỉờ kể từ liếư dùng cuối cùng. Nếu không thể
trì hoãn phẫu thuật thi có thể tăng nguy cơ chảy mảu. Nguy cơ chảy mảu nảy nên được cân nhắc
cùng với tính khẩn cấp cùa việc can thiệp (đổi với chuyền nhịp tim xem “Liều lượng vả cảch dùng”)
Gây rê tủy sổng/Gây tê ngoâi mảng củng/Chọc dò tủy sổng:
Cảo thủ thuật như gây tê tủy sống có thế cần chức năng cầm máu hoản chỉnh.
Nguy cơ bị khối mảu tụ ngoải mảng cứng hoặc tùy sống có thế tảng lên trong những trường hợp
chạm thương hoặc chọc đờ lặp đi lặp lại và do đặt catheter ngoải mảng cứng kéo dải. Sau khi rủt
catheter, cần chờ ít nhẩt 1 giờ trước khi bắt đầu dùng liếư PRADAXA đầu tiên. Cần thường xuyên
theo dõi cảc dấu hiệu vả triệu chứng thần kinh của hiện tượng khối mảu tụ ngoải mảng cứng hoặc
tùy sống ở những bệnh nhân nảy.
Giai đoạn sau thủ rhuật:
Tiếp tục đỉều trị lại sau khi đạt được cầm máu hoản toản.
Bệnh nhân thay van tim sinh học
Chưa có đảnh giá việc sử dụng dabigatran etexilat cho bệnh nhãn đặt van tim sinh học. do đó không
khuyên cảo sư dụng dabigatran etexỉlat trên đôi tượng bệnh nhản nảy.
Tá được:
Thuốc chứa tá dược sunset vảng (E110), có thể gây các phản ứng dị ứng. J.,
Tương tác thuốc j
Sử dụng đồng thời PRADAXA với cảc thuốc tảc động lên sự cầm máu hoặc động mảư bao gồm cảc
chât đôi khảng Vitamin K có thế lảm tăng đáng kê nguy co chảy mảư. (xem “Cảnh bảo đặc biệt vả
thận trọng”).
Dabigatran etexilate vả dabigatran không bị chưyến hóa bởi hệ thống cytochrome P450 vả không có
tảc động trên hệ enzyme cytochrome P450 cùa người in vitro. Do đó các tương tác thuôo — thuôo liên
quan khó có khả năng xảy ra với dabigatran etexilate hoặc dabigatran (xem “Nhóm bệnh nhân đặc
biệt”). '
Tương tảc P-gp:
Căc thuốc ửc chế P-glvcoproleín:
Dabigatran ctexilatc lả một cơ chắt cho chẳt vận chuyền xuất bảo P-gp. Sử dụng đồng thời các chất
ức chế P—gp (như amiodarone, verapamil, quinidìne, ketoconazole toản thân, dronedarone, ticagrelor
vả clarithromycine) có thể lảm tăng nồng độ dabigatran trong huyết tương.
Chống chỉ định sử dụng đồng thời với kctoconazole toản thân.
{~
Đối với cảc chất ức chế P-gp khảo được liệt kê ở trên không cần chỉnh liều PRADAXA trong chỉ
đinh “Phòng ngừa đột quỵ, thuyên tăc hệ thông và giảm tử vong do nguyên nhân mạch mảư ở những
bệnh nhân rung nhì”.
Về vỉệc sử dụng động thời với oác chất ức chế P- -gp và liều lượng của PRADAXA trong chỉ định
“phòng ngừa tai biến thuyên tắc huyết khối tĩnh mạch (TTHKTM) ở những bệnh nhân vừa trải qua
đại phẫu chinh hình” xin xem “Liều lượng vả cáoh dùng” và “Nhóm bệnh nhân đặc bỉệt”.
Amiodarone:
Nông độ dabigatran ở người tình nguyện khỏe mạnh tăng lên khoảng 1,6 lần (+60%) khi có sự xuât
hiện cùa amiodarone (xem Nhóm bệnh nhân dặc biệt).
Ở những bệnh nhân trong nghiên cứu RE- LY nồng độ nảy tăng không quá 14% và không quan sảt
thấy tăng nguy cơ chảy mảu.
Verapamil:
Khi dùng PRADAXA (150 mg) cùng với verapamil đường uống, Cmax vả AUC của dabigatran được
tăng lên nhưng mức độ thay đổi nảy lả khảo nhau, phụ thuộc vảo thời gian dùng thuốc và dạng chế
phấm cùa verapamil (xem “Nhóm bệnh nhân đặc biệt”).
Ở những bệnh nhân trong nghiên cứu RE- LY nồng dộ nảy tăng không quá 21% và không quan sảt
thấy tăng nguy cơ chảy mảư.
Quinidine:
Nông độ dabigatran ở người tình nguyện khỏe mạnh tãng lên khoảng 1,5 lân (+53%) khi có sự xuât
hiện của quinidỉne (xem “Nhóm bệnh nhân đặc biệt”).
Clarithromycin:
Nồng độ dabigatran ở người tình nguyện khỏe mạnh tăng lên khoảng 19% khi có clarithromycin mã
không có bất cứ vấn đề an toản nảo trên lâm sảng (xem “nhóm bệnh nhân đặc biệt”).
Ketoconazole: Àầ
Nồng độ dabigatran tăng lên khoảng 2, 5 lần (+150%) sau khi dùng đơn liều và đa liều của
ketoconazole toản thân (xem “Chống chỉ định” vả “Nhóm bệnh nhân đặc biệt”).
Dronedarone.
Nồng dộ dabigatran tăng lên 2,1 lần (+1 14%) hoặc 2 ,4 lần (+136%) tương ứng sau khi dùng đơn liều
hoặc đa liều dronedaronc (xem “Nhóm bệnh nhân đặc biệt”).
T icagrelor :
Nồng độ dabigatran ở người tình nguyện khóe mạnh tăng 1,46 lần (tăng 46%) khi có sự xuất hiện
cùa ticagrelor ở trạng thải ổn dịnh hoặc tăng 1,73 lần (tăng 73%) khi dùng đồng thời liếư tải
ticagrelor và liều dơn 75 mg dabigatran etexilate.
Các thuốc là cơ chất của P- Elỵcoprotein:
Dỉgoxin: Trong một nghiên cứu được tiến hảnh trên 24 người khỏe mạnh, khi sử dụng PRADAXA
cùng với digoxin, đã quan sảt thấy không có sự thay đôi digoxin và không có những thay đôi liên
quan đến lâm sảng về nồng độ dabigatran (xem“Nhóm bệnh nhân đặc biệt”).
Thuốc gâv cảm ứng P-glvcoproteín:
Sau 7 ngảy đỉếu trị với 600 mg rifampicin ngảy 1 lần cả AUCọ...o vả Cmax cùa dabigatran lần lượt
giảm 67% và 66% so với đỉều trị tham chiếu.
Sử dụng đổng thời với cảc thuốc cảm ứng P—gp (ví dụ rifampicin) lảm giảm nồng độ dabigatran và
nên trảnh (xem “Cảnh báo đặc biệt và thận trọng” vả “Nhóm bệnh nhân đặc biệt”).
Khả năng sinh sản, thai Ịq` và cho con bú
Thai kỳ
Hiện không có dữ liệu lâm sảng nảo về việc sử dụng thuốc ở phụ nữ có thai. Nguy cơ đối với thai
nhi chưa được biết.
Phụ nữ đang trong độ tuổi sinh sản cần trảnh có thai trong quá trình điều trị với PRADAXA và
không nên diều trị với PRADAXA ớ phụ nữ đang mang thai trừ khi lợi ích mong đợi nhiếu hơn so
với nguy cơ.
Cho con bú
Hiện ohưa có dữ liệu iâm sảng. Nên thận trọng băng cách ngừng cho con bủ.
Khả năng sinh sản
Không có dữ liệu lâm sảng. Các nghiên cứu tiến lâm sảng trên khả năng sinh sản không cho thây bât
kỳ tảo dụng ngoại ý trên khả năng sinh sản hoặc phảt triên của động vật sau khi sinh.
Anh hướng lên khả năng lái xe và vân hânh máỵ mỏc
Chưa oó nghiên cứu nảo được thực hiện trên tảo động tới khả năng lải xe và vận hảnh mảy móc.
Tác dung phu JỆ
Tính an toản của PRADAXA nhin chung đã được đảnh gỉả trên 28.837 bệnh nhân được điều trị
trong 7 nghiên cửu lâm sảng; trong đó có 18.726 bệnh nhân được đìều trị với PRADAXA.
Cảo nghiên cứu ban đầu trong phòng ngừa TTHKTM sau đại phẫu chinh hình với tổng số 10.795
bệnh nhân được điều trị trong 6 nghiên cứu có nhóm chứng được sử dụng ít nhất một liều dabigatran
etexilate (150 mg mỗi ngảy, 220 mg mỗi ngảy, enoxaparỉn). 6.684 trong số 10.795 bệnh nhân được
diều trị với liều 150 hoặc 220 mg dabigatran etexilate một lần mỗi ngảy.
Trong nghiên cứu RELY khảo sát việc phòng ngừa đột quỵ vả thuyên tắc hệ thống ở bệnh nhân rung
nhĩ, tổng cộng có 12.042 bệnh nhân được chọn ngẫu nhiên để dùngđiều trị với dabigatran etexilate.
Trong số đó, 6.059 bệnh nhân điều trị với liều dabigatran etcxilate 150 mg hai lần mỗi ngảy, trong
khi 5.983 bệnh nhân dùng liều ] 10 mg hai lần mỗi ngảy.
Tống cộng có khoảng 9% bệnh nhân được điều trị phẫu thuật chương trinh thay khớp gối hoặc khớp
hảng (điều trị ngắn hạn có thể đến 42 ngảy) và 22% bệnh nhân bị rung nhĩ điều trị phòng ngừa đột
quỵ vả thuyên tắc hệ thống (điều trị kéo dải lên đến 3 năm) bị cảc phản ứng ngoại ý.
Chảy máu
Chảy máu là tảo dụng phụ liên quan nhiều nhất tới PRADAXA; xảo định bời dấu hiệu chảy máu bất
kỳ loại hoặc mức độ nghiêm trọng nảo và xuất hiện trong khoảng 14% bệnh nhân điều trị ngắn hạn
trong phẫu thuật thay khớp gôi hoặc khớp hảng và 16, 5% bệnh nhân rung nhĩ điều trị dải hạn phòng
ngừa đột quy và thuyên tắc hệ thống
Mặc dù tần suất hiếm gặp trong các nghiên cứu lâm sảng, chảy máu nặng hoặc nghiêm trọng có thể
xảy ra, và bât kế vị trí, có thẻ dân tới hậu quả tản tật, đe dọa tinh mạng hoặc thậm chỉ gây tử vong.
Phỏng ngừa lai biển TTHKTM ở bệnh nhân sau đại phẫu chỉnh hình:
Tỷ lệ chảy máu nói chung là tương tư giữa các nhóm điếu trị và không có sự khác bíệt đáng kế.
Phòng ngừa đột quỵ, ihuyên tắc hệ thống và giỏm tử vong do nguyên nhân mạch mảư ở những bệnh
nhân rung nhĩ:
Chảy mảư nặng khi đảp ứng ít nhất một trong số cảc tiêu chí sau:
0 Chảy máu cùng với việc giảm haemoglobin it nhất 20 grams trên lít hoặc dẫn tới phải truyền
mảư với ít nhắt 2 đơn vị máu hoặc hồng cầu lắng
o Biếu hiện chảy mảư ở một vị trí hay cơ quan quan trọng: nội nhãn cầu, nội sọ, trong tủy sống
hoặc trong cơ với hội chứng chèn ép khoang, chảy mảu sau phủc mạc, chảy máu trong khớp
hoặc chảy máu mảng ngoải tim.
Chảy mảư nặng được phân loại là đe dọa đến tính mạng bệnh nhân nếu đảp ứng ít nhất một trong số
cảc tiêu chí sau:
0 Chảy máu gây tử vong; chảy mảư nội sợ có triệu chứng; giảm haemoglobin với ít nhất 50
grams trên lít; truyền ít nhất 4 đơn vị máu hoặc hồng câu lắng, chảy máu đi kèm với việc tụt
huyết ảp yêu câu phải dùng cảc chẳt vận mạch theo đường tĩnh mạch; chảy mảư cần phải can
thiệp phẫu thuật.
Các bệnh nhân dược chọn ngẫu nhiên dùng dabigatran etexilate liều l]Omg hai lần mỗi ngảy vả liếư
150mg hai lần mỗi ngảy có nguy cơ chảy máu đe dọa tính mạng, đột quy do xuất huyết và chảy máu
nội sọ thẳp hơn đáng kể so với warfarỉn [ p<0,05]. Tỷ lệ chảy mảư tất cả các loại thấp hơn có ý nghĩa
thổng kê ở cả hai hảm lượng dabigatran etexilate. Bệnh nhân chỌn ngẫu nhiên vảo nhóm dabigatran
ctcxilatc liếư llOmg hai lần mỗi ngảy có nguy cơ chảy máu nặng thấp hơn đáng kể so với warfarin
(tỷ số ngưy hại 0,80, p=0,0026). á
,
Ớư
Tác dung nhu: 0
Cảo phản ứng không mong muốn được phân loại theo hệ cơ quan (system organ class, SOC) vả
MedDRA được bảo oáo từ bắt kỳ nhớm điếu trị cho mỗi nhóm bệnh nhân của tắt cả cảc nghiên cứu
có nhóm chứng được liệt kê dưới đây. Bảng 2 ]íệt kê các tác dụng phụ được xác định ở cả hai chỉ
định. Bảng 3 liệt kê các tác dụng phụ liên quan tới chỉ định cụ thế.
Các tác dụng phụ nhìn chung liên quan đên Cơ chế dược lý học của dabigatran etexilate vả oảo biên
có liên quan đên chảy mảu có thế xảy ra ở cảc cơ quan và vị trí giải phân khác nhau.
Tỷ lệ cảc tảo dụng phụ quan sải được cùa dabigatran etexilate` ớ nhĩmg bệnh nhân điều trị trong
phòng ngừa TTHKTM sau phẫu thuật thay khớp gôi hoặc háng năm trong phạm vi của enoxaparin.
Tỷ lệ các tảo dụng phụ quan sảt được cùa dabigatran etexilate ở những bệnh nhân điếu trị trong
phòng ngừa đột quỵ ở bệnh nhân rung nhĩ là năm trong phạm vi tương tự warfarin ngoại trừ rôi loạn
dạ dảy một có một tỷ lệ cao hơn ở trong nhóm dùng dabigatran etexilate.
Bảng 2: Cảo tác dụng phụ được xảo định từ các nghiên cứu phỏng ngừa tịên phát tai biến
TTHKTM sau đại phân chỉnh hình và phỏng ngừa đột quỵ do !huyên lăc mạch vả thuyên
tắc hệ thống ở bệnh nhân rung nhĩ:
Rôi loan hê mảư vả bach huvết
Thiêu mảu, giảm tiêu câu
Rối loan hê miễn dich
Quả mẫn với thưôc bao gôm mảy đay, phảt ban vả ngứa, oo thăt phế quản, phù mạoh, phản
ứng phản vệ
Rối loan hê thần kinh
Xuât huyêt nội sọ
Rõi loan mach
Mảư tụ , chảy máu
Rối loan hô hắn, ngưc vả trung thất
Chảy mảư mũi , ho ra mảư
Rối loan da dảv ruôt
Xuât huyêt tiêu hóa , đau bụng, tiêu chảy, khó tiêu, buôn nôn, loét dạ dảy, viêm thực quản
dạ dảy, trảo ngược thục quản dạ dảy, nôn, khó nuốt
Rối loan gan mât
Bât thường chức năng gan
Rối loan da vả mô dưới da
Xuât huyêt da
Rôi loan xương. cơ xương khử và mô liên kêt
Tụ máu khớp
Rối loan thân vả tiết niên
Xuât huyêt niệu sính dục. 4.
" Z'
Rối loan toản thân và tai vi tri sử dung /
Xuất huyết nơi tiêm, xuất huyết tại vị trí đặt oatheter
Tổn thương. ngô đôc hoảc những biến chứng sau thủ thuât
Chảy máu do chân thương, chảy mảu tại vêt rạoh
Bảng 3: Các tác dụng phụ cụ thể được xảo định theo mỗi chỉ định
Phỏng ngừa tai biên TTHKTM ở những bệnh nhân sau đại pháu chính hình:
Rối loan maoh mảư
Chảy máu tại vêt thương
Rôi loan toản thân và tai vi tri sử dung
Tiêt dịch có máu
Tốn thương. ngớ đôc hoăc những biến chững sau thù thuât
Khôi máu tụ sau thủ thuật, chảy mảư sau thủ thuật, thiếu mảư hận phân, tiêt dịch sau thủ
thuật, vêt thương tiêt dịch
Cảo thù thuât nôi khoa và ngoai khoa
Dân lưu vêt thương, dân lưu hậu phân
Phòng ngừa đột quỵ, thuyên !ẳc hệ thống vả giảm lử vong do nguyên nhân mạch máu ở những bệnh
nhân rung nhĩ:
Không oó
Thông báo cho bảc sỹ các tác dụng không mong muốn gặp phải khi sử dụng thuốc.
Quá lỉều
Quả liều khi dùng PRADAXA có thể dẫn đến các biểnchứng chảy máu do đặc tính dược lực học
của thuốc. Không cớ săn thuốc giải độc đặc hiệu đôi kháng với hoạt tính dược lực học cùa
PRADAXA. Dùng liêu cao hơn oác liêu được khuyến cảo lảm tãng nguy cơ chảy mảu.
Trong trường hợp nghi ngờ quá liều, xét nghiệm đông máu có thể giúp xảc định nguy cơ chảy máu
(xem phần “Thận trọng đặc biệt và Cảnh bảo” và “Đặc tính Dược lý học”). Kiếm tra định lượng hiệu
chuẩn (dTT) hoặc phương pháp đo d'IT lặp lại cho phép dự đoản thời gian khi nảo sẽ đạt đến cảc
nồng độ dabigatran (xem phần "Đặc tỉnh Dược lý học"), cũng như trong trường hợp dùng cảc biện
phảp bổ sung ví dụ như lọc mảư đã được bắt đấu.
Có thế phải ngùng sử dụng PRADAXA khi có tác dụng chống đông mảư quá mức. Khi có các biến
chứng chảy mảư, phải ngừng điều tn“ vả xảo định vị trí chảy máu. Do dabigatran được thải trừ chủ
yêu qua thận, cần duy trì lượng nước tiểu thích hợp
Nên tiến hảnh các biện phảp điếu trị chuẩn thích hợp, như phẫu thuật cầm máu và bồi hoản lượng
mảư mắt. Ngoài ra, có thế cân nhắc việc sử dụng máu tươi toản phẩn hoặc huyết tương tươi đông
lạnh. Do liên kết với protein thấp, dabigatran có thể được thẩm phân, tuy nhỉên cảc kinh nghiệm lâm
sảng về việc dùng biện phảp lọc mảư trong trường hợp nảy còn hạn chế (xem “Nhóm bệnh nhân đặc
biệt”).
Phức hợp prothrombin đậm đặc hoạt hóa (ví dụ FEIBA) hoặc yếu tố VIIa tái tổ hợp hoặc các chế
phẩm đậm đặc chứa các yểu tố đông mảu II, IX, X nên được xem xét sử dụng. Có một vải bằng
chứng thực nghiệm để hỗ trợ cho vai trò cùa cảc yếu tố nảy trong việc đảo ngược hiệu quả chống
đông của dabigatran nhưng sự hữu ích cùa chủng trên lâm sảng chưa dược chứng minh một cảch có
hệ thống. Kiếm tra đông máu có thể trở nên không tin oậy sau khi dùng cảc thuốc đảo ngược được
gợi ỷ. Nên thận trọng đối với việc truyền tiếu cầu đậm đặc trong trường hợp có thiếu tiếu cầu hoặc
đã sử dụng các thuốc khảng tiểu cầu có hoạt tính kéo dải. Tất cả điều trị triệu chứng được đưa ra
theo quyết định cùa bảo sĩ.
h
Đăc tính dt… lỵ' hoc ả
Nhóm đỉều trị: thuốc ức chế thrombin trực tiếp dùng đường uống
Mã ATC : BOIAEO7 — dabigatran etexilate
Thông rin chung
Dabigatran etexilate là một tiền chất có phân tử lượng nhỏ và không có tảo dụng dược lý. Sau khi
uông, dabigatran etexilate được hấp thu nhanh chóng và chuyến hóa thảnh dabigatran nhờ sự thủy
phân được xúc tảo bởi esterase trong huyết tương và gan. Dabigatran lả một chất ức chế thrombin
trực tiếp, oó hồi phục, mạnh và có tính cạnh tranh và là chất có hoạt tính chính trong huyết tương.
Do thrombin (serine protease) giúp chuyển đổi tibrinogen thảnh fibrin trong quá trình đông mảư,
dùng thuốc ức chế thrombin sẽ ngăn chặn sự hình thảnh cục máu đông. Dabigatran cũng ức chế
thrombin tự do, thrombin liên kết với fibrin và sự kết tập tiểu oầu do thrombin
Các nghiên cứu in…vivo vả ex-vivo trên động vật cho thắy hiệu quả chống huyết khối vả hoạt tính
chống đông cùa dabigatran sau khi dùng theo đường tĩnh mạch và dabigatran etexilate sau khi uống
ở các mô hình huyết khối trên động vật khảo nhau.
Có một mối tương quan chặt chẽ gìữa nồng độ dabigatran trong huyết tương vả mức độ hỉệu quả
chống đông
Dabigatran kéo dải thời gian aPTT (thời gian thrombopiastin từng phần hoạt hóa), ECT và TT.
Các nghiên cứu lâm sâng vế DhònP. ngừa tỉến Dhảt thuvên tắc huvết khối tĩnh mach sau đai nhẫn thav
cảc khớp lởn:
Trong 2 nghiên cứu dò liều, mù đôi, nhóm song song, ngẫu nhiên quy mô lớn, những bệnh nhân
được đại phẫu chỉnh hình theo chương trình (một nghiên cứu cho bệnh nhân có phẫu thuật thay khớp
gối vả một nghiên cứu cho bệnh nhân oó phẫu thuật thay khớp hảng) dùng dabigatran etexilate 75
mg hoặc 1 10 mg trong vòng 1 - 4 giờ phẫu thuật, sau đó dùng 150 mg hoặc 220 mg một lần mỗi
ngảy, khi quá trình câm máu đã được bảo đảm, hoặc enoxaparin 40 mg vảo ngảy trước khi phẫu
thuật vả một lẳn mỗi ngảy sau đó.
Trong nghiên cứu RE-MODEL (thay khớp gối) bệnh nhân được điều trị 6 ~ 10 ngảy và trong nghiên
cứu RE-NOVATE (thay khớp háng) trong 28 . 35 ngảy. Tống số 2076 bệnh nhân (khớp gối) vả 3944
bệnh nhân (khớp háng) đã được điếu trị.
Các kết quả của nghiên oứu thay khớp gối (RẸ- MODEL) theo tiêu chí chính là toản bộ biến cố
thuyên tắc huyết khối tĩnh mạch bao gôm biến cô không triệu chứng và tử vong do mọi nguyên nhân
đã cho thắy tảo dụng chống huyết khối cùa dab1gatran etexỉlate ở cả hai mức liếư lá không thua kém
về mặt thống kế so với enoxaparin.
Tương tự như vậy, toản bộ bíến cố thuyên tắc huyết khối tĩnh mạch kể cả biến cố không triệu chứng
và tử vong do mọi nguyên nhân lả tiếu chí chinh oủa nghìên cửu thay khớp hảng (RE- NOVATE).
Một lần nữa, dabigatran etexilate 0 cả 2 mức liếư hảng ngảy về mặt thống kế đến không thua kém so
với tảo dụng cùa enoxaparin 40 mg mỗi ngảy.
Ngoài ra, trong một nghiên cứu thử 3 (RE-MOBILIZE) với thiết kế mù đôi, ngẫu nhiên, nhỏm song
song, cảc bệnh nhân trải qua phẫu thuật thay khớp gối dùng dabigatran etexilate 75 mg hoặc 110 mg
trong vòng 6 - 12 giờ sau khi phẫu thuật và sau đó dùng 150 mg vả 220 mg một lần mỗi ngảy. Thời
gian điếu trị lả 12 - 15 ngảy. Tồng cộng có 2615 bệnh nhân được chọn ngẫu nhiên và 2596 bệnh
nhãn được điều trị. Liều thuốc so sảnh cùa enoxaparin là 30 mg hai lần mỗi ngảy theo hướng dẫn sử
dụng cùa Mỹ. Tinh không thua kém không được chứng minh qua nghiến cứu RE-MOBILIZE.
Không có sự khảo biệt có ý nghĩa thống kê về hiện tượng chảy mảư so với thuốc đối chứng.
Bên cạnh đó, một nghiên cứu pha II, ngẫu nhiên, nhóm song song, mù đôi, có đối chứng với giả
dược tiến hảnh trên bệnh nhân người Nhật Bản dùng dabigatran etexilate 1 10 mg, 150 mg, và 220
mg ở ngảy kế tiếp sau khi phẫu thuật thay khớp gôí theo chương trình. Nghiên cứu trên người Nhật
Bản cho thấy môi liến hệ rõ rảng giữa đảp ứng với liều lượng lến hiệu quả cùa dabigatran etex1late
vả đặc điếm chảy mảư tương tự giá dược.
Trong nghiên cứu RE-MODEL vả RE-NOVATE, việc chia nhóm ngẫu nhiên được thục hiện trước
khi phẫu thuật vả trong nghiên cứu RE-MOBILIZE và nghiên cứu có so sảnh giả dược trên người
Nhật Bản thì việc chia nhóm ngẫu nhiến được thực hiện sau khi phẫu thuật. Đây iả điếm lưu ý đặc
biệt trong khi đánh giá tính an toản ở những nghiên cứu nảy. Vì lý do nảy các nghiến cứu được gộp
lại thảnh nghiên cứu ngẫu nhiên trước vả sau khi phẫu thuật trong Bảng 4.
Dữ liệu về tiêu chí TTHKTM nặng vả tử vong liên quan đến TTHKTM và chảy mảư nặng đã được
xảo định chẳc chẳn được trình bảy trong Bảng 4 dưới đây. TTHKTM được định nghĩa lả tỷ lệ kết
hợp gỉữa huyết khối tĩnh mạch sâu và Thuyên tấc phổi.
Bảng 4: Phân tích TTHKTM nặng và tử vong iiên quan đến TTHKTM trong quá trình điếu trị trong
các nghiên cứu phẫu thuật chỉnh hỉnh RE-MODEL vả RE-NOVATE
Thử nghiệm Dabigatran etexilate Dabigatran etexilate Enoxaparin
220 mg 150 mg 40 mg
RE-NOVATE (khớp hảng) '
N 909 888 917
Tỷ lệ (%) 28 (3,1) 38 (4,3) 36 (3,9)
Tỷ sô nguy co so với _ _
enoxaparín (KTC 95%) 0,78 (0,48, 1,27) 1,09 (0,70, 1,70)
RE-MODEL (khớp gối) 1
N 506 527 51 1
Tỷ lệ (%) 13 (2,6) 20 (3,8) 18 (3,5)
Tỷ sô nguy co so với _ _
enoxaparin (KTC 95%) 0,73 (0,36, 1,47) 1,08 (0,58, 2,01)
RE-MOBILIZE (khớp gối) 2 Enoxaparin
60 mg
N 618 656 668
Tỷ lệ (%) 21 (3,4) 20 (3,0) 15 (2,2)
Sự khảo biệt nguy co so với
. 1,2 0,8
enoxapann (%)
KTC 95 % (—0,7; 3,0) (-0,9; 2,5)
Tỷ lệ nguy cơ so với cnoxaparin 1,51 1,36
KTC 95% (0,79; 2,91) (0,70; 2,63)
Nghiên cứu (khớp gối) trên bệnh nhân Nhật bản²
Giả dược
N 102 113 104
Tỷ lệ (%) 0 2 (1,8) 6 (5,8)
Sự khảo biệt nguy cơ so với giả _ _ _ _ _
dược (%) (KTC 95 %) —5,8 (-10,3, 1,3) 4,0( 9,1,1,1)
cảc nghiên cứu ngẫu nhiên trước phẫu thuật
cảc nghiên cứu ngẫu nhiên sau phẫu thuật
Cảo nghiến cứu lâm sảng trong phòng ngừa đột quỵ vả thuyên tắc hệ thống ở bệnh nhân rung nhĩ
Bằng chứng lâm sảng vê hiệu quả của dabigatran etexilate được tống kết từ nghiên cứu RE- LY
(Đảnh giả một cách ngẫu nhiên, dải hạn liệu phảp chống đông mảư) lả một nghiến cứu đa trung tâm,
đa quốc gia, nhóm song song, ngẫu nhiên với 2 mức liếư dabigatran etexilate được lảm mù (110 mg
2 lần môi ngảy vả 150 mg 2 lần môi ngảy) so với nhóm dùng warfarin nhãn mở ở những bệnh nhân
rung nhĩ có nguy cơ đột quỵ hoặc thuyên tắc hệ thống từ trung binh tới cao Mục tiêu chính cùa
nghiên cứu là xác định liệu dabigatran có không thua kém so với warfarin trong việc lảm giảm sự
xuất hiện kết cuộc hỗn hợp bao gộm cảc biến có đột quỵ vả thuyến tắc hệ thống (TTHT)
Trong nghiên cứu RE-LY, tổng sô 18.1 13 bệnh nhân được lựa chọn ngẫu nhiên, độ tuối trung binh là
71,5 vả có điểm số trung binh CHADSz lả 2,1. Dân số nghiên cứu có sự tương đồng về tỉ lệ bệnh
nhân có điểm số trung bình CHADSg là 1 ,2 và 2 3 Dân sô nghiên cứu có 64% lả nam gỉới, 70% là
người da trắng và 16% là người Châu Ẩ. RE-LY có thời gian điều trị trung vị là 20 thảng với
dabigatran etexilate được dùng ở liều cố định mà không theo dõi đông mảu. Ngoài chấn đoản bị
rung nhĩ không do bệnh van tim (AF), ví dụ rung nhĩ dai dẳng hoặc kịch phảt , bệnh nhân có thêm
một trong các yếu tố nguy cơ sau đây cho đột quỵ:
Trước đó đã bị đột quỵ, cơn thoảng thiếu máu năo (TIA), hoặc thuyên tắc hệ thống
Phân suất tống máu thẳt trải < 40 %
Suy tim có triệu chứng, Phân loại NYHA ì độ 2
Tuổi 2 75
Tuổi 2 65 đi kèm với một trong cảc bệnh sau: đải thảo đường, bệnh động mạch vảnh, hoặc
tăng huyết ảp
Ề.
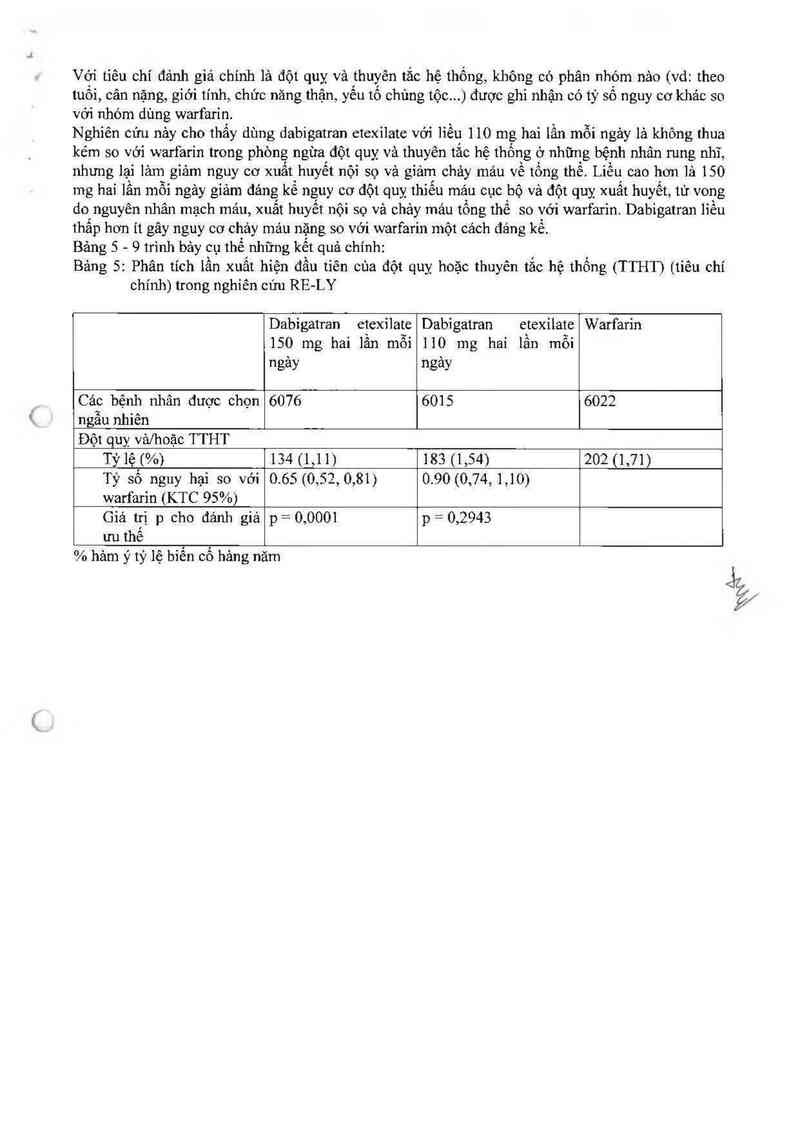
Với tiêu chí đánh giá chính là đột quy và thuyên tắc hệ thống, không có phân nhỏm nảo (vd: theo
tuồi, cân nặng, giới tính, chức năng thận, yêu tố chủng tộc.. .) được ghi nhận có tỷ số nguy cơ khác so
với nhóm dùng warfarỉn.
Nghiên cửu nảy cho thẳy dùng dabigatran etexilate với liếư 110 mg hai lần mỗi ngảy lả không thua
kém so với warfarin trong phòng ngừa đột quỵ vả thuyên tắc hệ thống' 0 những bệnh nhân rung nhĩ,
nhưng lại lảm giảm nguy cơ xuất huyết nội sợ và giảm chảy mảư về tổng thể Liều cao hơn lả 150
mg hai lần mỗi ngảy gỉảm đảng kế nguy cơ đột quỵ thiểu máu cục bộ và dột quỵ xuất huyết, tử vong
do nguyên nhân mạch máu, xuất huyết nội sọ vả chảy mảư tồng thế so với warfa.rin. Dabigatran liều
thấp hơn ít gây nguy cơ chảy máu nặng so vởi warfarin một cảch đáng kế.
Bảng 5 - 9 trình bảy cụ thể những kết quả chính:
Bảng 5: Phân tích lần xuất hiện đầu tiên cùa đột quỵ hoặc thuyên tắc hệ thống (TTHT) (tiêu chí
chính) trong nghiến cứu RE—LY
Dabigatran etexilate Dabigatran etexilate Warfarin
150 mg hai lần mỗi 110 mg hai lần mỗi
ngây ngảy
Các bệnh nhân được chọn 6076 6015 6022
ngẫu nhiên
Đột quỵ vả/hoặc TTHT
Tỳlệ(%) 134(1,11) 183 (1,54) 202(1,71)
Tỷ số nguy hại so với 0.65 (0,52, 0,81) 0.90(0,74, 1,10)
warfarin (KTC 95%)
Giá trị p cho đảnh giả p= 0,0001 p = 0,2943
ưuthế
% hảm ' t' lệ biến cố hản năm
y y g
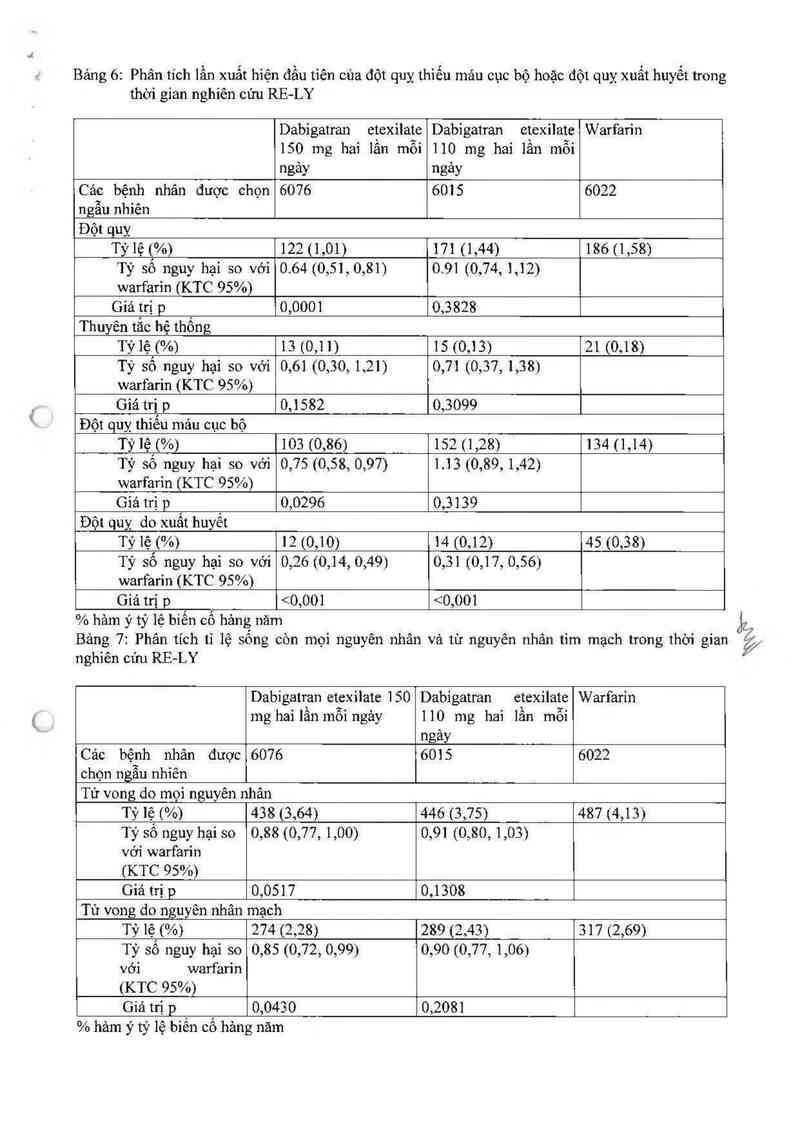
Bảng 6: Phân tích lần xuất hiện đầu tỉên của đột quỵ thiếu mảư cục bộ hoặc đột quỵ xuất huyết trong
thời gian nghiên cứu RE-LY
Dabigatran etexilate Dabìgatran etexỉlate Warfarin
150 mg hai lần mỗi 110 mg hai lần mỗi
ngảy ngảy
Cảc bệnh nhân được chọn 6076 6015 6022
ngẫu nhiên
Đột quỵ
Tỷlệ (%) 122(1,01) 171 (1,44) 186 (1,58)
Tỷ số nguy hại so với 0.64 (0,51,0,81) 0.91 (0,74, 1,12)
warfarin (KTC 95%)
Giá trị p 0,0001 0,3 828
Thuyên tắc hệ thống
Tỳlệ (%) 13 (0,11) 15 (0,13) 21 (0,18)
Tỷ số nguy hại so với 0,61 (0,30, 1,21) 0,71 (0,37, 1,38)
warfarin (KTC 95%)
Giá trị p 0,1582 0,3099
Đột quỵ thiếu mảu cục bộ
Tỷ lệ (%) 103 (0,86) 152 (1,28) 134 (1,14)
Tỷ số nguy hại so với 0,75 (0,58, 0,97) 1.13(0,89, 1,42)
warfarin (KTC 95%)
Giá trị p 0,0296 0,3139
Đột quỵ do xuất hưyết
Tỷ lệ (%) 12 (0,10) 14 (0,12) 45 (0,38)
Tỷ số nguy hại so với 0,26 (0,14, 0,49) 0,31 (0,17, 0,56)
warfarin (KTC 95%)
Giá trị p <0,001 <0,001
% hảm ỷ tỷ lệ biên có hảng năm
Bảng 7: Phân tích tỉ lệ sống còn mọi nguyên nhân vả từ nguyên nhân tim mạch trong thời gian
nghiến cứu RE-LY
Dabigatran etcxilate 150 Dabigatran etexilate Warfarin
mg hai lần mỗi ngảy 1 10 mg hai lần mỗi
ngảy
Các bệnh nhân được 6076 6015 6022
ChỌn ngẫu nhiên
Tử vong do mọi nguyên nhân
Tỳ 1ệ (%) 438 (3,64) 446 (3,75) 487 (4,13)
Tỷ số ngưy hại so 0,88 (0,77, 1,00) 0,91 (0,80, 1,03)
với warfarin
(KTC 95%)
Giá trị p 0,0517 0,1308
Tử vong do nguyên nhân mạch
Tỷ lệ (%) 274 (2,28) 289 (2,43) 317 (2,69)
Tỷ số ngưy hại so 0,85 (0,72, 0,99) 0,90 (0,77, 1,06)
với warfarin
(KTC 95%)
Giá trị p 0,0430 0,208]
% hảm ý tỷ lệ biến cố hảng năm
%
/
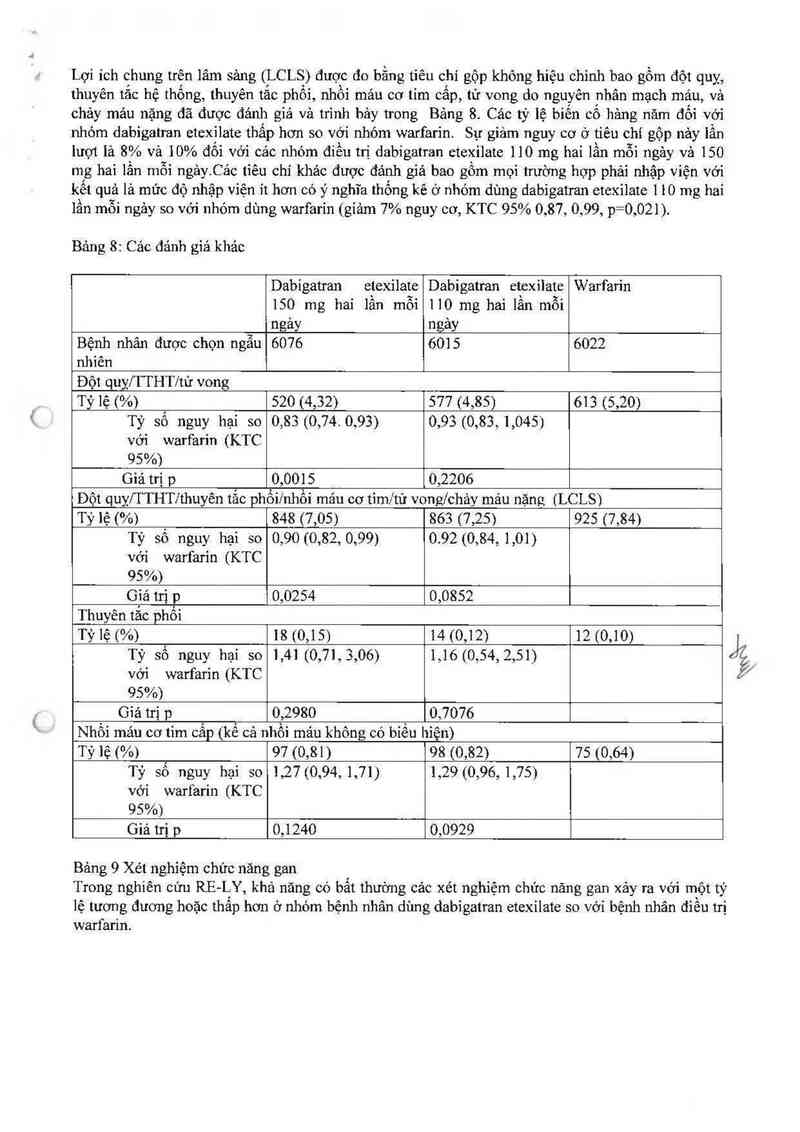
Lợi ích chung trên lâm sảng (LCLS) được đo bằng tiêu chí gộp không hiệu chinh bao gồm đột quỵ,
thuyến tắc hệ thống, thuyên tắc phối, nhồi mảư cơ tim cấp, tử vong do nguyên nhân mạch máu, vả
chảy mảư nặng đã được đảnh giá và trình bảy trong Bảng 8. Các tỷ lệ biến cố hảng năm đối với
nhóm dabigatran etexilate thấp hơn so với nhóm warfarin Sự giảm nguy cơ ở tiêu chí gộp nảy iần
lượt lả 8% vả 10% đối với cảc nhóm điếu trị dabigatran ctexilate 110 mg hai lần mỗi ngảy vả 150
mg hai lẩn mỗi ngảy. Cảo tiêu chỉ khảo được đánh giá bao gồm mọi trường hợp phải nhập viện với
kết quả lả mức độ nhập viện it hơn có ý nghỉa thống kê ở nhóm dùng dabigatran etexilate 1 10 mg hai
lần môi ngảy so với nhóm dùng warfarín (giảm 7% nguy cơ, KTC 95% 0,87, 0,99, p= 0,021).
Bảng 8: Cảo đánh giá khảc
Dabigatran etexilate Dabigatran etexilate Warfarin
150 mg hai lần mỗi 110 mg hai 1ần mỗi
ngảy ngảy
Bệnh nhân được chọn ngẫu 6076 6015 6022
nhìên
Đột quỵ/TTHT/tử vong
Tỷ lệ (%) 520 (4,32) 577 (4,85) 613 (5,20)
Tỷ số nguy hại so 0,83 (0,74. 0.93) 0,93 (0,83,1,045)
với warfarin (KTC
95%)
Giá trị p 0,0015 0,2206
Đột quỵ/TTHT/thuyên tắc phốilnhổi mảư cớ tim/tử vong/chảy mảư nặng (LCLS)
Tỷ lệ (%) 848 (7,05) 863 (7,25) 925 (7,84)
Tỷ số nguy hại so 0,90 (0,82, 0,99) 0.92(0,84, 1,01)
với warfarỉn (KTC
95%)
Gìả trị p 0,0254 0,0852
Thuyên tắc phồi
Tỷ lệ (%) 18 (0,15) 14 (0,12) 12 (0,10)
Tỷ số nguy hại so 1,41(0,71,3,06) 1,16(0,54, 2,51)
với warfarin (KTC
95%)
Giá trị p 0,2980 0,7076
Nhồi máu cơ tim cấp (kể cả nhồi mảư không có bỉểu hiện)
Tỷ lệ (%) 97 (0,81) 98 (0,82) 75 (0,64)
Tỷ số nguy hại 50 1,27(0,94, 1,71) 1,29 (0,96, 1,75)
với warfarin (KTC
95%)
Giá trị p 0,1240 0,0929
Bảng 9 Xét nghiệm chức năng gan
Trong nghiên cứu RE LY, khả năng có bất thường cảc xét nghiệm chức nảng gan xảy ra với một tỷ
lệ tương đương hoặc thấp hơn & nhớm bệnh nhân dùng dabigatran etexilate so với bệnh nhân điếu trị
warfarin
Dabigatran etexilate Dabigatran etcxilate Warfarỉn
150 mg hai lần mỗi 110 mg hai lần mỗi
ngảy ngảy
N (%) N (%) N (%)
Tống số bệnh nhân điếu trị 6059 (100,0) 5983 (100,0) 5998 (100,0)
ALT hoặc AST › 3 x ULN 106 (1,7) 118 (2,0) 125 (2,1)
ALT hoặc AST › 5 x ULN 45 (0,7) 36 (0,6) 50 (0,8)
ALT hoặc AST › 3 x ULN +14 (0,2) 1 1 (0,2) 21 (0,4)
Bilirubin >2xULN
(ULN= Giới hạn trên cùa giá trị bình thường, Upper Limit of Normal)
Nghiên cứu lâm sảng trong phòng ngừa thuyên tắc hưyết khối ở bệnh nhân thay van tim:
Một nghiên cứu pha 11 đánh giá dabigatran etexilate vả warfarin trong tồng số 252 bệnh nhân mới
trải qua phẫu thưặt thay van tim (nghĩa lả vẫn đang trong thời gian nằm viện) và những bệnh nhân đã
thay van tim cách đó hơn ba tháng. Đã quan sảt thắy sự mất cân bằng giữa các biến cố thuyên tắc
huyết khối và các biến cố chảy mảu nói chung (chủ yếu ở mức nhẹ), không ửng hộ cho việc sử dụng
dabigatran etexilate. Ở những bệnh nhân hậu phẫu gíai đoạn sớm, chảy máu nặng chủ yếu biến hiện
dưới dạng trân dịch mảng tim xuất huyết, đặc biệt ở những bệnh nhân bắt đầu điều trị dabigatran
etexilate sớm (vảo ngảy thứ 3) sau phẫu thuật thay van tim.
Dươc đông hoc
Sau khi dùng dabigatran etexilate đường uống ở những người tình nguyện khoẻ mạnh, đặc tính dược
động học cùa dabigatran trong huyết tương được đặc trưng bời sự tảng nhanh nồng độ trong huyết
tương, với nồng độ đỉnh (C,…) đạt được trong khoảng 0, 5— 2, 0 giờ sau khi uông. Cmax, diện tích
dưới đường cong nồng độ trong huyết tương theo thời gian (AUC) tỷ lệ với liếư dùng. Sau Cmax,
nồng độ trong hưyết tương của dabigatran giảm theo hảm mũ kép với thời gian bản thải trung binh
cúa pha cuối khoảng 11 giờ ở người cao tuối khoẻ mạnh. Sau khi dùng đa liếu, thời gian bản thải
cuối cùng được ghi nhận vảo khoảng 12 - 14 giờ. Thời gian bản thải không phụ thưộc vảo liều. Tuy
nhiên, thời gian bán thải bị kéo đải nếu chức năng thận suy giảm như trình bảy ở Bảng 10 dưới đây.
Bảng 10: Thời gian bán thải cùa dabigatran ở người tinh nguyện khỏe mạnh và ở người có chức năng
%
thận suy giảm
. . . Trun bình nhân % biến thiên trun bình nhân
Đọ 'ọ° °“ thạ“ (chD lgcvỂ/ol); giới hạn) tiiớ—i gian bản thải g
lmL/phủt] [giờ]
› 80 13,4 (25,7%; 11,0 - 21,6)
›50 - 5 80 15,3 (42,7%;11,7 - 34,1)
› 30 - 5 50 18,4 (18,5%;13,3 … 23,0)
5 30 27,2(15,3%; 21,6 … 35,0)
Sinh khả dụng tuyệt đối cùa dabigatran sau khi uống dabigatran etexilate với vỏ nang HPMC xấp xỉ
6, 5 %.
Thức ăn không ảnh hướng đến sinh khả dụng của dabigatran etexilate nhưng gây trì hoãn thời gian
đạt được nông độ đỉnh trong huyết tương khoảng 2 giờ
Sinh khả dụng đường uông có thể tăng lến khoảng 1, 8 lần (+75%) so với công thức viên nang tham
chiếu khi các hạt nhỏ được dùng không có vỏ nang HPMC Do đó, trên lâm sảng cần ]uôn luôn bảo
vệ tính nguyên vẹn của vỏ nang HPMC đế trảnh vô ý lảm tăng sinh khả dụng của dabigatran
exetilate. Vì thế, nên khuyến bệnh nhân không mở viên nang và tránh uống cảc hạt thuốc không
được bao bọc (ví dụ rắc thuốc vảo thức ãn hoặc cho vảo đồ uống) (xem “Liều lượng và cách dùng”).
Một nghiên cứu đảnh giá sự hấp thu của dabigatran etexilate sau phẫu thuật 1-3 giờ cho thẳy quá
trinh hấp thu bị chậm hơn so với người tình nguyện khớe mạnh, thế hiện bằng đường cong nồng độ -
thời gian bằng phẳng, không có nồng độ đỉnh tăng cao. Nồng độ đinh trong huyết tương đạt được sau
khi uông thuốc 6 giờ, hay khoảng 7- 9 gỉờ sau phẫu thuật (nghiên cứu BISTRO Ib). Tuy nhiên cũng
cần lưu ý là do ảnh hưởng của những yêu tố khác như gây mê, liệt dạ dảy ruột và tảc động phẫu
thuật, sẽ có một tỉ lệ bệnh nhân chậm hấp thu thuốc bất kể dạng bảo chế đường uống. Mặc dù nghiên
cứu nảy không dự đoản được lỉệu sự giảm hấp thu có tiểp tục xảy ra với cảc liều tiểp theo không,
một nghiên cửu khác đã cho thấy sự chậm và khó hấp thu thuốc thường chỉ xảy ra trong ngảy tiến
hảnh phẫu thuật. Trong các ngảy tiếp theo, dabigatran được hấp thu nhanh và nồng độ đỉnh trong
huyết tương dạt được trong khoảng 2 giờ sau khi uông.
Chuyến hoá và thải trừ dabigatran được nghiên cứu sau khi dùng một liều đơn tiêm tĩnh mạch đảnh
dấu bằng đồng vị phóng xạ ở những đối tượng nam giới khỏe mạnh. Sau một liều tiêm tĩnh mạch,
dẫn chắt dabigatran có hoạt tính phóng xạ được thải trừ chủ yếu qua thận (85%). Khoảng 6% liều
dùng được thải trừ qua phân. Khoảng 88 - 94% liều dùng đánh dấu đồng vị phóng xạ được thu thập
sau 168 giờ kể từ khi dùng thuốc.
Sau khi uống, dabigatran etexilate nhanh chóng chuyển thảnh dabigatran, dạng có hoạt tính trong
huyết tương. Quá trình chuyến tiền chất dabigatran etexilate thảnh hoạt chất chính dabigatran nhờ
enzym xúc tác thuỷ phân esterase là phản ửng chuyển hoá chủ yếu. Dabigatran lả một chất dễ kết
hợp tạo thảnh cảc acylglucuronidcs có hoạt tính dược lý. Có 4 chắt đồng phân vị trí, 1-0, 2—0, 3-0,
4- O— -acylglucuronide, mỗi chất chiếm khoảng dưới 10% tổng lượng dabigatran trong huyết tương.
Lượng rất nhỏ cùa các chắt chuyển hoá khảc chỉ được phát hiện nhờ những phương phảp phân tích
có độ nhạy cao Dabigatran được thải trừ chủ yếu dưới dạng không đổi trong nước tiêu vói tốc độ
khoáng ]00 mL/phút tương ứng với tốc độ lọc câu thận.
Sự găn kết của dabigatran vảo huyết tương người thì thấp (34- 35%) và không tùy thuộc vảo nổng
đội Thể tích phân bố của dabigatran khoảng 60— 70 L vượt quả thể tích nước của toản bộ cơ thể cho
thấy thuốc phân bố vảo mỏ ở mức trung bình.
Nhóm bệnh nhân đặc biệt
Suỵ thân
Trong một nghiên cứu pha 1, phân bố thuốc (ẠUC) dabigatran ở những người tình nguyện suy thận
trung bình (CrCL 30 — 50 mL/phút) sau khi uông dabigatran etexỉlate cao xâp xỉ 3 lần so với những
người không bị suy thận.
Ở một số ít người tình nguyện suy thận nặng (CrCL 10 - 30 mL/phút), nồng độ dabigatran cao gấp
khoảng 6 lân và thời gian bản thải kéo dải khoảng 2 lân so với quan sát ở người không bị suy thận
(xem phân Liều lượng và cách dùng và Chông chỉ định).
Thải trừ dabigatran nhờ lọc mảư đãÌ được nghiên cứu ở những bệnh nhân suy thận giai đoạn cuối
(ESRD) mã không bị rung nhĩ. Thâm phân được tiển hảnh với tôc độ chảy cùa dịch lọc là 700
mL/phút, kéo dải 4 giờ, tốc độ dòngmảu 200 mL/phủt hoặc 350 — 390 mL/phút. Phương phán nảy
loại bỏ tương ứng 50% hoặc 60% nông độ dabigatran dạng tự do hoặc toản phân. Lượng thuôc bị
loại bỏ nhờ thẩm phân thận tỷ lệ với tốc độ dòng mảư. Hoạt tinh chống đông mảư cùa dabigatran
giảm khi nồng độ trong huyết tưong giảm vả mối lỉên quan PK/PD không bị ảnh hưởng bời cảch
diều trị nảy.
Độ thanh thải creatinine trung vị trong nghiên cứu RE- LY lả 68, 4 mL/phút. Gần một nứa số bệnh
nhân trong nghiên cứu RE- LY (45, 8%) có CrCL >50- <80 mL/phủt. Nổng độ dabigatran trong
huyết tương ở bệnh nhân có độ suy thận trung bình (CrCL khoảng 30— 50 mL/phủt) tương ứng cao
gâp 2, 29 lần và 1,81 lần trước vả sau khi dùng liều tiếp theo so với những bệnh nhân không suy thận
(CrCL 2 80 mL/phút).
Người cao tuối. '
Cảc nghiên cứu dược động học pha 1 chuyên biệt trên người cao tuối cho thấy AUC tăng khoảng 1,4
đến 1,6 lần (+40- 60%) và Cmax tăng khoảng 1,25 lần (+25%) so với ở người trẻ tuổi.
Giá trị AUCt ,, vả Cmams ở những đối tượng cao tuối nam giới và nữ giới (> 65 tuổi) cao xấp xỉ 1,9
lần vả ] ,6 lần đối với nữ giới cao tuổi so với nữ giới trẻ tuổi vả cao hơn 2, 2 và 2, 0 lần đối vởi nam
giới cao tuổi so với nam giởi trong độ tuổi 18- 40.
@”
Tăng nổng độ dabigatran được quan sát có tương quan với sự giảm độ thanh thải creatinine liên quan
đến tuồì tảo.
Ành hưởng cùa tuổi tảo đến nồng độ dabigatran đã được khẳng định trong nghiên cửu RE- LY với sự
tăng khoảng 1, 3 lẩn (+ 31%) nông độ đáy đối với những đối tượng_ > 75 tuồi vả giảm khoáng 22%
nông độ đáy đối với những đối tượng < 65 tuối so với nhưng bệnh nhân trong độ tuổi 65 và 75.
Suv 2an.
Trong một nghiên cứu pha 1, nồng độ dabigatran không thay đổi ở 12 bệnh nhân suy gan trung binh
(Child Pugh B), so sảnh với 12 người thuộc nhóm chứng.
Phòng ngừa tai biển TTHKTM ở bệnh nhân sau đại phẫu chính hình
Bệnh nhân suy gan từ trung bình đến nặng (phân loại Child- -Pugh B và C) hoặc mắc bệnh gan được
cho lá có bất kỳ tác động nảo tới sự sống còn hoặc tăng men gan_ > 2 lần giới hạn trên cùa giá trị bình
thường (ULN) được loại trừ trong các nghiến cứu lâm sảng
Phỏng ngừa đột quỵ, thuyên Iẳc hệ thống và giăm rử vong do nguyên nhân mạch mảư ở những bệnh
nhân rung nhĩ:
Bệnh nhân mắc bệnh gan thể hoạt động nhưng không chỉ gìớì hạn ở việc gia tăng liên tục men gan 2
2 lân giới hạn trên cùa giá trị bình thường (ULN) hoặc viêm gan A, B hoặc C được loại trừ trong cảc
nghiên cứu lâm sảng.
Cân năng:
Nồng độ đảy của dabigatran lả thắp hớn khoảng 20% ở những bệnh nhân có cân nặng > 100 kg so
với bệnh nhân có khối lượng cơ thể từ 50 - 100 kg Phần lớn bệnh nhân (80,8%) có trọng lượng_ > 50
kg và < 100 kg vả không có khảc biệt rõ rả.ng nâo được phảt hiện Dữ liệu về những bệnh nhân 5 50
kg còn hạn chê.
Gìởl' lính:
Trong cảc nghiên cứu ban đầu cho phòng ngừa TTHKTM, nồng độ thuốc tăng khoảng 1,4 đến 1,5
lần (+40% tới 50%) ở bệnh nhân nữ. Trên cảc bệnh nhân nữ giới bị rung nhĩ, nông độ đáy và nồng
độ sau khi uống thuốc tăng trung bình khoảng 1,3 lần (+30%) Phảt hiện nảy không có ảnh hưởng
lâm sảng.
Chủm,7 tôc:
Dược động học của dabigatran được nghiên cứu trên người tỉnh nguyện da trắng và Nhật Bản dùng
liều đơn hoặc đa liều. Chủng tộc không ảnh hưởng tới dược động học của dabigatran tởi mức có ảnh
hưởng lâm sảng
Dữ liệu về dược động học cúa thuốc ở bệnh nhân da đen còn hạn chế vả không có gợi ý lá có khảc
biệt liên quan.
Tương tác dươc đỏng hoc:
Cảc nghiên cứu tương tác in vítro cho thấy không có sự ức chế hoặc cảm ứng hệ cytochrome P450
Điều nảy đã được khẳng định bẳng cảc nghiên cứu in vivo trên người tình nguyện khoẻ mạnh, không
thấy có tương tảc giữa điều trị dabigatran etexilate vả cảc thuốc sau: atorvastatin (CYP3A4) vả
diclofenac (CYP2C9).
Alorvastalin: Khi dabigatran được dùng đồng thời với atorvastatin, một cơ chất cùa CYP3A4, nồng độ
cùa atorvastatín, chât chuyên hóa atorvnstatin và của dabigatran lá không thay đôi cho thây không có sự
tương tảc.
Diclojènac: Khi dabigatran etexilate được dùng đồng thời với diclofenac, một cơ chất cùa CYP2C9,
dược động học của cả hai thuôc lá không thay đôi điêu nảy cho thây không có tương tảc giữa
đabigatran etexilatc vả diclofenac.
Cảo tương tảc với chất ức chếlcảm ứng P-l—lD
Tiền chẳt dabigatran etexilate, mã không phải lả dabigatran, lả một cơ chất cùa chất vận chuyến P-
glycoprotein (P-gp). Do vậy việc dùng đông thời với cảc chât ức chẽ và cảm ứng vởi chât vận
chuyên P-gp đã được khảo sảt.
Dùng đồng thời với chất ức chế P -gp
Amz'odarone: Khi dabigatran etexilate được dùng đồng thời vời một liều đơn dạng uống 600 mg
amiodarone, mức độ vả tỷ lệ hẳp thu cùa amiodarone và chất chuyến hỏa có hoạt tinh cùa thưốc nảy
lả DEA về cơ bản không thay dối AUC vả Cmax cùa dabigatran tương ứng lần lượt tăng khoảng 1,6
lần vả 1 ,5 lần (+60% và 50%). Trong nghiên cứu dược động học của dân số nghiên cứu RE—LY,
không có thay đổi đáng kể vê nông độ đáy dabigatran được quan sát ở những bệnh nhân dùng
amiodarone (xem mục “Tương tảc thuốc”).
Dronedarone. Khi dabigatran etexilate vả dronedarone được dùng cùng một thời điểm, cảc giá trị
AUCOỦ vả Cmax của dabigatran tương úng tăng khoảng 2, 4 lần vả 2, 3 iẩn (+136% vả 125%), sau khi
dùng đa liếư 400 mg dronedaronc hai lần môi ngảy, và khoảng 2, 1 lần và 1, 9 lần (+1 14% và 87%)
tương ứng sau khi dùng đớn lỉếu 400 mg Thời gian bản thải và thanh thải qua thận cùa dabigatran
không bị ảnh hưởng bới dronedarone. Khi dùng đợn liều và đa liếư dronedarone 2 giờ sau khi sử
dụng dabigatran, AUCO.,Otăng tương ứng gấp 1,3 lần vả 1,6 lần.
Verapamil: Khỉ dabigatran etexilatc được dùng đồng thời với verapamil dạng uống, Cmax vả AUC
cùa dabigatran tăng phụ thuộc vảo thời gian dùng và công thức của chế phấm verapamil.
Nống độ dabigatran tăng mạnh nhắt được quan sảt sau khi dùng một liều cùa dạng thuốc phóng thích
nhanh verapamil một giờ truớc khi dùng dabigatran etexilate (Cmax tăng khoảng 2 ,8 lần (+180%) vả
AUC tăng khoảng 2, 5 lần (+150%)) Tảo động giảm dần dần khi sử dụng dạng phóng thích chậm
(tâng C…ax khoảng 1,9 lần (+90%) vả AUC khoảng 1,7 lần (+70%)) hoặc dùng nhiếu liếư vcrapamil
(tăng Cmax khoảng 1,6 lần (+60%) vả AUC khoảng 1,5 lần (+50%)). Điếu nảy có thế được giải thích
do sự cảm ứng P- -gp trong ruột do điếu trị verapamil kéo dải
Không có tương tác có ý ngiữa được quan sảt khi verapamil được dùng 2 giờ sau khi dùng dabigatran
etexílate (tăng C…ax khoảng 10% và AUC khoảng 20%). Điều nảy được giải thích do dabigatran được hắp
thu hoản toản sau 2 giờ (xem Liều lượng và cảch dùng).
Không có dữ lìệu sẵn có cho dạng tìêm cùa verapamil; dựa vảo cơ chế tương tảc, có thế không có
tượng tác có ý nghĩa.
Trong nghìên cứu dược động học của dân số nghiên cứu RE-LY, không có thay đối đảng kể về nồng
độ đáy dabigatran được quan sảt ở những bệnh nhân dùng verapamỉl (xem mục “Tượng tảo thuốc”).
Ketoconazole: Kctoconazolc toản thân gây tăng toản bộ các giá trị AUC…o vả Cmax của dabigatran
tương ứng khoảng 2,4 lần (+138% và 135%) sau khi dùng liếư đơn 400 mg, vả tương ứng khoảng 2,5 lần
(+153% vả 149%) sau khi dùng đa liều 400 mg ketoconazolc ngảy 1 lần. Ketoconazole không ảnh
hưởng đến thời gian đạt nồng độ đỉnh, thời gian bán thải và thời gian tồn lưu trung bỉnh trong cơ thể của
thuốc.
Clarithromycin: Khi sử dụng clarithromycin 500 mg hai lần mỗi ngảy cùng với dabigatran etexilate,
không có tương tác dược động học có ý nghĩa trên lâm sảng được ghi nhận (tảng Cmax khoảng 15% và
AUC khoảng 19%).
Quinidine: Quinidinc được dùng với lìều 200 mg mỗi 2 giờ cho tới tổng liều 1000 mg. Dabigatran
etexilate được dùng hai lần mỗi ngảy trong 3 ngảy liên tiếp, vảo ngây thứ 3 có hoặc không có
quinidine. AUC… vả C…,ms của dabigatran tãng trung bình khoảng 1,5 lần (lần lượt +53% vả 56%)
với việc dùng đống thời quinidine.
Ticagrelor: Khi dùng đồng thời líều đơn dabigatran ctexilate 75 mg với một liếư tải ticagrelor 180 mg,
AUC vả c…ax của dabigatran tường ứng tãng 1,73 lần và 1,95 lần (tăng 73% và 95%). Sau khi dùng đa
liếư ticagrelor 90 mg hai lần một ngảy, mức tăng AUC vả Cmax của dabigatran ít hcm, tương ứng còn 1,56
lần và 1,46 lần (tăng 56% và 46%).
Dùng cùng vởi cơ chất cùa P- -gn
Digoxz'n: Khi dabigatran ctexilatc được dùng cùng vói digoxin, một cơ chất P-gp, không có tương tác
vê được động học được ghi nhận Cả dabigatran và tiền chất dabigatran etcxi1atc đều không ức chế
P- -gp trên lâm sảng
Sứ dung cùng với chất cảm ứng P- 20
Rijampicine: Cảc liếư thăm dò trước của chất gây cảm ứng như rifamicine ở liều 600 mg ngảy ] lần
trong 7 ngảy lảm gỉảm cả nồng độ đinh và nổng độ toản phần dabigatran tượng ứng lả 65, 5% và
67% Tảc động gây cảm ứng bị gỉảm dần dẫn đến nồng độ dabigatran gân bằng với mức tham chìếu
ờ ngảy thứ 7 sau khi ngừng điếu trị rifampicine. Không thấy sinh khả dụng tăng thêm sau 7 ngảy
nữa.
Sử dung cùng với các chất ức chế kết tân tìều cầu
AceMsalyơlic acid (ASA): Tác động cùa việc dùng đồng thời dabigatran etcxìlate vả acid acctylsalicylic
(ASA) vê nguy cơ xuất huyết đã được nghiên cứu trên những bệnh nhân rung nhĩ trong một nghiên cứu
pha H trong đó việc sử dụng ASA ngẫu nhiến được ảp dụng Căn cứ vảo phân tích hồi qui logistic, việc sử
dụng ASA cùng với dabigatran etexilate 150 mg hai lần mỗi ngây có thế lảm tăng nguy cơ gây chảy mảư
từ 12% đến 18% và 24% tường ứng khi dùng liền 81 mg và 325 mg ASA.
Từ cảc dữ liệu thu được trong nghiến cứu pha III RE-LY, đã quan sảt thấy ASA hoặc clopidogrel sử dụng
cùng với dabigatran ctexilate ờ liếư 110 hoặc 150 mg hai lần mỗi ngảy có thể gây tãng nguy cơ chảy mảư
nậng. Tuy nhiên tỷ lệ bíến cố chảy mảư cao hơn khi dùng cùng với ASA hoặc clopidogrel cững được ghi
nhận đối với warfarin
Sử dụng NSAID để giảm đau trong thời gian ngắn trước hoặc sau phẫu thuật không lảm tãng nguy
cơ chảy mảư khi điếu trị kết hợp với dabigatran etcxilate. Bằng chứng vê việc sử dụng thường xuyên
NSAID có thời gian bán thải dưới 12 giờ trong quá trình điểu trị với dabigatran etcxilate còn hạn chế
và chưa cho thấy tăng nguy cơ chảy máu.
NSAID lảm tăng nguy cơ chây mảư trong nghiên cứu RE-LY ở tất cả cảc nhớm điếu trị.
Clopỉdogrel: Trong một nghiên cứu pha 1 ở nam giới tình nguyện khỏe mạnh, việc sử dụng đồng thời
dabigatran etexilate vả clopidogrel không lảm kéo dải thêm thời gian chảy mảư mao mạch (capillary
blceding time) so với đợn trị liệu clopidogrel. Thêm vảo đó, AUCLss vả Cmax_ss cùa dabigatran vả cảc
xét nghiệm đông máu để đánh giá tảc dụng của dabigatran như aPTT, ECT, hoặc TT (khảng FIIa)
hay xét nghiệm đánh giá khả nãng ức chế kết tập tiếu cẳu (IPA) của clopidogrel về cơ bản lả không
thay đồi khi điều trị kết hợp so với cảc đơn trị liệu tượng ứng. Với một liếư clopidogrel ban đầu lên
tới 300 hoặc 600 mg, AUC… vả cm,, cùa dabigatran tăng khoảng 1,3 đến 1,4 lần (+ 30 tới 40%).
(xem cảc mục ở trên về ASA).
Các chất chống kết tập tiếu cẳu và chống đông máu khảo: Sử dụng đồng thời dabigatran etexilate vả
các chất chống kết tập tiếu cầu hoặc chống đông mảư khảo có thế lảm tăng nguy cơ chảy mảư (xem
Cảnh báo đặc biệt và thận trọng).
Sứ dung đồng thời với cảc chẳt ức chế tải hấp thu serotonin có chon ]oc:
SSRIs lảm tăng nguy cơ chảy máu trong tất cả các nhóm điều trị trong nghiên cứu RE—LY.
Sử dung cùng với cảc chất lảm tăng DH da dảv
Pantoprazole: Khi dabigatran được sử dụng cùng với pantoprazolc, đã quan sảt thấy giảm diện tích
dưới đường cong nồng độ- thời gian trong huyết tương của dabigatran khoảng 30%. Pantoprazole và các
chất ức chế bơm proton được sử dụng cùng với dabigatran etcxilate trong cảc nghiên cứu lâm sảng vả
không ghi nhận ảnh hưởng lên tình ưạng chảy mảư hoặc hiệu quả.
Ranitiđz'ne: Sử dụng ranitidine cùng với dabigatran etexilate không gây ảnh hướng có ý nghĩa lến
mức độ hấp thu của dabigatran.
Những thay đổi trong nồng độ dabigatran, được xác định bắng phân tích dược động học dân số, gây
ra bời thuốc ức chế bơm proton (PPI) vả cảc thuốc khảng acid được xem lá không có ý nghĩa lâm
sảng do tảc động ít (gỉảm rât ít sinh khả dụng, không đảng kể đối với thuốc kháng acid vả 14, 6% đối
với cảc PPI Trong nghiên cứu pha III, RE- LY, sử dụng cùng với PP] không lảm gíảm nồng độ đáy
và nhìn chung chỉ gây giảm nhẹ nồng độ sau khi đùng thuốc (-11%). Do vậy, sử dụng cùng với PPI
dường như không lảm tăng tỷ lệ đột quỵ hoặc thuyên tắc hệ thống, đặc biệt trong so sảnh với
warfarin, vả vì thế, giảm sinh khả dụng do sử đụng cùng với pantoprazole được cho lá không có ý
nghĩa lâm sảng.
Điều kiên bảo guản
D:,ng vỉ :
Bảo quản nguyên trong bao bì để tránh ấm. Bảo quản không quá 30°C
Dạng chai :
Sau khi mở chai, chỉ sử dụng thuốc trong 04 tháng.
Đóng chặt nắp chai thuốc. Bảo quản nguyên trong bao bị để tránh ấm. Bảo quản không quá 30°C.
Trình bâv
Viên nang cứng tương ứng 75mg, 1 lOmg vả 150mg.
Dạng trinh bảy với hảm lượng 75mg vả llOmg: Hộp carton chứa 01 chai 60 viên hoặc 1, 3, 6 ví x 10
v1cn nang.
Dạng trình bảy với hảm lượng lSOmg: Hộp carton chứa 3 vì x 10 viên nang.
Han dùng
30 tháng kế từ ngảy sản xuất
Sản xuất bởi
Boehringer Ingelheim Pharma GmbH & Co.KG
Bingcr Str.l73, 55216 Ingelheim am Rhein, Germany.
ĐOC Kỹ HƯQNG DẨ1~J SỬ DỤNG TRỰớợ KHI DÙNG
NỄU CAN THEM THONG TIN XIN 1101 Y KIÊN BÁC sỹ
PHÓ cục muớne
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng